Персонализированная медицина (от англ. personalized medicine), или прецизионная, индивидуализированная медицина, – совокупность методов профилактики патологических состояний, диагностики и лечения, основанных на индивидуальных особенностях пациента. Ряд авторов определяют ее как подход к улучшению качества медпомощи путем использования информации о биомаркерах и молекулярных путях заболевания, геномике, протеомике, метаболомике [1]. Однако к индивидуальным особенностям пациента относят также совокупность фенотипических признаков. Еще корифеи отечественной медицины А.Я. Мудров, С.П. Боткин, И.М. Сеченов и др., обосновывая индивидуальный подход к ведению пациента, применяли строго определенную схему его обследования – историю болезни, в которой рассматривались не только факторы наследственности, но и психологические, физиологические, приобретенные качества и симптомы, проявляющиеся в определенных условиях жизни. В 1990-х гг. Л. Голланд (США) интегрировал все эти факторы с современными фундаментальными методами дифференциальной диагностики болезней (методиками молекулярной медицины, геномикой, постгеномной биологией и др.) и тем самым усилил концепцию прецизионной медицины.
Одно из направлений индивидуализированной медицины – персонализированная нутрициология. В данной области большое внимание уделяется не только уже имеющимся подходам, но и форсайт-исследованиям, прогнозирующим огромное будущее данному направлению науки. Это отражено в стратегии научно-технологического развития России до 2035 и 2040 гг., утвержденной указом Президента РФ № 642 от 01.12.2016 [2]. В основу указа положен проект Федерального агентства научных организаций, Фонда «Центр стратегических разработок «Северо-Запад» и Российского научного фонда по прогнозированию перспектив развития научных тематик, опирающийся на метод Disruptive Foresight. В проекте приведены:
а) описание больших вызовов, стоящих перед исследователями в сфере нутрициологии;
б) описание существующих мегатрендов в нутрициологии и возможностей их масштабирования;
в) анализ прорывных направлений, способных изменить парадигму нутрициологии уже сегодня.
Нам при анализе литературы удалось выделить два основных стратегических направления персонализированной нутрициологии – производственно-технологическое и медико-технологическое (рис. 1).

В соответствии со стратегией научно-технологического развития России в качестве приоритетных направлений на период до 2025 г. по первому направлению определены:
- запрос общества на здоровое питание и потребность в развитии соответствующей индустрии;
- развитие системы безопасности пищевых продуктов;
- сохранение биоактивных веществ в пищевых продуктах и определение их качества.
При этом если особенности технологий создания продукции для диетологической персонализированной профилактики уже приводятся в многочисленных публикациях, то в отношении специализированных продуктов парентеральной и энтеральной алиментации, а также иных строго медицинских вопросов (индивидуальная диагностика метаболических нарушений, технологии нутритивной реабилитации больных, нутритивная поддержка паллиативных пациентов в онкологии и др.) прогноз прорывного эффекта в соответствии с тайм-лайн-развитием основных событий нутрициологии по результатам форсайт-исследований планируется лишь на 2030–2050 гг. [2]. Таковы реалии больших вызовов, на которые будет отвечать нутрициология в долгосрочной перспективе, где одним из мегатрендов выделяется теория персонализированного питания как необходимое условие адаптации к индустриальному образу жизни.
К прорывным технологиям при этом отнесены:
а) омиксные технологии (в частности, персонализированная нутрициология и микробиота);
б) создание продуктов для активного долголетия, в т.ч. с помощью 3D-печати;
в) открытие новых фармаконутрицевтиков и создание пищевых структур для повышения их доступности;
г) специальное питание для больных, в т.ч. с онкопатологией;
д) нутригеномика;
е) использование гаджетов для обеспечения расчетного питания;
ж) открытие механизмов молекулярного действия биоактивных веществ и др.
В отношении ряда медицинских направлений в настоящее время уже имеются фундаментальные наработки, которые могут быть положены в основу мегатрендов и прорывных технологий персонализированной нутрициологии.
Одна из базисных концепций персонализированной медицины (и нутрициологии, в частности) – генетические исследования. В долгосрочном прогнозе до 90% лекарств могут уйти с рынка (карди-, гастропротекторы и др.), а индивидуализированное нутриционное лечение выйдет на первый план [3]. Ведущее место в этом направлении принадлежит омиксным наукам (рис. 2).
Омиксные технологии – один из драйверов современной науки.
Так, нутригеномика изучает влияние употребляемой пищи на обмен веществ. На каждый из сотен нутриентов, предписанных человеку природой, «работает» по нескольку генов, организующих усвоение. Некоторые авторы занимаются вопросами пищевого поведения, определением индивидуализированного рациона по ДНК-тесту [4–6,10 и др.]. Главные задачи нутригеномики:
а) исследование влияния питания на метаболические процессы и контроль гомеостаза;
б) оценка регуляции на этапах формирования болезней, ассоциированных с питанием;
в) изучение взаимосвязей патогенеза болезней с индивидуальным геномом человека, т.е. биохимической связи между составом пищевого продукта и ДНК потребителя (табл. 1), уточнение механизмов влияния питания на генотип, исследование обменных процессов на молекулярном уровне и выявление метаболических связей, не открытых ранее [7–9 и др.].
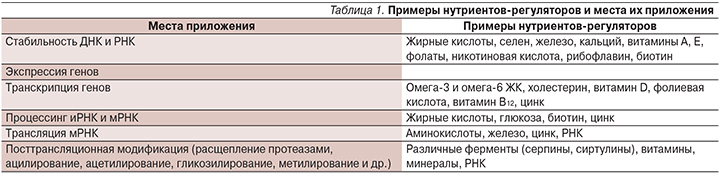
Таким образом, цель нутригеномики – оценка риска и пользы определенных диет и их компонентов, научное обоснование индивидуализированного питания.
Нутригенетика – другая наука, свидетельствующая, что пищевые предпочтения различных людей определяются небольшими отличиями в их ДНК. Благодаря такому полиморфизму каждый человек усваивает пищу по-своему: один неплохо потребляет жирную пищу, другой – углеводную. Так, оказалось, что у людей имеется от 2 до 15 копий гена AMY1 (отвечает за слюнные ферменты, начинающие расщепление крахмала в полости рта) и чем больше у человека копий этого гена, тем лучше он переваривает углеводы. При построении пищевых рационов учитывается не только потребность человека в количестве углеводов, но и соотношение легко- и медленноусвояемых углеводов (т.е. сахаров и крахмала, гликогена). При этом ген DNA-PK способствует превращению углеводов в жировые отложения, тем самым формируя лишний вес [11, 12]. Так как содержание сахара в крови при потреблении крахмалов нарастает постепенно, целесообразно лицам, страдающим сахарным диабетом, атеросклерозом, ожирением, на 80–90% удовлетворять углеводные потребности за счет медленновсасывающихся углеводов. Известны гены обмена и усвоения витаминов A, C, D, E, группы B и др., металлов (железа, цинка, селена, хрома и др.), гены расщепления жиров, обмена углеводов, усвоения белка [13, 14]. Средиземноморская кухня с множеством фруктов, овощей, оливкового масла, которые обладают восстановительным действием, имеет авторитет в здоровом питании. Однако в генетической составляющей лиц, проживающих в средиземноморских странах, доминирует определенный генный полиморфизм (АпоЕ2), при котором эта кухня полезна. В Центральной Европе его практически нет, вместо него присутствует АпоЕ4-полиморфизм, при котором образуются атерогенные ЛПНП (липопротеиды низкой плотности)-частицы. Это означает, что четверть населения считает, что питается правильно, употребляя средиземноморскую кухню, однако из-за своей генетической предрасположенности питается неправильно. Анализ полнотранскриптомных профилей позволил установить группы генов, являющихся мишенью для ряда алиментарных факторов: общих жиров, фруктозы и холестерина [15]. Полученные данные позволили авторам сделать вывод о больших перспективах использования полнотранскриптомного профилирования на ДНК-микрочипах в качестве высокочувствительного скринингового метода для поиска новых молекулярно-генетических маркеров алиментарно-зависимых заболеваний, а в будущем определять молекулярные механизмы влияния нутриентов на уровни экспрессии различных генов и осуществлять персонализацию диетотерапии. Известно также, что и энергетический дисбаланс организма обусловлен генетическими полиморфизмами. Результаты проведенных исследований полиморфизмов rs9939609 гена жировой массы (FTO) и rs4994 гена β3-адренорецептора (ADRB3) свидетельствуют об их связи с риском развития ожирения и сахарного диабета 2 типа [16]. Данные изучения энергетического обмена у лиц с полиморфизмом rs9939609 гена FTO и Trp64Arg гена β3-адренорецепторов, как считают авторы, могут косвенно свидетельствовать о существовании лептин-опосредованного механизма зависимости между полиморфными вариантами rs9939609 гена FTO, rs4994 гена ADRB3 и выраженностью энергетического дисбаланса [16].
Метаболомика – научное направление, занимающееся изучением низкомолекулярных соединений, входящих в состав метаболома, т.е. комплекса всех низкомолекулярных (не более 1 кДа) метаболитов в клетке, ткани, органе, биологической жидкости, являющихся промежуточными или конечными продуктами обмена веществ. Ее цель – изучение ответной реакции организма на какое-либо патофизиологическое воздействие. В результате любого воздействия на организм происходят изменения концентраций метаболитов в крови, моче, семенной, фолликулярной или церебральной жидкости. Анализируя полученные метаболические профили, получают своеобразные «отпечатки» (finger print), отражающие физиологическое состояние организма [17, 18] и являющиеся маркерами заболеваний и участниками обменных (в т.ч. нутритивных) процессов. Например, при исследовании биоптатов молочной железы выделено около 30 эндогенных концентрационно изменяющихся тканевых метаболитов (маркеров опухолей): растет уровень фосфохолина, понижается уровень глицерофосфохолина и глюкозы [19]. Для диагностики колоректального рака (КРР) некоторые авторы, определяя метаболомический профиль сыворотки крови, считают показатели α-оксимасляной (2-оксибутановой), аспарагиновой кислот, кинуренина и цистамина даже более чувствительными, чем стандартные онкомаркеры, – раково-эмбриональный антиген (РЭА) и СА-19 [20], а Y. Qiu в качестве маркеров КРР определял фенилуксусную и парагидроксифенилуксусную кислоту в моче [21, 22]. Подобных исследований достаточно много [23–25 и др.]. Однако следует отметить, что, участвуя в процессах усвоения нутриентов, метаболиты могут служить и основой для расчета персонализированного питания [26]. В последнее десятилетие особое внимание уделяется продуктам промежуточного обмена, которые являются маркерами – регуляторами усвоения рационов. Так, рост уровня таких маркеров, как ацетон, ацетоуксусная и β-оксимасляная кислоты [26], свидетельствует о дефиците углеводов (например, при сахарном диабете, голодании), который приводит к обеднению печени гликогеном и усиленному поступлению в нее жира. Этому способствует также недостаточный ресинтез высших жирных кислот из кетоновых тел и нарушение их окисления в трикарбоновом цикле. Недостаточное окисление кетоновых тел связано также с дефицитом соединений, образующихся при промежуточном обмене углеводов (пировиноградная и щавелевоуксусная кислоты) и являющихся субстратами цикла трикарбоновых кислот. Продукты расщепления жиров превращаются в жировые вещества, характерные именно для данного организма. К промежуточным продуктам липогенеза относится и пальмитил-КоА, участвующий в β-окислении. Пальмитил-КоА может подвергаться этерификации при взаимодействии с гидроксильными группами α-глицерофосфата, образуя фосфатидную кислоту, которая представляет собой ключевой промежуточный продукт в процессах биосинтеза как жиров, так и фосфолипидов, являющихся составной частью биомембран [27]. Не останавливаясь на биохимических аспектах проблемы, подчеркнем еще раз, что каждый из промежуточных продуктов свидетельствует о целесообразности заместительного или корригирующего фармаконутритивного воздействия. Такая коррекция необходима, например, лицам с энцефалопатией гипоэнергетического типа (при ферментопатиях глюконеогенеза, гликолиза, окисления жирных кислот, недостаточности митохондриальных дегидрогеназ), когда развивается такая же клиническая симптоматика, как и при токсических энцефалопатиях (рвота, сонливость, кома), но с выраженной мышечной гипотонией, гипорефлексией, кардиомиопатией, сосудистой недостаточностью и коллапсом, внезапной смертью. Индивидуальный подбор частично гидролизованных рационов или заместительное введение ферментов-фармаконутриентов – одна из возможностей повышения качества жизни таких пациентов.
Разрабатывая диагностическую панель для колоректального рака (КРР), Y. Cheng использовал метаболиты мочи – лимонную, гиппуровую, 2-аминомасляную, миристиновую и кинуреновую кислоты, паракрезол и путресцин, являющиеся продуктами совместного метаболизма организма-хозяина и микробиоты кишечника [28]. Это свидетельствует о том, что не только в области влияния продуктов обмена нутриентов на диагностику, течение заболевания или его профилактику, но и в сфере баланса между компонентами пищи и сложным сообществом кишечных бактерий (кишечной геноэкологией) также уже имеются наработки.
В плане персонализированной нутрициологии (подбора схем нутритивной коррекции) микробиому уделяется в последнее время огромное внимание. Микробиота кишечника человека представляет собой сложную экосистему, которая оказывает большое влияние на метаболизм организма-хозяина (человека) [29, 30, 33]. В настоящее время ее изучают на геномном, протеомном, метаболомном уровнях. И оказалось, что кишечная микробиота, ее состав дают индивидуально-специфическую реакцию на те или иные нутриенты, влияет на их усвоение. В частности, нами в Московском клиническом научном центре показано влияние метаболитов микробиоты кишечника (исследовали спектр и активность короткоцепочечных жирных кислот [КЦЖК] в копрофильтрате) на его моторику после субтотальных дистальных резекций желудка (рис. 3).
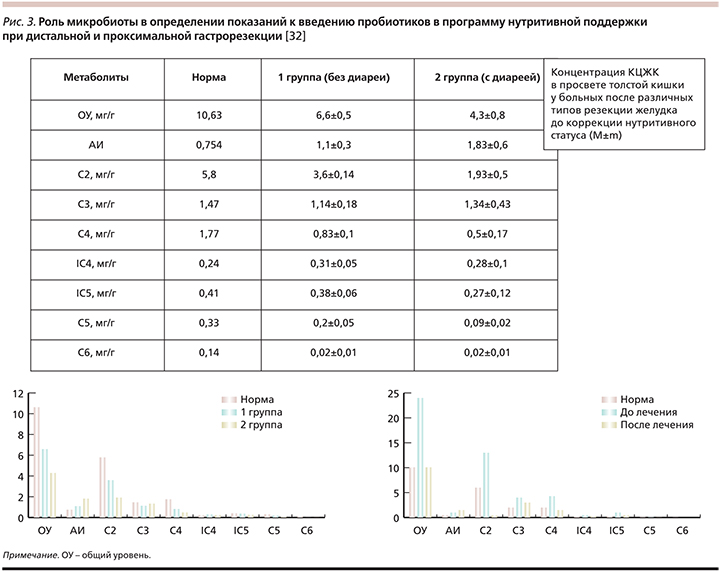
При сопоставлении концентраций КЦЖК с эвакуаторной функцией кишечника выделены три варианта активности кишечной микробиоты:
- у трети пациентов отмечены супервысокие концентрации КЦЖК кала, что свидетельствовало о синдроме повышенного бактериального обсеменения (СИБР) и нутритивной недостаточности, связанной с диарейным синдромом;
- у 38% наблюдавшихся было снижение уровня всех видов КЦЖК в копрофильтрате при наличии гипермоторной дискинезии кишечника, что наблюдалось при демпинг-синдроме, сопровождавшемся также снижением показателей статуса питания;
- в спектре КЦЖК отмечали снижение концентраций отдельных КЦЖК при нормальном или сниженном их общем содержании, что расценивалось как функциональная слабость толстокишечной микробиоты, сопровождавшаяся снижением переваривания пищевых волокон с развитием белково-энергетического дисбаланса организма. В первом случае назначали антибактериальную терапию, во втором применяли известную терапевтическую или хирургическую тактику, в третьем случае успешно использовали пре- и пробиотики.
При изучении механизмов развития нутриционной недостаточности вследствие постколэктомического (ПКЭС) и постколрезекционного (ПКРС) (после лево- или правосторонней гемиколэктомии) синдромов была также установлена огромная роль микробиоты. Дело в том, что в норме снижение рН при образовании КЦЖК приводит к тому, что аммиак, образующийся в толстой кишке при микробном преобразовании белков и аминокислот, переходит в ионы аммония, которые не могут свободно диффундировать через кишечную стенку в кровь, а выводятся в виде аммонийных солей с калом. Другой механизм детоксикации, связанный с микрофлорой толстой кишки, связан с преобразованием билирубина в уробилиноген, который частично всасывается и экскретируется с мочой, а частично выводится с калом. При ПКЭС эти механизмы отсутствуют и постепенно развивается эндотоксикоз, требующий коррекции (в т.ч. с помощью фармаконутрицевтиков и специальных препаратов нутриционной поддержки). В последнее время приобрели актуальность вопросы детоксикации при химиотерапии рака, в которой также участвует микробиота. Эндогенное отравление при онкологии обусловлено влиянием на организм сразу нескольких факторов:
а) нарушением процессов метаболизма;
б) распадом злокачественной опухоли;
в) накоплением применяемых во время лечения лекарственных препаратов;
г) выделением опухолями специфических веществ (PIF и др.);
д) осложнениями химиотерапии или лучевой терапии.
У каждого метода детоксикации (форсированный диурез, перитонеальный диализ, энтеросорбция, плазмаферез, гемодиализ и фильтрационные методы, непрямое окисление крови, гемосорбция) имеются свои показания и противопоказания. Известна детоксикационная роль белков (существует специфическая система биоабсорбции для глутатиона), липидов, особенно омега-3. Мы подтвердили дезинтоксикационный эффект микробиоты, оказываемый препаратами бифидо- и лактобактерий (в структуре программ нутритивной коррекции применяли имевшиеся в клинике пробиотики различных групп: Аципол, Линекс, Бифинорм, Бактисубтил и др.).
Детоксикационное питание как разновидность персонализированного питания
В последние годы действует и такое понятие, как детоксикационное питание [34], представляющее собой профилактическое и лечебное направление у лиц, работающих или проживающих на загрязненных территориях, а также подвергающихся воздействию производственных токсикантов.
В отношении поиска новых нутрицевтиков проводились крупные клинические испытания жировых эмульсий (ЖЭ) не только как энергетического компонента парентерального питания, но и как фармаконутрицевтика, т.е. нутриента с конкретными фармакологическими свойствами. Например, это относится к противовоспалительному эффекту (анти-SIRS-ответу) ω-3 и ω-6ЖК (рекомендовано соотношение ω-6 и ω-3 – от 4:1 до 2:1) [35]. Использующиеся в составе суппортана эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК) позволяют поддерживать энергообеспечение у онкологических пациентов. Весьма распространен фармаконутрицевтик глутамин, применяемый также в структуре парентеральной или энтеральной нутриционной коррекции в виде дипептивена или интестамина соответственно. Глутамин – предшественник синтеза нуклеотидов, субстрат для глюконеогенеза, важный фактор для синтеза протеинов и медиаторов (в частности, нейротрансмиттеров), а также компонент, предотвращающий иммунодепрессию, антиоксидативный стресс и атрофию слизистой оболочки кишечника, снижающий интенсивность бактериальной транслокации, являющийся метаболическим источником энергии, «топливом» для желудочно-кишечного тракта [38]. Учитывая роль окислительного стресса в патологии и при загрязнении окружающей среды, большое значение уделяют в качестве фармаконутрицевтиков антиоксидантам. Роль микроэлементов в обеспечении индивидуализированного питания связана с их регуляторной функцией в структуре молекулярных сигнальных путей. Так, в рацион рекомендуется вводить нутриенты и фармаконутриенты, ограничивающие пролиферацию, инвазию или ангиогенез опухолевой ткани и стимулирующих ее апоптоз путем влияния на экспрессию ряда генов. Например, 6-гингерол, содержащийся в имбире, индуцирует клеточную гибель с характерной фрагментацией ДНК благодаря торможению экспрессии Bcl2 в лейкозных клетках in vitro. Лютеин, содержащийся в красном перце, снижает экспрессию Bcl2 и повышает экспрессию Bax, стимулируя при этом апоптоз клеток. По-видимому, витамины, участвующие в метаболических путях, могут также рассматриваться как фармаконутриенты. Подобных исследований в настоящее время достаточно много, и они составляют основу фармакологии питания.
Персонализация нутриционной поддержки в зависимости от характера заболевания
Персонализация нутриционной поддержки в зависимости от характера заболевания – давно сложившееся направление. В целом диетология и нутрициология основаны на рекомендациях для конкретных нозологических форм. Однако современный подход предполагает модифицировать такие диеты, подстраивая их под индивидуальные особенности каждого больного. В частности, при диабете помимо известной диеты для диабетиков в целях индивидуализированной нутриционной реабилитации ряд авторов [36, 37] опираются на ω-3-индекс (Ω-3-индекс равен процентному содержанию ЭПК+ДГК в мембране эритроцита, а следовательно, в мембране каждой клетки нашего организма). Содержание и соотношение этих ЖК в мембране клетки коррелируют с инсулинорезистентностью, что позволяет назначать диету с повышенным или менее высоким содержанием ω-3 индивидуально, выбирать соотношение ω-3 и ω-6.
Разработаны специальные продукты для покрытия специфических потребностей в метаболических субстратах и для больных раком. Они характеризуются высокой калорийностью, высоким содержанием белков и жиров, ω-3 ЖК, особенно таких, как ЭПК и ДГК (например, продукт суппортан), высоким содержанием клетчатки (фрезубин-2), гидролизованного белка (провайдЭкстра, нутрихим-2), глутамина, каннабиноидов, нестероидных противовоспалительных средств, карнитина и др. Известно, что ω-3 ЖК антагонизируют действие медиаторов раковой кахексии – ПИФ (протеолиз-индуцирующий фактор) и ЛМФ (липид-мобилизующий фактор) [36], ослабляют острофазный ответ пациентов с раковой кахексией [37], ингибируют рост злокачественных опухолей, усиливают эффект противоопухолевой терапии. Глутамин повышает активность клеток-киллеров, выработку глутатиона, ингибирует рост опухоли. Прокинетики оказывают дофаминергическое действие, снижают эффект быстрого насыщения и тошноты, талидомид ингибирует синтез фактора некроза опухоли α (ФНО-α), снижает потерю массы тела, купирует кахексию. Карнитин оказывает положительное влияние на качество жизни, снижает утомляемость и др. На этой основе созданы противоатеросклеротические диеты, специальные рекомендации для больных целиакией, язвенным колитом, ркомендации для урологии, нефрологии, гастроэнтерологии, нутритивные продукты различных фирм для пульмонологии, для пациентов, находящихся на диализе и т.д.
Нами проведены исследования нутритивного статуса, определены рекомендации, созданы и внедрены в производство питательные смеси для персонализированной нутритивной поддержки в зависимости от характера операции на кишечнике и типа адаптации. На сегодняшний день в зависимости от клинических проявлений последствий укорочения кишечника и нутриционной недостаточности при них можно выделить несколько типичных вариантов синдромов оперированного кишечника [39]:
а) синдром короткой кишки трех типов с подтипами в зависимости от уровня и объема резекции (длина сохраненной части свыше 2 м, длина сохраненной части от 200 см до 50 см, суперкороткая часть длинной менее 50 см);
б) постколэктомический синдром (в различных вариантах в зависимости от ведущей симптоматики и функционального резерва оставшейся части кишки);
в) синдром последствий сочетанных тонко-толстокишечных резекций.
Для каждого из типов этих синдромов нами описаны варианты нутриционно-метаболических последствий и созданы специальные нутриционные рецептуры для приема перорально и через зонд, или стому [40]. При концевых стомах в зависимости от характера операции (стома в верхних или нижних отделах тонкой кишки, стомы в различных отделах ободочной кишки) используется питание через рот с различными фармаконутриентами или без них.
Рационы специализированного персонализированного зондового питания
Хотя в соответствии с программой развития нутрициологии решение проблем энтерального и парентерального питания намечены лишь на 2030 г., в настоящее время уже созданы некоторые специализированные продукты клинической алиментации направленного действия (для пациентов с почечной, печеночной недостаточностью и др.). Например, Ренилон закупается для питания больных почечной недостаточностью, находящихся на диализе. В РФ существуют Нутриэн-гепа, Нутриэн-нефро и созданные нами Нутрихим и Нутрозим для алиментации пациентов с печеночной, почечной, кишечной недостаточностью соответственно. В то же время эти продукты созданы с учетом особенностей, связанных с характером патологии или выполненной операции, но могут в дальнейшем быть усовершенствованы путем выявления индивидуальных генотипических и иммунотипических предпочтений каждого конкретного индивида.
Не менее важным, чем исследование маркеров персональной интолерантности к тем или иным нутриентам, является индивидуальная синдромная диагностика нутриционных нарушений [40], определяющая выбор программы их коррекции. В этом плане наиболее совершенной в последнее время признается оценка нутриционного статуса по критериям т.н. алиментационно-волемического диагноза по Л.Н. Костюченко (табл. 2).

Программы персонификации в зависимости от выявленных метаболических нарушений
На сегодняшний день существует множество разнообразных рекомендательных диет. Однако диета, которая помогла одному человеку, может оказаться неэффективной или даже вредной для другого. Причины различны. Возможно резкое изменение экспрессии генома как целостного ответа на диету (в этом случае мониторинг экспрессии генома проводят на уровне транскриптов, образующихся с определенных генов, на уровне белков и метаболитов). Возможны также, как указывалось выше, и эпигенетическое («надгенетическое», без изменения последовательности генома), и метаболическое программирование на определенных стадиях жизни человека, результаты которого проявляются на более поздних стадиях жизненного пути и даже в последующих поколениях. Персонализированная диета в этом случае означает, что питание подобрано с учетом индивидуальных потребностей конкретного человека в зависимости от его стадии жизни, стиля жизни и жизненной ситуации, в которой человек находится.
Новый методологический подход к созданию персонализированной элиминационной диеты при пищевой непереносимости, обусловленной иммунопатологическими реакциями III типа
В исследованиях статистических характеристик распределений иммунных откликов выявлено, что вид их частотного спектра уникален и персонифицирован для иммунной системы конкретного человека, может играть роль специфического маркера гиперчувствительности по иммуноглобулин G (IgG)-признаку [41]. Иными словами, процессы нарушения иммунологической толерантности к пищевому антигену (пАГ) связаны с функциональными и микробиотическими дисбалансами эпителиального барьера кишечника, активности толл-рецепторов дендритных клеток, макрофагов, В-лимфоцитов и приводят к активному трансцитозу недорасщепленных до мономеров пищевых антигенов во внутреннюю среду. Иллюминация подобных пАГ происходит посредством образования иммунных комплексов (ИК) в составе пАГ-специфических антител сАТ, где аСТ представлены субклассами IgG, являющихся базовыми маркерами иммунопатологических реакций III типа.
Естественная технология флоккулообразования как необходимый компонент персонализированного подхода к нутритивной коррекции
В 1980-е гг. был описан феномен флоккулообразования в верхних отделах пищеварительного тракта [42]. Суть заключается в том, что в естественных условиях пищеварения закисление энтеральной среды периодически поступающим желудочным соком приводит к образованию структур жидкокристаллического типа (флоккулы), сорбирующих полостные пищеварительные ферменты и повышающие их активность. Флоккулы обладают постоянной структурой (выявляется при рентгенографическом анализе), в основе которой лежит гликопротеиновая матрица. Активность и рентгенспецифика этих структур, как показано в эксперименте, обеспечивают оптимизацию усвоения нутриентов в поврежденном желудочно-кишечном тракте (в т.ч. после резекций желудка, ахилиях и пр.). Исследования данного феномена у конкретного человека при выборе рациона – одно из направлений персонализированной нутрициологии.
Программы на основе изучения генетического кода
Последние исследования в области нутригенетики утверждают, что для выбора корректной диеты следует учитывать индивидуальные генетические особенности. В частности, на основе генетического теста ученые Стэнфордского университета (Калифорния) создали методику подбора диет на основе 4 полиморфных генов, участвующих в процессах метаболизма питательных веществ:
- FABP2 (играет роль в усвоении, внутриклеточном метаболизме и транспорте ЖК);
- PPARG (участвует в процессе окисления ЖК и дифференцировке жировых клеток);
- ADRB2 (участвует в регуляции превращения жира в энергию);
- ADRB3 (участвует в регуляции расщепления жиров и теплообмена).
Заключение
Персонализированная медицина – современный вектор научного развития. Горизонты медицинского направления нутриционной науки глазами ученых, по-видимому, могут выглядеть следующим образом.
Будут продолжаться:
а) исследования микробиоты и другие омик-технологии как один из базовых параметров для развития нутриционной поддержки;
б) технологии, основанные на фундаментальных открытиях полостного гетерофазного пищеварения;
в) генно-инженерные и 3-D-техно-логии;
г) исследования по совершенствованию препаратов нутриционной парентерально-энтеральной и сипинговой коррекций для онкологических пациентов;
д) профилактические направления персонализированной нутрициологии (поддерживающие концепцию здорового образа жизни).
Использование совокупности кодирующих (ДНК, РНК) и сигнальных (белки и нуклеиновые кислоты) молекул для регуляции функционала организма могут быть использованы для редактирования генома и создадут возможность персонализации нутритивной периоперационной коррекции метаболизма при хирургических вмешательствах для достижения индивидуального физиологического ответа. Подобная высокотехнологичная реализация принципов функциональной молекулярной и ферментативной хирургии в виде систем редактирования генома, тераностических агентов (обеспечивающих как диагностику, так и лечение) составляет современное представление о персонализированной нутрициологии.



