Пояснично-крестцовые радикулопатии (ПКР) достаточно часто встречаются в клинической практике, а в структуре патологии периферической нервной системы занимают ведущее место, составив 70 % [8]. По числу лиц с временной утратой трудоспособности радикулопатии занимают второе место после травм.
По современным представлениям, причиной ПКР могут быть вертеброгенные (чаще всего остеохондроз позвоночника) и невертеброгенные факторы. Корешковые синдромы выявляются среди 37,4 % больных остеохондрозом позвоночника [11]. По данным собственных наблюдений, провоцирующим фактором развития ПКР в 13,7 % случаев было переохлаждение, в 4,4 % – перенесенная вирусная инфекция, в 30,7 % – тяжелая физическая нагрузка, а подавляющее большинство (51,2 %) больных указывают на сочетание 1–3 факторов. При вертеброгенном поражении корешка, связанном со сложностью его взаимоотношений с образованиями позвоночного канала, проявляется действие вегетативно-сосудистых, реактивно-воспалительных, застойных и других факторов, а клинические проявления корешковых расстройств зависят от степени вовлечения корешков в патологический процесс [1]. Сегментарная демиелинизация, возникающая при таком типе повреждения, тем выраженнее, чем интенсивнее и продолжительнее фактор давления [20]. Повреждение волокон нервного корешка в результате механического воздействия на него грыжи межпозвонкового диска носит смешанный характер: часть волокон подвергается сегментарной демиелинизации, другая часть – валлеровскому перерождению [21, 23]. Нарушение ультраструктуры нервных волокон корешка приводит к негативному изменению его физиологических функций – страдают проведение электрических импульсов и аксональный транспорт. Блокада электрических импульсов приводит к двигательным и чувствительным расстройствам в соответствующих миотоме и дерматоме. Несомненным является тот факт, что при ПКР в условиях гипоксии и отека корешка нарушается одна из важнейших функций нервной клетки – обеспечение трофическими факторами и обмен веществ между телом нейрона и его отростками. Блок аксонального транспорта в ортоградном направлении угнетает трофическое влияние нерва на иннервируемые ткани. Блок ретроградного транспорта сказывается на жизнедеятельности нервной клетки, угнетает и изменяет ее метаболизм, вызывая увеличение ее регенеративного потенциала. Замечено, что чем ближе к телу клетки повреждается аксон, тем более грубая дегенеративная реакция в нервной клетке и тем больше риск ее гибели. Поэтому повреждение нервного корешка может приводить к более существенным, чем повреждение периферического нерва, последствиям [11, 15].
Имеются работы, посвященные роли перекисного окисления липидов (ПОЛ) в развитии гипоксии нервной ткани, при которой происходит усиление свободно-радикального окисления в липидном слое ее биологических мембран. В частности, у больных ПКР отмечается активация ПОЛ, проявляющаяся в повышении уровня диеновых конъюгатов и малонового диальдегида [7, 17]. При ПКР продукты распада и токсины из мест дегенерации корешка за счет бoльшего проксимально-дистального аксоплазменного градиента стремительно переносятся в нижние отделы сплетения, периферические нервы, вызывая там процессы, которые клинически проявляются дистальными парезами. С помощью ретроградного транспорта те же продукты распада попадают в тело нервной клетки, нарушая работу ее цитоплазменных структур и изменяя защитную функцию всего неврального аппарата. В результате происходят уменьшение выработки миелина, дальнейшее повреждение гемато-неврального барьера (вторичная демиелинизация), в итоге – хронизация заболевания [8].
Лечение пациентов с данной патологией комплексное. Важнейшим должно быть этиологическое лечение, однако принципы его в настоящий момент недостаточно разработаны.
Основные направления лекарственной терапии:
• купирование основных механизмов раздражения синувертебрального нерва, устранение сосудистых и дистрофических изменений в области экстравертебральных очагов (стероидные и нестероидные противовоспалительные средства, сосудистые препараты, миорелаксанты);
• активизация трофических процессов (биогенные стимуляторы, протеолитические ферменты, хондропротекторы, препараты витаминов, анаболические препараты);
• симптоматическая терапия (транквилизаторы, антидепрессанты, гастропротекторы).
Этот далеко не полный перечень основных медикаментозных средств, которые можно применять в лечении ПКР, позволяет выбирать индивидуальную схему для конкретного больного в зависимости от патогенеза ведущих клинических симптомов. Основная часть лекарственных препаратов, используемых в консервативной терапии ПКР, имеет много противопоказаний и побочных эффектов. Поэтому тактика лечения должна быть направлена на рациональное назначение лекарственных препаратов, не допуская полипрагмазии.
В связи с этим лечение нервных расстройств, в основе которых лежит дефицит трофических веществ, должно заключаться в восполнении этого дефицита. С учетом общности патогенетических механизмов поражения центральной и периферической нервной системы при ряде заболеваний представляет интерес изучение эффективности применения при ПКР отечественного нейропротекторного препарата Мексидол.
Мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат) является антиоксидантом, ингибитором свободных радикалов, мембранопротектором, уменьшает активацию ПОЛ, повышает активность антиоксиднтной системы, активируя физиологическую систему ферментов (супероксиддисмутазу, каталазу, ферменты системы глутатиона). Мексидол подвергается метаболизму в печени, и в процессе гидролиза из него освобождается сукцинат. Протективное действие Мексидола в печени можно объяснить его мембраностабилизирующим действием, в результате которого наблюдаются угнетение ПОЛ мембран и изменение их фосфолипидного состава, а также нормализация функционирования мембраносвязанных ферментов. Наряду с этим сукцинат Мексидола легко проникает в клетки и окисляется в цикле трикарбоновых кислот, что способствует поддержанию уровня макроэргов при стрессорной гипоксии [7]. Нейропротекторное действие Мексидола проявляется в восстановлении нарушенных при различной патологии структуры и функций мембран; модулирующем влиянии на мембраносвязанные ферменты, ионные каналы, транспортеры нейромедиаторов, рецепторные комплексы, в т. ч. бензодиазепиновый, γ-аминомасляный, ацетилхолиновый; оптимизации синаптической передачи между структурами центральной нервной системы. Мексидол улучшает мозговой метаболизм и кровоснабжение мозга, улучшает реологические свойства крови; подавляет агрегацию тромбоцитов, улучшает деятельность иммунной системы. Антигипоксическое действие Мексидола проявляется в снижении потребности нейронов в кислороде в условиях гипоксии. Мексидол оказывает антиатерогенное действие, вызывая регресс атеросклеротических изменений в артериях и восстанавливая липидный гомеостаз путем уменьшения уровня общего холестерина и липопротеидов низкой плотности, замедляет процесс старения. Таким образом, Мексидол обладает широким спектром фармакологических эффектов, проявляющихся как на нейрональном, так и на сосудистом уровнях. Он оказывает церебропротекторное, противогипоксическое, транквилизирующее, антистрессорное, ноотропное (улучшение памяти, внимания, умственной работоспособности), антиалкогольное, противосудорожное, противопаркинсоническое, вегетотропное действия. У Мексидола практически отсутствуют побочные эффекты (кроме индивидуальной непереносимости), он имеет низкую токсичность.
Целью исследования был сравнительный анализ применения Мексидола в составе комплексного лечения ПКР.
Материал и методы
Проведено обследование и лечение 205 больных с клиническими проявлениями ПКР (104 женщины и 101 мужчина). Возраст больных составил от 18 до 74 лет. Больные были разделены на две сопоставимые по полу и возрасту группы – основную (ОГ) и группу сравнения (ГС). Численность ОГ составила 110 человек (56 мужчин и 54 женщины), ГС – 95 (49 мужчин и 46 женщин). В исследовании также участвовали 30 практически здоровых человек в качестве группы контроля. Наличие пареза отдельных мышц либо пареза мышц стопы (сгибательной и/или разгибательной группы) стало основным критерием, по которому больные были разделены на подгруппы, поскольку именно двигательные нарушения свидетельствуют о выраженных клинических проявлениях ПКР, приводящих к длительной нетрудоспособности или инвалидизации больных. В 1-ю подгруппу ОГ (ПОГ-1) вошли 87 (79,1 %) пациентов с чувствительными и рефлекторными нарушениями, в 1-ю подгруппу ГС (ПГС-1) – 79 (83,2 %). Подгруппы 2 (ПОГ-2 и ПГС-2) составили пациенты с чувствительными и рефлекторными нарушениями в сочетании с периферическим дистальным парезом мышц нижней конечности численностью 23 (20,9 %) и 16 (16,8 %) соответственно. Всем больным проведен курс общепринятой медикаментозной и физиотерапии, в ОГ дополнительно применен Мексидол по 2 мл 5 %-ного раствора 2 раза/сут внутримышечно или внутривенно 10–20 дней в зависимости от клинической картины и тяжести состояния больного. Затем Мексидол принимали перорально по 250 мг (2 таблетки) 3 раза/сут до 2 месяцев, т. е. пациенты продолжали прием препарата в амбулаторных условиях.
В динамике в обеих группах провели тщательное неврологическое обследование, клинико-лабораторное и биохимическое исследования (уровни сиаловых кислот, фибриногена, С-реактивного белка), стимуляционную электронейромиографию (ЭНМГ), нейровизуализирующие методики (компьютерную томографию, ядерно-магнитно-резонансную томографию). Клинико-неврологические методы исследования дополнили обследованием пациентов по шкалам и опросникам: визуальной аналоговой шкале боли (ВАШ); опроснику Роланда–Морриса “Боль в нижней части спины и нарушение жизнедеятельности”; Шкале оценки адаптационного статуса больных с патологией позвоночника [4, 18, 22, 25]. Магнитно-резонансная томография (МРТ) в положении лежа в сагиттальной и фронтальной плоскостях проведена на аппарате “Образ-2” (Россия) с напряженностью магнитного поля 0,14 Тс, толщиной “среза” 4 мм. ЭНМГ проводилась по стандартным методикам [2, 3] на аппарате “Нейромиан” (Таганрог, Россия) всем больным ОГ и 55 пациентам ГС. С помощью стимуляционной определяли прямой мышечный ответ (М-ответ), амплитуду измеряли в милливольтах (мВ) от пика до пика [3]. Кроме амплитуды оценены латентный период (мс), скорость проведения импульса (СПИ). С помощью параметров F-волны (частоты ее возникновения, латентности) оценили состояние мотонейронов и их аксонов на самом проксимальном участке. В качестве нормативов были использованы показатели контрольной группы (30 практически здоровых людей). Статистическая обработка полученных данных осуществлялась с помощью программы С. Гланца “Медико-биологическая статистика” [9].
Результаты исследования
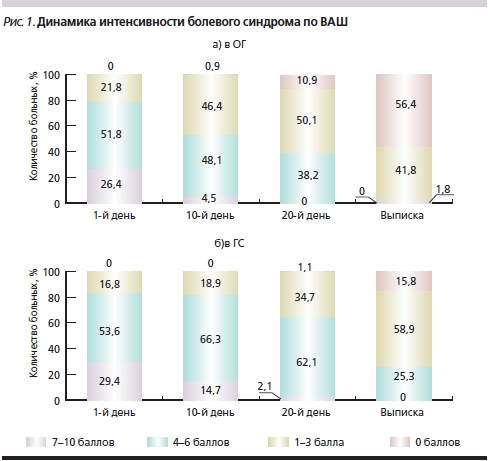
Диагноз ПКР был поставлен пациентам обеих групп на основании подробного сбора анамнеза и тщательного неврологического обследования. Следует отметить, что в ОГ у 19 (17,3 %) больных заболевание было выявлено впервые, у остальных 91 (82,7 %) – повторно, в ГС – 14 (14,7 %) и 81 (85,3 %) соответственно. Практически всем обратившимся за стационарной помощью был проведен курс амбулаторного лечения, который или не дал положительного результата, или ожидаемый эффект был неполным. Так как все больные в сравниваемых группах испытывали болевые ощущения в той или иной мере, большое внимание уделялось оценке регресса болевого синдрома. Наиболее простым и информативными тестом для количественной оценки восприятия боли, по мнению ряда исследователей [4], является визуальная аналоговая шкала (ВАШ), которая представляет собой отрезок прямой линии длиной 10 см, где начальная точка (ноль) соответствует отсутствию боли, а конечная (десять) – невыносимым болевым ощущениям. Больному предлагали на данном отрезке изобразить силу испытываемой боли ежедневно в течение всего периода обследования, что позволило оценить динамику восприятия пациентом своих болевых ощущений и эффективность проводимой терапии. В ГС выраженный болевой синдром (7–10 баллов) наблюдался у 29,4 % пациентов, средней интенсивности (4–6 баллов) – у 53,6 %, умеренный (1–3 балла) – в 16,8 % случаев (28, 51 и 16 человек соответственно). В ОГ те же показатели распределились следующим образом: 7–10 баллов – 26,4 % (29), 4–6 балла – 51,8 % (57) и 1–3 балла –21,8 % (24). После завершения курса лечения при оценке болевого синдрома в ОГ снижение боли на 5 и более баллов отмечено у 48 (43,6 %) пациентов, снижение на 1–4 балла – у 62 (56,4 %). В ГС снижение на 5 баллов и более наблюдалось у 8 (8,4 %) пациентов, на 1–4 балла – у 48 (50,5 %), без динамики – у 38 (40 %), усиление боли отмечено в 1 (1,05 %) случае. Таким образом, при проведении комплексной терапии с использованием Mексидола результаты по уменьшению интенсивности болевого синдрома в ОГ значительно оптимистичнее, нежели в ГС.
Динамика снижения интенсивности болевого синдрома в процессе лечения представлена на рис. 1а, б, на котором видно, что в ОГ наибольший темп снижения боли происходит с 10-го по 20-й день лечения, причем ко дню выписки (25–30-й день) более чем у 50 % пациентов болевой синдром полностью купируется, у остальных становится умеренным, что требует применения обезболивающих средств лишь периодически. В ГС (рис. 1б) также наблюдается регресс болевого синдрома, но менее значительный, чем в ОГ. К моменту завершения курса лечения в ГС преобладают пациенты (51,6 %) с умеренным болевым синдромом, однако остается значительным (25,3 %) число лиц с болью средней интенсивности, требующей постоянного приема обезболивающих средств.
У больных ПКР в сравниваемых группах до лечения выявлена различная неврологическая симптоматика в виде анизорефлексии, симптомов натяжения (Ласега, Нери, Дежерина, Бонне, Вассермана, Сикара), изменения статики и динамики позвоночника, мышечно-тонический синдром, выпадение чувствительности в соответствующих дерматомах, вегетативно-трофические расстройства (сухость кожи, поредение волосяного покрова на нижних конечностях, гиперкератоз стоп), в ряде случаев отмечено снижение силы в отдельных мышечных группах.
Подавляющее большинство пациентов: 92 (83,6 %) – в ОГ и 88 (92,6 %) – в ГС имели одностороннее поражение, 18 (16,4 %) и 7 (7,4 %) человек соответственно – двустороннее. Оценивая динамику клинических симптомов в обеих группах, следует отметить, что в ОГ все пациенты, кроме одного, претерпели обратное развитие мышечно-тонического синдрома, тогда как в ГС – только 6 (33,3 %) из 18; у 72 (69,2 %) больных ОГ купировались симптомы натяжения, в ГС – лишь у 11 (11,6 %). Наблюдалась динамика в рефлекторной сфере: восстановление (полное или частичное) зарегистрировано в ОГ у 40 (42,6 %) больных, в ГС – у 14 (16,3 %). У остальных пациентов динамики не отмечено. Положительная динамика в восстановлении чувствительности имела место в ОГ у 36 (36,7 %) пациентов, в ГС – у 13 (14,6 %); мышечной силы в ОГ у 5 (21,7 %) пациентов, в ГС – у 1 (6,3 %). Отрицательной динамики не отмечено. Таким образом, наиболее значительный регресс неврологического дефицита был достигнут в ОГ, особенно в отношении мышечно-тонического синдрома и симптомов натяжения, которые вкупе с болью причиняют больным наибольшие страдания.
Кроме того, следует отметить более быстрое, нежели в ГС, восстановление рефлексов и чувствительности, что может свидетельствовать об уменьшении воспалительных и гипоксических нарушений в корешке и периферических нервах, уменьшении отека, а также начавшихся процессах ремиелинизации. В ОГ отмечена положительная тенденция в восстановлении двигательной активности у пациентов с дистальными парезами: у 5 (21,7 %) – полное восстановление, у остальных 18 (78,3 %) – положительная динамика; в ГС – полное восстановление у 1 (6,2 %) больного, положительная динамика – у 4 (25 %) пациентов, без динамики – у 11 (68,8 %). Следует отметить, что полное восстановление было зарегистрировано среди пациентов с изначально нетяжелыми парезами (3,5–4,5 балла) и относительно небольшим “стажем” заболевания (до 6 месяцев). При субъективной оценке эффективности лечения в ОГ “улучшение” отметили 108 (98,2 %) пациентов, в ГС – 37 (38,9 %).
Данные опросника Роланда–Морриса “Боль в нижней части спины и нарушение жизнедеятельности” до лечения выявили выраженное нарушение всех сторон жизнедеятельности больных, особенно активного передвижения вне дома и эмоционально-психической сферы, сна. Общее число пунктов у больных составило в ПОГ-1 – 11,6 ± 0,4; в ПГС-1 – 11,3 ± 0,6; в ПОГ-2 – 13,2 ± 0,9 и в ПГС-2 – 14,2 ± 0,8. Наличие дистального пареза значительно ухудшало многие стороны повседневной жизни больных (p < 0,05). После лечения средние значения общего числа пунктов у больных составили в ПОГ-1 – 6,8 ± 0,3; в ПГС-1 – 9,6 ± 0,8; в ПОГ-2 – 8,1 ± 0,5 и в ПГС-2 – 11,9 ± 0,6. В подгруппах ОГ различия между показателями до и после лечения были существенными (р < 0,001). В ГС улучшение (р < 0,05) было достигнуто после лечения только в ПГС-2. Комплексное лечение с включением Мексидола оказало положительное влияние на восстановление сна и уменьшение эмоциональных переживаний, особенно убедительным был отказ от внешней опоры 13 (56,5 %) пациентов ПОГ-2, что свидетельствовало о значительном улучшении двигательной функции.
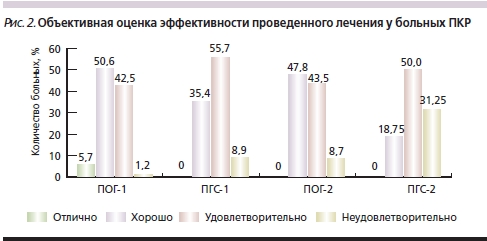
Для объективной оценки показателя утраты способности к самообслуживанию по Шкале оценки адаптационного статуса больных с патологией позвоночника высчитывалась степень дезадаптации (СД), составившая до лечения в ПОГ-2 37,6 ± 2,2 %, в ПГС-2 – 36,8 ± 1,8 %, в ПОГ-1 – 22,4 ± 1,2 %, в ПГС-1 – 24,2 ± 1,4 %. Различия между подгруппами внутри групп были существенными (p < 0,001). После лечения более значимое снижение СД выявлено среди пациентов ОГ: в ПОГ-1 – на 80,4 %, в ПГС-1 – на 47,1 %; у больных с парезами: в ПОГ-2 – на 37,8 %, в ПГС-2 – только на 15,2 %. СД значительно (p < 0,001) уменьшилась среди пациентов ПОГ-1, ПОГ-2 и ПГС-1; в ПГС-2 существенного снижения добиться не удалось (p > 0,05). Результаты терапии оценивали по коэффициенту эффективности проведенного лечения. Отличные результаты наблюдались только в ПОГ-1. В основном у больных в группах преобладали хорошие и удовлетворительные результаты лечения с явным преобладанием хороших оценок в ОГ (рис. 2). Неудовлетворительные результаты в ПГС-2 превысили 30 %.
По данным рентгенологического исследования и МРТ, у всех больных обеих групп выявлены признаки остеохондроза позвоночника, спондилеза и спондилоартроза (от 1–2 позвонков до полного поражения пояснично-крестцового отдела). Грыжи Шморля диагностированы в 9 (4,4 %) случаях, у 1 больного множественные; в 100 % случаев выявлены межпозвонковые задние протрузии и (или) грыжи: у 28 (13,7 %) – срединная, у 147 (71,7 %) – парамедианная, у 30 (14,6 %) – боковая, в т. ч. множественные у 25 (12,2 %) больных. Локализация протрузий и грыж была следующей: у 128 (62,4 %) пациентов на уровнях L5–S1, у 71 (34,6 %) – L4–L5, у 4 (1,95 %) – L3–L4, по одному (0,5%) – на уровнях L2–L3 и L1–L2. В 133 (64,8 %) случаях протрузии и грыжи компремировали переднюю стенку дурального мешка, в 20 (9,8 %) – отмечено нарушение ликвородинамики. Поясничный стеноз был выявлен в 47 (22,9 %) случаях.
При сопоставлении клинической картины с результатами МРТ в 181 (88,3 %) случае выявлено соответствие уровня локализации и направления выпячивания с уровнем выявленной радикулопатии, что говорит о высокой чувствительности данного метода обследования. В остальных случаях локализация протрузии или грыжи не соответствовала стороне и уровню радикулопатии. К примеру, у больного З. были выявлены задние срединные протрузии дисков L1–L2 и L2–L3 размером 3,0 и 3,5 мм без признаков компрессии дурального мешка, а клинически и по результатам ЭНМГ определена двусторонняя радикулопатия L5, S1 c вторичным аксонально-демиелинизирующим поражением обоих большеберцовых нервов.
Результаты ЭНМГ представлены в таблице.
* Статистически значимые различия между показателями у пациентов до и после лечения (* p < 0,05; ** p < 0,001); # статистически значимые различия между показателями пациентов после лечения и показателями контрольной группы (# p < 0,05; ## p < 0,001).
По данным ЭНМГ, до лечения в обеих группах, даже при клиническом отсутствии двигательного дефицита, у пациентов с рефлекторными и чувствительными нарушениями выявлены признаки демиелинизации не только спинномозговых корешков, но и периферических нервов (см. таблицу). При этом формирование периферического дистального пареза мышц нижних конечностей возникало при аксонально-демиелинизирующем поражении периферических нервов, о чем свидетельствовало снижение амплитуды М-ответа (во вторых подгруппах p < 0,05 по сравнению с ГК) и еще более выраженного (p < 0,05), чем в первых подгруппах, уменьшения СПИ по двигательным волокнам (ДВ). Поражение большеберцовых нервов у больных парезами было более выраженным, поскольку выявлено еще и статистически значимое (p < 0,05) по сравнению с ГК увеличение терминальной латентности. Исследование Н-рефлекса показало, что процессы демиелинизации затрагивали и чувствительные, и ДВ корешков S1–S2, и большеберцового нерва. Существенных различий латентности Н-рефлекса между подгруппами в ОГ и ГС обнаружено не было (p > 0,05), показатели в подгруппах (ПОГ-1 – 33,2 ± 1,6 мс, ПОГ-2 – 35,6 ± 1,8, ПГС-1 – 32,9 ± 1,3, ПГС-2 – 36,1 ± 1,7 мс) были повышены и достоверно отличались от ГК (p < 0,05). В результате проведенного лечения (см. таблицу) в ПОГ-2 существенно увеличилась (p < 0,05) амплитуда М-ответа; статистически значимых различий с ГК не было (p > 0,05); в ГС полученные результаты значительно отличались от ГК (p < 0,05). Положительная динамика во вторых подгруппах в виде снижения терминальной латентности при стимуляции большеберцового нерва преобладала в ПОГ-2 (p < 0,05). В подгруппах ОГ существенно увеличилась СПИ по ДВ большеберцового (p < 0,001) и малоберцового (p < 0,05) нервов, однако во вторых подгруппах результата ГК достичь не удалось, различия были существенными (p < 0,05). В ГС значительного увеличения СПИ после лечения выявлено не было (p > 0,05), полученные результаты (кроме СПИ по малоберцовому нерву в ПГС-1) знаметно отличались от таковых в ГК (p < 0,001). В ОГ восстановление проводимости в корешках (уменьшение латентности F-волны) отмечено в обеих подгруппах, особенно в ПОГ-1. В ГС положительная динамика была незначительной в обеих подгруппах, результаты после лечения существенно отличались от таковых в ГК (p < 0,05). Восстановление проведения нервного импульса (уменьшение латентности Н-рефлекса) выявлено в ПОГ-1 (29,1 ± 1,3 мс, p < 0,05). В ПГС-1 (32,1 ± 1,5 мс) и ПОГ-2 (31,2 ± 1,4 мс) эффект был неполным; полученные значения достоверно не отличались от таковых в ГК (p > 0,05). Лишь в ПГС-2 положительный эффект был незначительным (34,3 ± 1,6 мс).
Клинико-неврологический контроль отдаленных результатов лечения в подгруппах больных
Для проверки стойкости достигнутых результатов лечения и их оценки в более отдаленные сроки нами были обследованы 38 пациентов с ПКР спустя 6 месяцев после завершения лечения. На повторный визит явился 21 человек из ОГ (11 – из ПОГ-1 и 10 – из ПОГ-2) и 17 – из ГС (8 – из ПГС-1 и 9 – из ПГС-2). Сохранение или даже улучшение клинического эффекта на протяжении полугода было зарегистрировано у 17 (81,0%) из 21 больного в ОГ: 8 (72,7 %) пациентов – из ПОГ-1 и 9 (90,0 %) – из ПОГ-2 и лишь у 3 (17,6 %) из 17 пациентов ГС (все из ПГС-1). Ухудшения состояния в виде усиления болевого синдрома в ОГ не отмечено, в ГС боли возобновились или усилились у 14 (82,4 %) больных, а 6 (35,3 %) пациентов в течение этого периода времени повторно проходили курс лечения. При исследовании динамики интенсивности боли в подгруппах ОГ отмечено существенное (p < 0,05) снижение: с 2,78 ± 0,25 до 1,34 ± 0,18 балла; напротив, в ГС интенсивность боли увеличилась с 3,56 ± 0,79 до 4,86 ± 0,52 балла. В подгруппах ОГ наблюдался также дальнейший регресс неврологической симптоматики и улучшение жизнедеятельности (по данным шкалы Роланда–Морриса). В ГС отмечено ухудшение данных показателей, особенно во второй подгруппе. В подгруппах ОГ имело место неуклонное уменьшение СД (в ПОГ-1 СД снизилась с 6,4 до 3,8 %, в ПОГ-2 – с 12,8 до 8,4 %), в ПГС-1 положительный результат был незначительным (с 23,4 до 22,6 %), в ПГС-2 дезадаптация увеличилась с 31,2 до 32,4 %.
Таким образом, дальнейший регресс неврологической симптоматики, связанное с ним улучшение социальной адаптации и основных аспектов жизнедеятельности у пациентов основной группы свидетельствовали о пролонгированном действии Мексидола, его положительном влиянии на частоту обострений и длительность ремиссии больных ПКР вне зависимости от наличия двигательного дефицита.
Выводы
Применение Мексидола в составе комплексной терапии больных ПКР по сравнению с общепринятой терапией значительно и стойко уменьшает выраженность болевого синдрома, ускоряет восстановление функции спинномозговых корешков, периферических нервов и связанное с ним улучшение социальной адаптации и основных аспектов жизнедеятельности пациентов. При клинико-неврологическом контроле отдаленных результатов лечения получены данные о пролонгации положительного действия Мексидола, выраженного в дальнейшем регрессе боли и неврологического дефицита, уменьшения частоты обострений и стойкости ремиссии больных ПКР.
У больных ПКР с рефлекторными и чувствительными нарушениями рекомендовано включать в состав консервативной терапии нейропротекторный препарат Мексидол по 2 мл 5 %-ного раствора 2 раза/сут внутримышечно или внутривенно курсом 15–20 дней. У пациентов с дистальными парезами рекомендуется использовать Мексидол в тех же дозах курсом 20–25 дней.
С целью профилактики обострений ПКР необходимо продолжить лечение Мексидолом перорально по 250 мг (2 таблетки) 3 раза/сут в течение месяца. При необходимости курс лечения можно повторно назначать через 3–6 месяцев.



