Введение
Проблема атрофического вагинита (АВ) в постменопаузе широко распространена, но зачастую рассматривается как естественный процесс старения и угасания организма. Здоровье и качество жизни женщины в данный период зависят от многих факторов, один из которых – снижение уровня эстрогенов, что вызывает нарушение пролиферативных процессов влагалищного эпителия, снижение митотической активности клеток (в первую очередь базального и парабазального слоев), изменение чувствительности рецепторного аппарата [4]. С увеличением продолжительности постменопаузы и дальнейшим развитием эстрогенного дефицита происходит ощелачивание влагалищной среды, инициируются дисбиотические и атрофические процессы [3, 4].
Результаты молекулярно-генетических исследований регуляции вагинальной микроэкосистемы в разные возрастные периоды показали, что эндогенная микрофлора влагалища – это динамическая биосистема, которая находится в равновесии с макроорганизмом и подвергается изменениям под влиянием эндогенных и экзогенных факторов [6]. Состояние репродуктивного тракта женщины зависит от гормональной регуляции, присутствия местной микрофлоры, клеток иммунной системы и продуцируемых ими биологически активных веществ.
Представительство микрофлоры во влагалище и цервикальном канале (лактобактерии, условно-патогенная микрофлора) зависит от этиологии воспалительного процесса и гормонального фона [6].
Для жизнедеятельности и роста лактобактерий необходим цитолиз непрерывно слущивающихся эпителиальных клеток с освобождением гликогена. Колонизация эпителия лактобактериями и Escherichia coli (E. coli) зависит от уровня эстрогенов. При дефиците эстрогенов недостаточное созревание эпителия приводит к анатомо-физиологической недостаточности многослойного плоского эпителия (МПЭ) влагалища, дефициту гликогена, снижению количества и элиминации лактобацилл, смещению рН влагалища в щелочную сторону. При увеличении содержания эстрогенов за счет дифференциации десквамозного эпителия и кератинизации эпителия влагалища не происходит адгезии и последующей колонизации E. coli [6]. На фоне гипоэстрогении, связанной с возрастными биологическими изменениями в организме женщины, клетки МПЭ влагалища уменьшаются в размере, у промежуточного слоя нарушается процесс образования гликогена, соответственно, ухудшаются условия для жизнедеятельности лактобактерий, в результате чего их число уменьшается [1].
Для формирования резистентности влагалища к инфекции необходима насыщенность организма эстрогенами, стимулирующими пролиферацию МПЭ и повышающими продукцию гликогена в поверхностных клетках. Учитывая важную роль эстрогенного фона для обеспечения пролиферации МПЭ и продукции гликогена в поверхностных клетках с целью формирования резистентности влагалища к инфекции, при лечении вагинита в постменопаузе целесообразно проводить местную терапию препаратами, содержащими эстрогены, обладающими высоким профилем безопасности, а также избирательной активностью в отношении слизистой оболочки урогенитального тракта [4]. В рамках такой тактики терапии большой интерес вызывает эстриол – вещество, представляющее собой синтетический аналог эстрогенов. Эстриол обладает короткой продолжительностью действия и не вызывает пролиферации эндометрия, в связи с чем не требует дополнительного назначения прогестагенов [3, 4]. Эстриол показан к лечению АВ. Препарат, содержащий терапевтические дозы эстриола, прост и безопасен, что позволяет справиться с проблемой и улучшить качество жизни женщин [3, 4]. В настоящее время на российском фармацевтическом рынке имеется препарат эстриола для местного применения в постменопаузе – Овипол Клио (ОАО «Акрихин», Россия). Препарат выпускается в свечах по 0,5 мг, рекомендован к лечению АВ и других расстройств урогенитального тракта [3, 4].
Для достижения оптимальных терапевтических результатов при АВ в постменопаузе перед восстановлением функций влагалища при помощи препаратов с эстриолом целесообразна комплексная предварительная санация влагалища с целью профилактики и коррекции активизации условно-патогенной микрофлоры. В арсенале врачей существует множество комбинированных антибактериальных препаратов, которые применяются в терапии инфекций влагалища смешанной этиологии с высокой клинической эффективностью. Для элиминации избыточного количества анаэробных микроорганизмов используют этиотропные препараты группы 5-нитроимидазола или клиндамицин. С клинической точки зрения интерес представляет клиндамицин – антибиотик группы линкозамидов. По эффективности терапии вагинитов клиндамицин сопоставим с метронидазолом (89–93%) с меньшей частотой побочных эффектов [3, 4, 10]. В рамках комбинированной терапии вагинитов используется бутоконазол (производное имидазола), обладающий фунгицидной активностью в отношении грибов и некоторых грамположительных бактерий. При однократном местном применении бутоконазол (2%-ный вагинальный крем) имеет сопоставимую эффективность с 7-дневным курсом применения миконазола (2%-ный вагинальный крем) [7].
Совместное содержание бутоконазола (антигрибковый компонент) и клиндамицина (антибактериальный компонент) представлено в комбинированном препарате местного действия Клиндацин Б пролонг (крем вагинальный) (ОАО «Акрихин», Россия), что обусловливает интерес к применению препарата для лечения вагинитов. В соответствии с инструкцией по применению препарат обладает особыми фармакологическими свойствами: гидрофильная кремовая основа лекарственной формы обеспечивает гелеобразную консистенцию при температуре 35–40°С, в связи с чем при интравагинальном применении крем не плавится и активные вещества находятся на слизистой оболочке влагалища в течение 1–3 дней. Эти свойства обеспечивают препарату высокую биоадгезивность и пролонгированный характер действия в отсутствие раздражающего действия, что важно для достижения эффективности местных форм препаратов, применяемых в постменопаузе. Вагинальный крем, содержащий бутоконазол 2%, клиндамицин 2%, применяют 1 раз в сутки интравагинально, предпочтительно перед сном, ежедневно в течение 3–6 дней. Рекомендуемая доза составляет 5 г крема, что соответствует 100 мг бутоконазола нитрата и 100 мг клиндамицина, согласно инструкции по применению.
Таким образом, в постменопаузе на фоне гипоэстрогении увеличиваются частота и степень выраженности симптомов АВ: сухость, зуд и жжение во влагалище, диспареуния, рецидивирующие вагинальные выделения, контактные кровянистые выделения. В результате прогрессирования симптоматики возникает дискомфорт и снижается качество жизни женщины, что обусловливает актуальность ранней диагностики и своевременного назначения соответствующей терапии. Появление на фармацевтическом рынке новых препаратов позволит разработать тактику комплексной этиопатогенетической терапии вагинитов в постменопаузе.
Цель исследования: оценить клиническую эффективность комплексной терапии АВ у женщин в постменопаузе, включающей применение вагинального крема, содержащего бутоконазол 2%, клиндамицин 2%, для вагинального использования с последующим применением суппозиториев с эстриолом.
Методы
В исследовании добровольно приняли участие 74 женщины с АВ, находившиеся на амбулаторном лечении в медицинских центрах Санкт-Петербурга (ММЦ «ВРЕМЯ», МЦ «Петроклиника») и Томска (МО «Здоровье», МЦ «МедАрт») в 2016–2017 гг. Все пациентки были осведомлены о ходе исследования и подписали информированное согласие на участие в нем.
Критерии включения: возраст от 50 до 70 лет, постменопауза, подтвержденный диагноз АВ, согласие на участие в исследовании.
Критерии исключения: возраст моложе 50 лет или старше 71 года, отсутствие постменопаузы, повышенная чувствительность к компонентам препарата, применение в течение предыдущих 2 недель системной или локальной антибактериальной терапии, инфекции, передающиеся половым путем.
Выбор метода лечения осуществлен при помощи метода «слепых конвертов».
Основную группу составили 54 женщины (средний возраст – 60,4±0,6 года), которым применяли интравагинально при помощи аппликатора крем бутоконазол+клиндамицин по 5 г ежедневно в течение 6 дней и далее – вагинальные суппозитории с эстриолом по 1 свече 1 раз в сутки на ночь в течение 15 дней. Группу сравнения составили 20 женщин (средний возраст– 61,1±0,9 года), получавших соответствующим образом только суппозитории с эстриолом.
Оценка эффективности лечения проведена по наличию/отсутствию жалоб, результатам бимануального исследования, осмотра в зеркалах, микроскопического исследования мазков вагинального секрета, окрашенных по Граму, цитологического исследования мазков с шейки матки, полимеразной цепной реакции (ПЦР) в режиме реального времени (тест Фемофлор) с количественным определением ДНК бактерий, ассоциированных с вагинитами (Gardnerella vaginalis, Atopobium vaginae, Ureaplasma urealyticum, Mycoplasma hominis, Prevotella spp., Megasphera spp. и др.). Контрольные исследования проводили перед лечением, через 2 недели и 1 месяц после окончания терапии.
Статистическая обработка данных проведена в программе Statistica v. 10 (StatSoft Inc., США) с помощью U-критерия Манна–Уитни и χ2-критерия Пирсона. Различия считали значимыми при р<0,05. В таблицах числовые значения представлены в виде М±m, где М – среднее значение показателя в группе, m – стандартное отклонение.
Результаты исследования
По возрасту участников исследования, результатам клинико-лабораторных тестов исследуемые группы были сопоставимыми.
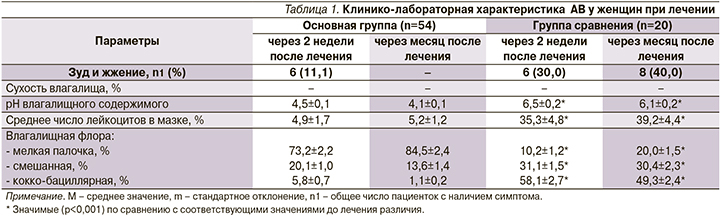
На момент начала исследования женщины предъявляли жалобы на жжение, сухость слизистой оболочки влагалища, скудные желтоватые выделения. При обследовании влагалищного содержимого у пациенток основной группы и группы сравнения определена кислотность в пределах рН 6,7±0,4 и 6,6±0,4 (p>0,05), в мазках среднее число лейкоцитов в поле зрения составило 58,8±5,6 и 63,0±7,2 соответственно (p>0,05), при микроскопии мазка обнаружены популяции мелкой палочки (31,6±1,1% и 10,5±1,2%), смешанной (21,1±1,2% и 29,0±1,5%), кокко-бациллярной флоры (47,4±1,9% и 59,1±2,1%) соответст-венно (p>0,05).
Таким образом, до лечения у женщин с АВ имелись выраженные изменения микроценоза влагалища. Наиболее часто выявлялись ассоциации различных микроорганизмов на фоне снижения концентрации лактобацилл.
Через 2 недели после окончания лечения у 6 (11,1%) из 54 пациенток (p<0,001 по сравнению с данными до лечения) основной группы сохранялись жалобы на жжение, при этом у всех отсутствовали жалобы на сухость во влагалище, кислотность влагалищного содержимого восстановилась до среднестатистической нормы, находящейся в пределах рН 4,5 [2, 5, 6], более чем в 10 раз уменьшилось (p<0,05) число лейкоцитов в мазках вагинального секрета, во влагалищной флоре в среднем 2,3 раза (p<0,05) увеличилось представительство мелкой палочки при одновременном незначительном уменьшении доли смешанной и в среднем в 9 раз (p<0,05) кокко-бациллярной флоры.
В отличие от пациенток, получавших комплексную терапию, у 6 (30,0%) из 20 пациенток (p<0,001 по сравнению с данными до лечения), которые принимали только свечи с эстриолом, после курса лечения на фоне признаков клинического улучшения (отсутствие сухости во влагалище) сохранялось чувство жжения во влагалище, динамика лабораторных показателей была разнонаправленной и маловыраженной. Так, рН вагинального содержимого не нормализовалось и оставалось без динамики, среднее содержание лейкоцитов в мазке снижалось менее значительно (в среднем в 1,8 раза; p<0,05), во влагалищной флоре в динамике уменьшилось представительство мелкой палочки при одновременном увеличении доли смешанной (на 23,1%; p<0,05) и кокко-бациллярной флоры (на 22,1%; p<0,05; табл. 1).
Через месяц после окончания терапии у пациенток основной группы зарегистрирована дальнейшая положительная динамика клинико-лабораторных показателей, что позволило считать их выздоровевшими. В то же время у женщин после монотерапии существенных изменений в аналогичных показателях не отмечено, при этом у 8 (40,0%) пациенток сохранялось чувство жжения во влагалище, у всех сохранялась низкая кислотность вагинального содержимого, представительство микрофлоры практически не претерпевало изменений и оставалось на высоком уровне за счет кокко-бациллярной флоры.
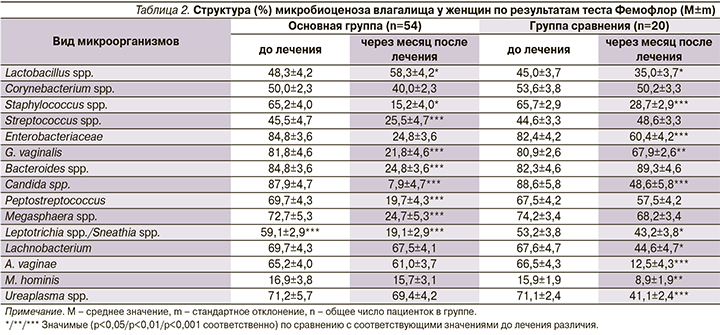
Исследование микробиоценоза влагалища женщин с АВ методом ПЦР в режиме реального времени с помощью теста «Фемофлор» через месяц после лечения по комбинированной схеме продемонстрировало значимое (р<0,001) увеличение концентрации лактобацилл и снижение содержания облигатных анаэробов (Staphylococcus spp., G. vaginalis, Bacteroides spp., Peptostreptococcus, Megasphaera spp., Leptotrichia spp./Sneathia spp., Lachnobacterium spp., A. vaginae, M. hominis, Ureaplasma spp.) и грибов (Candida spp.). У женщин, принимавших только свечи с эстриолом, отмечена слабоположительная динамика. При этом на фоне уменьшения концентрации отдельных представителей облигатной анаэробной флоры (Staphylococcus spp., Enterobacteriaceae, G. vaginalis, Leptotrichia spp./Sneathia spp., Lachnobacterium, A. vaginae, M. hominis, Ureaplasma spp.) и Candida spp. снижалось содержание лактобактерий (табл. 2).
Таким образом, уже через 2 недели после курсового приема назначенных препаратов отметилась более выраженная эффективность комбинированной схемы лечения АВ. В целом монотерапия АВ препаратом Овипол Клио не обеспечила нормализации биоценоза влагалища.
Несмотря на отсутствие желаемого эффекта терапии у определенной части пациенток, все женщины, участвовавшие в исследовании, хорошо перенесли лечение, аллергические реакции и другие побочные эффекты отсутствовали.
Известно, что гормональные нарушения в организме женщины создают благоприятный фон для развития воспалительного процесса нижнего отдела гениталий за счет изменения реактивности слизистой оболочки влагалища. В МПЭ влагалища и влагалищной части шейки матки эстрогены вызывают усиление пролиферации в базальном и парабазальном слоях, созревание клеток промежуточного слоя с накоплением в них гликогена; созревание клеток поверхностного слоя с накоплением в них кератина. Наиболее частыми клиническими формами возрастных изменений влагалища и шейки матки в постменопаузе являются АВ и цервициты [2–4, 8].
Активная секреция влагалищного эпителия зависит от количества эстрогенов: для фолликулярной фазы менструального цикла характерно выявление клеток поверхностного слоя, для лютеиновой – преимущественно промежуточных клеток, на фоне гипоэстрогении – базальных и парабазальных [2, 8]. На фоне дефицита эстрогенов в постменопаузе за счет снижения пролиферативной активности базального и парабазального слоев МПЭ происходит истончение и снижение эластичности атрофированного эпителия, уменьшается объем подслизистой сосудистой сети, развивается ишемия стенки влагалища, уменьшается транссудация. Атрофические изменения слизистой оболочки влагалища делают его легкоранимым, что служит причиной жалоб на дискомфорт, сухость, жжение, диспареунию, водянистые или кровянистые выделения при коитусе [4].
На протяжении всей жизни женщины вагинальные клетки и клетки эктоцервикса выделяют протоны через апикальную плазматическую мембрану, смещая рН влагалища в кислую сторону. С увеличением рН влагалищной среды в сторону ощелачивания до 5,5–7,5 значительно уменьшается общее число бактерий, прежде всего лакто- и бифидобактерий, вследствие чего в составе микрофлоры преобладают облигатно-анаэробные бактерии [9], провоцирующие воспалительную реакцию. Дальнейшая активизация условно-патогенной микрофлоры приводит к снижению колонизационной резистентности слизистой оболочки влагалища и шейки матки, увеличению количества факультативной микрофлоры, что создает благоприятные условия для развития и хронизации воспалительного процесса. Важно отметить, что в постменопаузе за счет угнетения сопротивляемости тканей эпителий влагалища становится еще более уязвимым к инфекции и изъязвлениям, способствуя колонизации влагалища и нижних мочевых путей условно-патогенной флорой (в основном кишечной палочкой и типичными представителями микрофлоры кожных покровов) и их вторичному инфицированию. В результате развиваются вторичные воспалительные процессы, бактериальный вагиноз, рецидивирующие вагиниты, что снижает сексуальную уверенность женщины и вносит вклад в развитие диспареунии [2].
Результаты исследования свидетельствуют о более значимом положительном эффекте лечения пациенток с АВ по комбинированной схеме (интравагинально крем бутоконазол+клиндамицин и далее – суппозитории с эстриолом), что, очевидно, обусловлено фармакологическими свойствами препаратов и этиопатогенетически обоснованным их применением.
Эстриол при местном применении способствует восстановлению влагалищного эпителия, нормализует рН среды и микрофлору урогенитального тракта, а также приводит к восстановлению основных элементов соединительной ткани – коллагена и эластина [3, 4].
Клиндамицин, связываясь с 50S-субъединицей рибосомы, подавляет синтез белка в микробной клетке, благодаря чему обладает широким спектром антибактериального действия в отношении ряда бактерий, включая G. vaginalis, Peptococcus spp., Peptostreptococcus spp., Bacteroides spp., Fusobacterium spp. и др. Фунгицидный и антимикробный механизмы действия бутоконазола заключаются в блокировании образования эргостерола из ланостерола в клеточной мембране и увеличении проницаемости мембраны, что приводит к лизису клетки гриба или бактерии [7].
Анализируя динамику клинико-лабораторных показателей женщин с АВ в постменопаузе, следует отметить, что монотерапия эстриолсодержащим препаратом способствует восстановлению клеточного состава слизистой оболочки влагалища, результатом чего является увеличение секреторной активности клеток эпителия. Вместе с тем при наличии дисбиотических нарушений во влагалище, характерных для постменопаузального периода, восстановление секреторной активности становится благоприятным фактором для развития патогенной флоры. Это и проявляется ее ростом на фоне снижения концентрации лактобактерий. В связи с этим заблаговременное применение препарата с широким спектром антимикробного и фунгицидного действий позволяет предотвращать прогрессирование дисбиотических нарушений при восстановлении функции клеток слизистой оболочки влагалища в ходе лечения А в постменопаузе.
Заключение
Гипоэстрогения в постменопаузе приводит к редукции вульвовагинальной перфузии, уменьшению числа клеток в слоях МПЭ влагалища, сокращению содержания в них гликогена, снижению секреторной активности слизистой оболочки, что способствует изменению влагалищного микробиоценоза. Адекватная и эффективная медикаментозная коррекция дисбиотических процессов вагинальной микросистемы в постменопаузе должна учитывать особенности патогенеза, базироваться на социальных аспектах жизни женщины, а также возрастных изменениях количественного и качественного состава вагинальной микробиоты. Учитывая полимикробную этиологию микрофлоры влагалища целесообразно применение комбинированных препаратов для местной терапии.
В связи с этим наряду с использованием свечей с эстриолом, предназначенных для местного применения при лечении вагинита в постменопаузе, целесообразно применение антибактериальных препаратов, оказывающих положительное действие на вагинальную микробиоту. Комплексная терапия с применением комбинированного крема для интравагинального использования и суппозиториев, содержащих терапевтические дозы эстриола, – простая и безопасная терапевтическая стратегия при АВ в постменопаузальном периоде.
Ограничения исследования
Результаты исследования могут служить основой для разработки эффективных схем комплексной терапии АВ в постменопаузе, в т.ч. с учетом сопутствующих соматических заболеваний.



