Проблема оценки минеральной плотности кости (МПК) и верификации диагноза остеопороза (ОП) у пациентов, перенесших низкоэнергетические переломы (НЭП), заслуживает весьма пристального внимания. Анализ данных литературы показал, что даже в экономически развитых странах мира двухэнергетическая рентгеновская денситометрия (DXA) поясничного отдела позвоночника (L1–L4) и проксимального отдела бедра (ПОБ), являющаяся «золотым» стандартом оценки МПК и диагностики ОП, проводится относительно небольшому количеству пациентов: в ряде проспективных наблюдений частота этого исследования лиц с НЭП составила 9–30%, причем во время госпитального лечения по поводу переломов этот показатель не превышал 5% [1–5]. В России исследование МПК больным после случившегося НЭП проводится крайне редко. Например, по данным Л.П. Евстигнеевой и соавт., женщинам, перенесшим НЭП дистального отдела предплечья (ДОП), DXA проводилась лишь в 3,1% случаев [6].
Основными причинами низкой частоты исследования МПК у пациентов, перенесших НЭП, считаются большие временные затраты на проведение DXA, а также ее высокая стоимость [7]. Кроме того, в России определенную роль играют недостаточная обеспеченность соответствующей аппаратурой. Так, по данным аудита состояния проблемы ОП, оснащенность денситометрами в регионах Российской Федерации составляла в среднем 0,6 аппарата на 1 млн жителей, при том что рекомендуемое количество DXA-денситометров для Европы составляет 11 на 1 млн человек [8, 9].
Вместе с тем периферическая DXA (пDXA) с оценкой МПК в ДОП является легковыполнимой и более доступной диагностической методикой. На ее проведение затрачивается меньше времени, сама процедура измерения МПК полностью автоматизирована и может быть проведена средним медицинским персоналом с последующим врачебным заключением. Периферические рентгеновские денситометры финансово более доступны, чем аппаратура для осевой DXA.
Перспективы использования оценок МПК в ДОП в качестве альтернативы «стандартной» денситометрии ранее неоднократно обсуждались в литературе [7, 10, 11]. А. Dhainaut и соавт. провели исследование, в котором сопоставили данные измерения МПК в ДОП с результатами, полученными при DXA в области ПОБ. По их мнению, чувствительность и специфичность выявления ОП при исследовании руки не отличались от таковых, полученных при DXA шейки бедра. Авторы сделали вывод, согласно которому их данные могут быть использованы для уменьшения числа пациентов, направляемых на стандартное обследование и, таким образом, иметь практическое значение в случаях, когда проведение DXA ограниченно [12]. Международное общество по клинической денситометрии считает возможным использовать пDXA с оценкой МПК в ДОП для идентификации лиц с очень низкой вероятностью переломов, которые не нуждаются в дальнейших диагностических процедурах, а также для принятия решения о необходимости противоостеопоротической терапии лиц, для которых переломы высоковероятны, если невозможна осевая DXA.
В последнем случае обязательно должны учитываться клинические факторы риска [13]. Вышеизложенные факты указывают на необходимость дальнейшего изучения возможности проведения пDXA у различных групп пациентов для выявления диагностических закономерностей данного метода.
Целью нашего исследования стала оценка возможности использования пDXA ДОП для прогнозирования ОП осевого скелета у женщин в постменопаузе, перенесших НЭП основных остеопоротических локализаций.

Материал и методы
Для решения поставленной цели проведено одномоментное исследование МПК у 134 женщин (средний возраст – 64,5 ± 8,7 года), перенесших НЭП пяти основных остеопоротических локализаций: 1) ПОБ, 2) ДОП, 3) хирургической шейки плеча, 4) позвоночника, 5) латеральной и/или медиальной лодыжки. Измерение МПК в поясничном отделе позвоночника (L1-L4), ПОБ и ДОП проводилось на двухэнергетическом рентгеновском остеоденситометре Discovery A («Hologic», США) и периферическом рентгеновском денситометре Osteometer Meditech DTX 200 (США).
Критерии включения в исследование: женский пол, возраст ≥50 лет, постменопауза, НЭП в течение 2 месяцев до инструментального обследования, согласие на участие в исследовании. Критерии невключения в исследование: наличие заболеваний, отрицательно влияющих на костное ремоделирование (хронические активные заболевания печени и почек, первичный гипер- и гипопаратиреоз, тиреотоксикоз, сахарный диабет 1 типа, состояния, требующие терапии препаратами с известным отрицательным влиянием на костную ткань).

Статистическая обработка полученных данных проведена с использованием пакета программ для статистического анализа STATISTICA for Windows (версия 10.0) и MedCalc (версия 15.6).
Результаты
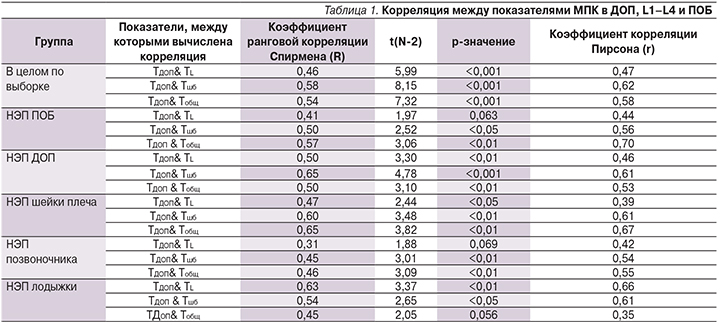
Первоначально были проанализированы корреляции между МПК (по Т-критерию) предплечья (ТДОП) и МПК в L1-L4 (ТL), шейке бедра (Тшб) и ПОБ в целом (Тобщ) (табл.1).
Как следует из табл. 1, показатели МПК в ДОП имели корреляции умеренной силы с показателями МПК в других отделах скелета (величина коэффициента корреляции Спирмена [R] – от 0,31 до 0,65) как в выборке в целом, так и в отдельных подгруппах пациенток с НЭП различных локализаций. Во всех изученных подгруппах МПК в ДОП демонстрирует однонаправленные изменения с МПК в ПОБ и L1–L4 (более высокая МПК в ДОП сочетается с более высокой МПК в ПОБ и L1–L4, а низкая МПК в ДОП – с низкой МПК в отделах осевого скелета). Соответственно, в отношении всех пациенток, перенесших НЭП, МПК в ДОП в принципе позволяет косвенно оценить состояние костной ткани ПОБ, шейки бедра и позвоночника.
Затем нами были проанализированы чувствительность и специфичность показателей МПК в ДОП для прогнозирования ОП (Т-критерий ≤-2,5SD) в L1–L4 и ПОБ. Анализ диагностической ценности показателей МПК в ДОП осуществлен при помощи построения т.н. характеристических кривых (ROC-кривая) и вычисления показателей чувствительности и специфичности для различных «точек разделения» («Cut-off points») по стандартной методике. Оптимальная «точка разделения» показателя МПК в ДОП, характеризующаяся наилучшим соотношением чувствительности и специфичности, определялась при помощи индекса Youden (J) [14], определяемого следующим образом: J=Чувствительность+Специфичность–1.
На рис. 1 представлена «характеристическая кривая», отражающая диагностическую ценность ДОП для прогнозирования ОП позвоночника (ТL≤-2,5SD). Площадь под кривой (AUC) показателя ТДОП составила 0,760±0,042 (95% доверительный интервал [ДИ] – 0,678; 0,830). Ниже представлены значения чувствительности и специфичности различных значений ТДОП для прогнозирования ОП позвоночника (табл. 2).
Оптимальной «точкой разделения» является значение ТДОП ≤-2,6SD (индекс Youden=0,45), которая позволяет прогнозировать ОП позвоночника (ТL ≤-2,5SD) с чувствительностью 74% и специфичностью 71%. При точке разделения ТДОП ≤-2,5SD пDXA предплечья прогнозирует ОП позвоночника с чувствительностью 74%, но более низкой специфичностью (66%).
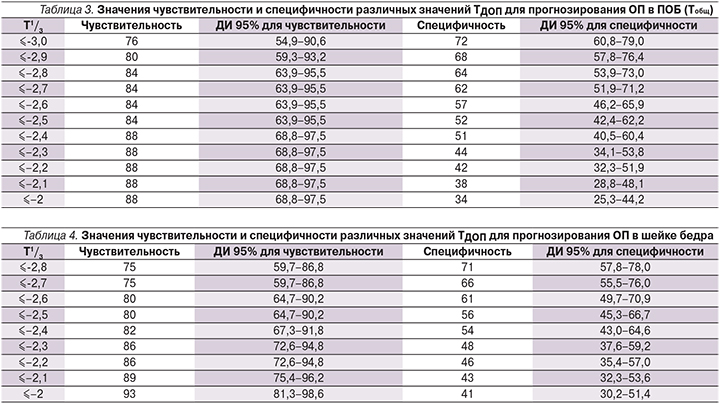
На рис. 2 представлена «характеристическая кривая», отражающая диагностическую ценность ТДОП для выявления ОП в ПОБ (Тобщ ≤-2,5SD). AUC показателя ТДОП составила 0,774±0,056 (95% ДИ – 0,693; 0,843). В табл. 3 представлены значения чувствительности и специфичности различных значений ТДОП для прогнозирования ОП в ПОБ (Тобщ).
Оптимальной «точкой разделения» является значение ТДОП ≤-3,0SD (индекс Youden=0,48), что позволяет прогнозировать ОП в ПОБ (Тобщ ≤-2,5SD) с чувствительностью 76% и специфичностью 72%. При точке разделения ТДОП ≤-2,5SD пDXA предплечья прогнозирует ОП в ПОБ с чувствительностью 84%, но более низкой специфичностью, равной 52%.
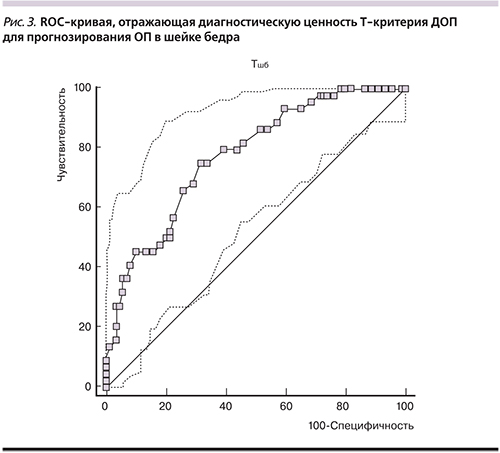
На рис. 3 представлена «характеристическая кривая», отражающая диагностическую ценность ТДОП для выявления ОП в шейке бедра (показатель Тшб ≤-2,5SD). AUC показателя ТДОП составила 0,774±0,042 (95% ДИ – 0,694; 0,842). В табл. 4 представлены значения чувствительности и специфичности различных значений ТДОП для прогнозирования ОП в шейке бедра.
Оптимальной «точкой разделения» является значение ТДОП ≤-2,8SD (индекс Youden=0,48), что позволяет прогнозировать ОП в шейке бедра (Тшб ≤-2,5SD) с чувствительностью 75% и специфичностью 71%. При точке разделения ТДОП ≤-2,5SD пDXA предплечья прогнозирует ОП в шейке бедра с чувствительностью 80% и специфичностью 56%.
Обсуждение
Проведенный в нашем исследовании анализ показал, что у женщин ≥ 50 лет в постменопаузе, перенесших НЭП различных локализаций, МПК в ДОП демонстрирует однонаправленные корреляции с МПК бедра/позвоночника (более высокая МПК в ДОП сочетается с более высокой МПК в бедре/позвоночнике, а низкая МПК в ДОП – с низкой МПК в отделах осевого скелета). При этом полученные нами данные о силе корреляционных связей МПК в ДОП с показателями МПК шейки бедра и бедра в целом (r=0,58 и r=0,62 соответственно) и МПК L1–L4 (r=0,47 по выборке в целом) были сопоставимыми с результатами других авторов. Так, по данным J.M Pouillès и соавт., значения коэффициентов корреляции между показателями МПК в ДОП и МПК отделов осевого скелета составляли 0,40–0,60 [15]. Согласно данным J. Fiter и соавт., коэффициенты корреляции МПК в ДОП с МПК в L1–L4 и шейке бедра составляли соответственно r=0,66 и r=0,65 [16]. В исследовании А. Dhainaut и соавт. мощность корреляции между МПК в ДОП и в шейке бедра составляла r=0,65 [12].
Согласно результатам проведенного нами анализа, показатели МПК предплечья (Т-критерий) позволяют прогнозировать ОП позвоночника и бедра с достаточной чувствительностью и специфичностью (соответственно 72–75% и 71–76% в зависимости от избранной точки разделения). Полученные данные отличаются от оценок диагностической ценности денситометрии ДОП в ранее проведенных исследованиях. Так, по данным W. Trivitayaratana и соавт. (2001), чувствительность показателей МПК правой лучевой кости в качестве метода оценки МПК бедра, шейки бедра и треугольника Ward составляла 90–95% при большом разбросе специфичности 54–74%; для МПК левой лучевой кости значения чувствительности и специфичности составляли соответственно 85–97 и 58–82% [17]. В исследовании J. Fiter и соавт. (2001) было показано, что чувствительность и специфичность МПК в ДОП (точка разделения: T-критерий ≤-2,5) для диагностики ОП в L1–L4 (T-критерий ≤-2,5) составляли соответственно 39 и 90%; при этом чувствительность и специфичность МПК в ДОП для выявления ОП в шейке бедра равны соответственно 58 и 87% [16]. Вероятными причинами выявленных различий являются неоднородность изученных разными авторами популяций пациентов, а также выбор точек разделения: при их подборе мы руководствовались оптимальным соотношением чувствительность/специфичность. Другие исследователи чаще выбирали точки разделения, соответствующие 90%-ной чувствительности и, соответственно, с более низкой специфичностью.
Заключение
Таким образом, нами получены показатели МПК в ДОП у женщин в постменопаузе, перенесших НЭП, при которых можно прогнозировать наличие ОП в поясничном отделе позвоночника и ПОБ (в целом или шейке бедра) с чувствительностью 72–75% и специфичностью 71–76%, что может быть использовано в условиях первичного звена здравоохранения в отсутствие аппаратов для центральной DXA для данной категории пациентов.



