Введение
До настоящего времени остается дискуссионной эффективность литокинетической терапии (ЛКТ) при нефролитиазе [1]. Ключевым фармакологическим препаратом, обеспечивающим дилатацию просвета мочеточника и элиминацию конкрементов, остаются α1А-адреноблокаторы (α-АБ). Аддитивный релаксирующий эффект на гладкомышечные клетки (ГМК) мочеточника воспроизводят нестероидные противовоспалительные средства, поскольку ингибирование циклооксигеназы сопровождается снижением уровня внутриклеточного Са2+ [2]. Недостаточная эффективность ЛКТ, используемой при нефролитиазе, побуждает к поиску новых перспективных мишеней для разработки фармакологических препаратов, способных индуцировать и поддерживать механизмы релаксации ГМК. Потенциальным кандидатом для включения в схему ЛКТ может считаться аденозин [3], однако в литературе отсутствует информация, касающаяся состояния аденозиновых рецепторов при нефролитиазе и в процессе траффика конкрементов.
Цель исследования: оценить активность аденозинового А2А-рецептора в процессе ЛКТ пациентов с локализацией крупных конкрементов (>10 мм) в верхней трети мочеточника.
Материал и методы
Исследование носило проспективный характер и включило 61 пациента с визуализационными признаками наличия конкрементов в верхней трети мочеточника. В стандартную ЛКТ вошли нестероидные противовоспалительные средства (диклофенак натрия, 100–150 мг/сут.), α1А-адреноблокатор (тамсулозин, 0,4 мг/сут.) и антибиотики. Когорта больных была распределена на две группы: с эффективной элиминацией конкремента – 40 пациентов (1-я группа), у которых, по данным визуализационного контроля, в течение 7 суток произошло перемещение конкремента из пиело-уретеральной зоны в среднюю треть мочеточника; а также с неэффективной элиминацией конкремента – 21 пациент (2-я группа), у которых локализация конкремента в мочевыводящих путях (МВП) в течение 7 суток не изменилась. Средний размер конкремента составил в 1-й группе 15,1±0,9 мм (min-max 7,0–25,0 мм), во 2-й – 16,9±1,8 мм (min-max 7,0–25,0 мм); межгрупповых различий не выявлено (р>0,05). Анализ функциональной активности рецепторов проводили in vitro на суспензии тромбоцитов (Тц), для чего из периферической крови путем центрифугирования выделили обогащенную Тц плазму. В пробе содержание Тц в 1 мкл составило 200 000±20 000. В исследовании применили аденозин (неселективный лиганд аденозиновых А1-, А2А-, А2В- и А3-рецепторов) (Sigma-Aldrich Chemie GmbH, Германия). Оценка агрегации Тц (АТц) проведена турбидиметрическим методом на анализаторе ChronoLog (США). От всех обследованных пациентов получено информированное согласие на участие в исследовании. Статистический анализ осуществлен с использованием пакета MedCalc. Все клинические исследования выполнены по согласованию с комиссией по биоэтике Донецкого национального медицинского университета им. М. Горького.
Точечная оценка величин, подлежавших анализу, проведена путем расчета среднего арифметического признаки () или ее медианы (Me) и соответствовавшей стандартной погрешности (m). При анализе межгрупповых различий применены критерий Стьюдента (в случае нормального закона распределения), критерий Вилкоксона (в случае различия закона распределения от нормального), Для выявления связи между признаками использованы методы корреляционного анализа: рассчитывали коэффициент корреляции Пирсона R (в случае нормального закона распределения) или показатель ранговой корреляции Спирмена (в случае отличия закона распределения от нормального). Во всех случаях различия считались статистически значимыми при уровне значимости р<0,05.
Результаты
Исследовательский вопрос – различается ли активность аденозинового А2А-рецептора на фоне стандартной ЛКТ при эффективной и неэффективной элиминации конкрементов из верхней трети мочеточника? В 1-й группе до назначения ЛКТ выявлена гипореактивность А2А-рецептора, сохранявшаяся в течение 24 часов после начала ЛКТ (табл. 1).
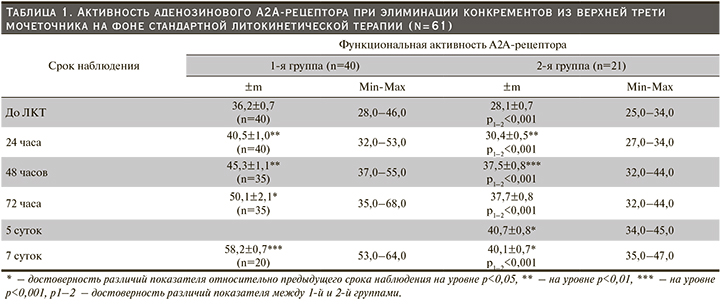
Следует отметить, что за указанный срок наблюдения активность данного рецептора возросла на 11,9% (р<0,01) по сравнению с исходным уровнем. Через 48 часов после начала ЛКТ у 5 (12,5%) пациентов отмечена элиминация конкрементов из МВП, при этом активность А2А-рецептора соответствовала диапазону нормореактивности – 44,0±0,7% (95% доверительный интервал [ДИ]: 42,0–46,0%). У оставшихся 15 пациентов 1-й группы активность данного типа аденозиновых рецепторов также соответствовала нормореактивности. Прирост активности А2А-рецептора за прошедшие 24 часа составил 11,8% (р<0,001) по сравнению с предыдущим сроком наблюдения и превышал исходные значения на 25,1% (р<0,001). Следовательно, у пациентов 1-й группы через 48 часов после начала ЛКТ не выявлена разница активности аденозинового А2А-рецептора при элиминации конкрементов и отсутствии таковой в верхней третей мочеточника. Вероятно, достижение нормореактивности А2А-рецептора в процессе ЛКТ не является пороговым значением для реализации траффика конкрементов, поскольку (а) не достигается оптимального эффекта блокады α-АБ на ГМК и/или (б) доминируют патогенетические факторы, поддерживающие сокращение мышечной оболочки мочеточника; к таковым можно отнести активацию симпато-адреналовой системы, усиление синтеза ТхА2, повышение уровня внеклеточного АТФ [4].
Через 72 часа активность А2А-рецептора возросла на 10,6% (р<0,05) по сравнению с предыдущим сроком наблюдения; еще более демонстративным прирост выглядит по сравнению с исходным уровнем (на 38,4%; р<0,001). Тем не менее в когорте подтвержден уровень нормореактивности А2А-рецептора. Результаты анализа кардинально изменяются, если через 72 часа после начала ЛКТ в 1-й группе учитывать раздельно данные об активности рецептора при выведении конкрементов из верхней трети мочеточника и без положительного траффика. По данным визуализационных методов исследования, элиминация конкрементов из верхней трети мочеточника подтверждена у 15 (37,5% от общей когорты 1-й группы) пациентов. У больных данного контингента активность А2А-рецептора возросла на 39,7% (р<0,001) по сравнению с предыдущим сроком наблюдения и составила 63,3±1,1% (95% ДИ: 60,9–65,7%), т.е. достигался уровень гиперреактивности. По сравнению с исходным уровнем прирост значений показателя достигал 74,9% (р<0,001). У оставшихся 20 пациентов активность А2А-рецептора понижалась до уровня гипореактивности – 40,2±0,7% (95% ДИ: 38,7–41,7%), т.е. уменьшалась на 11,3% (р<0,001) по сравнению с предыдущим сроком наблюдения, но превышала исходный уровень на 11,0% (р<0,001).
Через 7 суток после начала ЛКТ у 20 (50%) обследованных пациентов 1-й группы подтверждена элиминация конкрементов из верхней трети мочеточника. При этом активность А2А-рецептора увеличилась на 16,2% (р<0,001) относительно предыдущего срока наблюдения и соответствовала уровню гиперреактивности. По сравнению с исходным уровнем прирост значений показателя был более высоким – 60,8% (р<0,001). Таким образом, при применении стандартной ЛКТ у всех пациентов 1-й группы через 7 суток наблюдалась элиминация конкрементов из верхней трети мочеточника. Выявлено два пика выраженной элиминации конкрементов – 72 часа и 7 суток, когда эффект воспроизводился у 15 (37,5%) и 20 (50%) обследованных пациентов соответственно. Следовательно, элиминация конкрементов из верхней трети мочеточника наблюдалась только у пациентов с гиперреактивностью А2А-рецептора. Повышение активности данного рецептора в отсутствие фармакологических препаратов, способных стимулировать аденозиновые А2А-рецепторы, приводит к заключению о неспецифическом влиянии ЛКТ на микроциркуляцию и метаболизм пуриновых нуклеотидов, в результате чего повышается уровень аденозина. Нельзя исключать, что ишемическое прекондиционирование тканей мочеточника, связанное с длительным пребыванием конкрементов в МВП, приводит к повышению экспрессии аденозиновых А2А-рецепторов [5], увеличению активности эктоферментов (CD73) и нуклеотидаз (экто-5'-нуклеотидазы), участвующих в образовании аденозина при гипоксии [6], или снижению активности аденозиндезаминазы.
Во 2-й группе до назначения ЛКТ также выявлена гипореактивность А2А-рецептора. Тенденция к повышению активности данного рецептора проявилась уже в первые 24 часа после начала ЛКТ и достигла своего максимума через 5 суток. Обращает на себя внимание следующее: если через 24 часа ЛКТ прирост активности А2А-рецептора составлял 8,2% (р<0,01), то через 5 суток – 44,8% (р<0,001) по сравнению с исходным значением. В последующие двое суток активность рецептора оставалась стабильной и соответствовала уровню гипореактивности. Таким образом: (а) крупные конкременты не выводились из верхней трети мочеточника при наличии у пациента гипореактивности А2А-рецептора; (б) сохранение гипореактивности данного рецептора при неэффективной элиминации конкрементов, вероятно, связано с перманентным нарушением кровотока в тканях МВП при наличии в просвете конкрементов. Как следствие гипоксии/ишемии тканей мочеточника устанавливается низкий синтез АТФ в митохондриях и лимитируется образование внеклеточного аденозина в ГМК [7] или возникает дисфункция активности CD73 [8].
Исследовательский вопрос: зависит ли скорость траффика крупного конкремента в верхней трети мочеточника от активности А2А-рецептора, если таковая модулирует степень сокращения стенки мочеточника?
Анализ сроков выведения конкрементов из верхней трети мочеточника в 1-й группе позволил выделить 2 подгруппы пациентов: с быстрой (в течение 72 часов) – подгруппа А, и медленной – подгруппа Б (в течение 7 суток) элиминацией конкрементов. В обеих подгруппах до назначения ЛКТ выявлена гипореактивность А2А-рецептора (табл. 2).
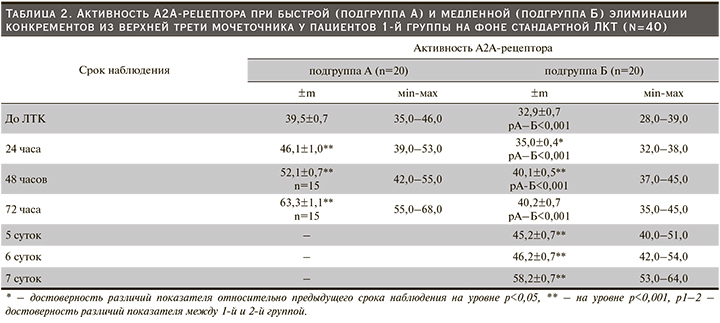
В подгруппе А через 24 часа после начала ЛКТ активность аденозинового рецептора повысилась на 16,7% (р<0,001) по сравнению с исходным уровнем и находилась в диапазоне нормореактивности (первая фаза). Через 48 часов у 5 (12,5%) пациентов на фоне нормореактивности А2А-рецептора (44,0±0,7%, 95% ДИ: 42,0–46,0%) подтверждена элиминация конкрементов из верхней трети мочеточника, при этом активность рецептора превысила исходные значения на 11,4% (р<0,001). У оставшихся 15 пациентов локализация конкрементов не изменилась, хотя активность данного рецептора увеличилась на 13,0% (р<0,001) по сравнению с предыдущим исследованием и возросла на 31,9% (р<0,001) по сравнению с исходным значением. Отмеченный уровень активности А2А-рецептора соответствовал диапазону нормореактивности. Следовательно, достижение нормореактивности А2А-рецептора в процессе ЛКТ не во всех случаях соответствовало быстрой элиминации конкрементов из верхней трети мочеточника.
Через 72 часа после начала ЛКТ у 15 пациентов конкременты перемещались из верхнего отдела в средний и нижний отделы мочеточника; процесс траффика происходил на фоне гиперреактивности А2А-рецептора; активность данного рецептора увеличилась на 21,5% (р<0,001) по сравнению с исходным значением и на 60,2% (р<0,001) по сравнению с исходным значением (вторая фаза). Таким образом, одним из условий быстрой элиминации конкрементов стало достижение уровня гиперреактивности А2А-рецептора. Судя по приросту активности рецептора через 24, 48, 72 часа относительно исходного значения на 16,7%, 31,9 60,2% соответственно аденозин воспроизводил усиление внутриклеточной сигнализации в ГМК; вероятно, при достижении гиперреактивности достигалась максимальная релаксация мышечной оболочки МВП, что способствовало траффику конкрементов.
Во 2-й группе через 24 часа ЛКТ-активность А2А-рецептора сохранялась в диапазоне гипореактивности. В течение 48 часов (первая фаза) после начала ЛКТ активность рецептора возросла на 14,6% (р<0,001) по сравнению с исходными значениями и сохранялась на стационарном уроне в течение 72 часов. Следовательно, у данного контингента больных на протяжении 3 суток поддерживалась гипореактивность А2А-рецептора, при этом ни в одном из случаев не наблюдалось элиминации конкрементов. Вторая фаза усиления аденозиновой сигнализации проявилась через 5 суток, когда активность рецептора повысилась на 12,4 и 37,4% (р<0,001) по сравнению с предыдущей и исходной точками наблюдения; при этом достиглась нижняя граница нормореактивности рецептора. На достигнутом уроне нормореактивность А2А-рецептора сохранялась в течение 6 суток ЛКТ. Через 5–6 суток после начала ЛКТ элиминация конкрементов не выявлена ни в одном из случаев. Третья фаза воспроизведена через 7 суток, в течение которых наблюдалось выведение конкрементов из верхней трети мочеточника у всех пациентов. Активность А2А-рецептора увеличилась на 28,8 и 76,9% (р<0,001) по сравнению с предыдущим и исходным сроками наблюдения; при этом достигался диапазон гиперреактивности. Следовательно, при быстрой и медленной элиминации конкрементов развивается стереотипная компенсаторная реакция, направленная на релаксацию ГМК, для которой характерно достижение гиперреактивности А2А-рецептора. При быстрой элиминации реактивность аденозиновой сигнализации характеризовалась двумя фазами: восстановлением и поддержанием нормореактивности А2А-рецептора на протяжении первых 48 часов ЛКТ, возникновением гиперреактивности рецептора в течение последующих 24 часов. При медленной элиминации конкрементов проявлялись три фазы реактивности аденозиновой сигнализации. Первая фаза длительностью 48 часов, когда сохранялась гипореактивность А2А-рецептора, несмотря на проведение ЛКТ, вторая – продолжительностью 4 суток (с 3-и по 6-е сутки), когда восстанавливалась и поддерживалась нормореактивность рецептора; третья фаза – достижение уровня гиперреактивности А2А-рецептора в течение 24 часов (7-е сутки ЛКТ). Таким образом, при медленном трафике конкрементов по сравнению с быстрой элиминацией принципиальное отличие касается длительности фаз гипореактивности (2 суток) и нормореактивности (4 суток) А2А-рецептора. Установление кинетики активности А2А-рецептора и временных промежутков дисфункции аденозиновой внутриклеточной сигнализации обосновывает необходимость разработки агонистов аденозиновых рецепторов в качестве нового терапевтического подхода к консервативному лечению нефролитиаза.
Заключение
Стандартная ЛКТ при нефролитиазе может влиять на активность аденозинового А2А-рецептора, который модулирует релаксацию ГМК мочеточника. Анализ трансформации пуриновых нуклеотидов в стенке МВП при их обструкции конкрементом, а также исследование влияние аденозина на мышечный тонус ГМК при длительной дилатации мочеточника позволят оценить перспективу использования агонистов А2А-рецепторов для совершенствования тактики консервативного лечения нефролитиаза.



