Введение
В 2014 г. более чем у 600 млн взрослых (от 18 лет и старше) во всем мире было констатировано наличие ожирения. Ожирение – значимый фактор риска поражения почек. Оно увеличивает вероятность развития основных факторов риска хронической болезни почек (ХБП), таких как сахарный диабет и артериальная гипертензия (АГ), и оказывает непосредственное влияние на развитие ХБП и терминальной почечной недостаточности (тХПН). У лиц, страдающих ожирением, формируется гиперфильтрация, по-видимому, как компенсаторная реакция, позволяющая обеспечивать возросшие метаболические потребности организма при увеличении массы тела. Повышение внутриклубочкового давления может приводить к повреждению почечных структур и увеличению риска развития ХБП в отдаленном периоде.
К положительному моменту относится следующее: ожирение, а также ассоциированная с ним ХБП в значительной мере предотвратимы. Просвещение и повышение информированности о рисках ожирения и о пользе здорового образа жизни, в т.ч. правильного питания и физической активности, могут оказать существенную помощь в профилактике ожирения и заболеваний почек. В этой статье, приуроченной к Всемирному Дню почки-2017, анализируется связь между ожирением и поражением почек.
Эпидемиология ожирения у взрослых и детей
За последние три десятилетия распространенность избыточного веса и ожирения (ИМТ≥25 кг/м2) у взрослых во всем мире существенно увеличилась [1]. В 2013–2014 гг. в США скорректированная на возраст распространенность ожирения составила 35% у мужчин и 40,4% у женщин [2]. Проблема ожирения также затрагивает детей. В США в 2011–2014 гг. распространенность ожирения у детей и подростков в возрасте 2–19 лет составила 17%, а крайней степени ожирения – 5,8%. Прирост распространенности ожирения остается глобальной проблемой [3, 4]: прогнозируют, что в следующем десятилетии он достигнет 40% по всему миру. В странах с низким и средним уровнями дохода в настоящее время наблюдается переход от нормальной массы тела к избыточной и ожирению. Это та же тенденция, которая наблюдалась несколько десятилетий назад в части европейских стран и в США [5]. Такое увеличение распространенности ожирения вносит вклад в развитие сердечно-сосудистых заболеваний (ССЗ) и ХБП. Высокий индекс массы тела (ИМТ) – один из наиболее значимых факторов риска развития ХБП [6, 7].
Определение ожирения чаще всего основано на величине ИМТ (т.е. массы тела [в кг], разделенной на квадрат роста [в м]). Значение ИМТ в интервале от 18,5 до 25 кг/м2, согласно определению Всемирной организации здравоохранения (ВОЗ), считается нормальным весом, ИМТ в пределах от 25 до 30 кг/м2 рассматривают как избыточный вес, а ИМТ>30 кг/м2 – как ожирение. Несмотря на то что ИМТ легко рассчитать, этот показатель не позволяет оценить характер распределения жировой массы; так, у лиц с хорошо развитой мускулатурой или с преимущественно подкожным распределением жира ИМТ может быть таким же, как и у лиц с преимущественно интраабдоминальным (висцеральным) ожирением. Высокое значение ИМТ при висцеральном ожирении ассоциировано с гораздо более высоким риском метаболических нарушений и ССЗ. Альтернативные показатели, точнее характеризующие избыток висцерального жира, включают окружность талии (ОТ) и соотношение окружностей талии и бедер (ОТ/ОБ): соответственно >102 см и >0,9 у мужчин и >88 см и >0,8 у женщин. Показано, что для корректной классификации ожирения при ХБП критерий ОТ превосходит критерий ИМТ.

Связь ожирения с ХБП и другими осложнениями со стороны почек
В многочисленных популяционных исследованиях обнаружена ассоциация между показателями ожирения и развитием, а также прогрессированием ХБП (см. таблицу). У лиц без заболеваний почек повышение ИМТ ассоциировано с наличием [8] и появлением [9–11] протеинурии. Более того, по данным многочисленных крупных популяционных исследований, более высокие значения ИМТ оказались связанными с наличием [8, 12] или возникновением снижения расчетной СКФ (рСКФ) [9, 10, 13], а также с более быстрыми темпами дальнейшего падения рСКФ [14] и развитием тХПН [15–18]. У пациентов с предсуществующей ХБП повышение ИМТ, ожирение II степени и выше были ассоциированы с более быстрым прогрессированием ХБП [19]. В нескольких исследованиях, оценивавших взаимосвязь между ХБП и адбоминальным ожирением (диагностированным по величине ОТ и соотношению ОТ/ОБ), описана ассоциация между более высокими значениями охвата талии и бедер и альбуминурией [20], снижением СКФ [8] и развитием тХПН [21] независимо от уровня ИМТ.
Увеличение количества висцеральной жировой ткани, измеренной при компьютерной томографии, ассоциировано с большей распространенностью альбуминурии у мужчин [22]. Наличие не зависимой от величины ИМТ ассоциации между абдоминальным ожирением и худшими почечными исходами также описано при изучении смертности среди пациентов с тХПН [23] и среди реципиентов почечного трансплантата [24]. Эти данные свидетельствуют о непосредственном влиянии висцеральной жировой ткани на почки. В целом взаимосвязь между ожирением и неблагоприятными почечными исходами сохраняется даже после поправки на возможные факторы, опосредующие сердечно-сосудистые и метаболические эффекты ожирения – такие, как высокое АД и сахарный диабет, что свидетельствует о том, что ожирение может влиять на функцию почек посредством механизмов, частично не связанных с этими осложнениями (см. ниже). Отрицательное воздействие ожирения на почки распространяется на другие осложнения, такие как нефролитиаз и злокачественные новообразования почек. Повышение ИМТ ассоциировано с увеличением распространенности [25] и заболеваемости [26, 27] нефролитиазом. Более того, прибавка в весе с течением времени, так же как и бόльший исходный показатель ОТ, тоже были ассоциированы с более высокой заболеваемостью нефролитиазом [27]. Ожирение ассоциировано с различными видами злокачественных новообразований, в частности с раком почки. В популяционном исследовании с участием 5,24 млн жителей Великобритании увеличение ИМТ на 5 кг/м2 было ассоциировано с повышением риска рака почки на 25%, причем 10% всех случаев рака почки приходилось на лиц с избыточным весом [28]. В другом крупном исследовании, посвященном анализу глобального влияния ожирения на злокачественные новообразования, было показано что 17 и 26% всех случаев рака почки у мужчин и женщин соответственно приходились на лиц с избыточной массой тела [29]. Как показал мета-анализ, включивший 221 исследование (в т.ч. 17, посвященных непосредственно раку почки), ассоциация между ожирением и раком почки оказалась устойчивой как у мужчин, так и у женщин в различных странах мира. Среди всех злокачественных новообразований, оцениваемых в этом мета-анализе, рак почки занимал третье место по степени риска, ассоциированного с ожирением (относительный риск при повышении ИМТ на 5 кг/м2: 1,24; 95% ДИ – 1,20–1,28, р<0,0001) [30].
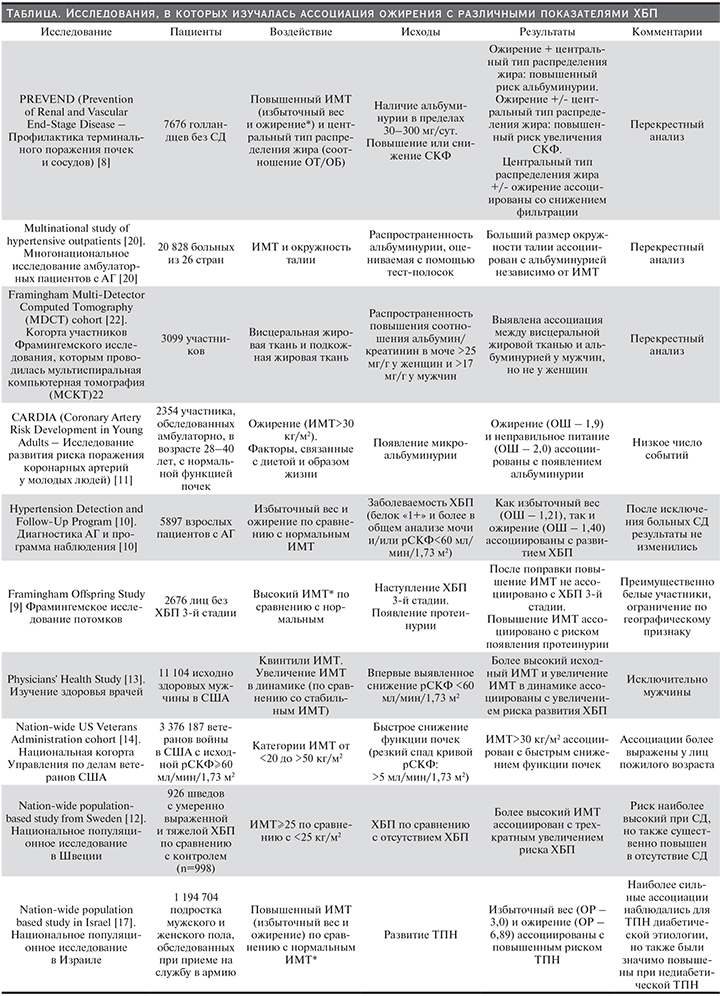
 Механизмы, лежащие в основе воздействия ожирения на почки
Механизмы, лежащие в основе воздействия ожирения на почки
Ожирение приводит к комплексу метаболических нарушений, которые оказывают различное повреждающее действие на почки. Точные механизмы, посредством которых ожирение может ухудшить течение или привести к развитию ХБП, по-прежнему не установлены. Сам факт, что у большинства лиц с ожирением не развивается ХБП и что до 25% лиц с ожирением считаются «метаболически здоровыми», свидетельствует о том, что самого по себе увеличения массы тела недостаточно для индукции повреждения почек [31]. Некоторые из неблагоприятных последствий воздействия ожирения на почки могут быть результатом развивающихся в дальнейшем коморбидных состояний, таких как сахарный диабет или АГ, но выделяют также непосредственное влияние жировой ткани на почки, связанное с эндокринной активностью продуцируемых адипоцитами веществ, среди которых важная роль принадлежит адипонектину [32], лептину [33] и резистину [34] (рис. 1). В результате запускается ряд процессов, в т.ч. воспаление [35], оксидативный стресс [36], нарушение метаболизма липидов [37], активация ренин-ангиотензин-альдостеновой системы [38], увеличение продукции инсулина и формирование инсулинорезистентности [39, 40].
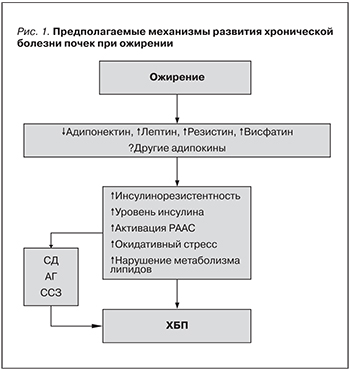
Вышеуказанные воздействия приводят к специфическим патологическим изменениям в почках [41] и могут лежать в основе увеличения риска ХБП, обнаруженного в наблюдательных исследованиях. Патологические изменения включают эктопическое накопление липидов [42] и увеличение количества жировых отложений в почечном синусе [43, 44], развитие клубочковой гипертензии и увеличение проницаемости клубочков вследствие индуцированного гиперфильтарцией повреждения гломерулярного фильтрационного барьера [45], в конечном счете – развитие гломеруломегалии [46] и фокального или сегментарного гломерулосклероза [41] (рис. 2). Частота развития т.н. гломерулопатии, ассоциированной с ожирением (ГАО), с 1986 по 2000 г. возросла в 10 раз [41]. Важно отметить, что ГАО часто сочетается с патологическими процессами, обусловленными другими состояниями или пожилым возрастом, что приводит к более выраженному поражению почек у больных с высоким АД [47] или у пожилых пациентов [14, 39].
Ожирение ассоциировано с рядом факторов риска, вносящих вклад в более высокую заболеваемость и распространенность нефротилиаза. Более высокая масса тела ассоциирована с более низким значением рН мочи [48] и повышенной экскрецией с мочой оксалатов [49], мочевой кислоты, натрия и фосфатов [50]. Диета, богатая белком и натрием, может способствовать закислению мочи и снижению в ней концентрации цитрата, что также повышает риск камнеобразования. Инсулинорезистентность, характерная для ожирения, также может предрасполагать к нефролитиазу [51], влияя на Na/H-транспортер в канальцах [52] и аммониагенез [53] и способствуя поддержанию кислой реакции мочи [54]. Усложняет картину тот факт, что некоторые методы снижения веса способствуют скорее увеличению, чем снижению риска камнеобразования; например, операции на желудке могут приводить к значительному возрастанию всасывания оксалатов в кишечнике и повышению риска нефролитиаза [55].
Механизмы, лежащие в основе увеличения риска рака почки, наблюдаемого у лиц с ожирением, изучены недостаточно. Стимулирующее влияние на рост разных типов опухолевых клеток могут оказывать инсулинорезистентность с последующей хронической гиперинсулинемией, увеличение продукции инсулиноподобного фактора роста 1, а также комплекс многочисленных вторичных гуморальных эффектов [56]. И уже в самое последнее время в качестве дополнительных эндокринных воздействий жировой ткани [57] стали рассматривать ее влияние на иммунитет [58] и формирование воспалительного окружения, оказывающие комплексное воздействие на механизмы канцерогенеза [59, 60].
Ожирение у пациентов с далеко зашедшими стадиями заболеваний почек: необходим дифференцированный подход.
 Учитывая вышеизложенные доказательства чрезвычайно неблагоприятного влияния ожирения на различные патологические процессы, представляется парадоксальным наличие стойкой ассоциации ожирения с более низкой смертностью у пациентов с тяжелой ХБП [19, 61] и тХПН [62, 63]. Аналогичная «парадоксальная» ассоциация также была описана в других популяциях, например у пациентов с застойной сердечной недостаточностью [64], хронической обструктивной болезнью легких [65], ревматоидным артритом [66] и даже просто у лиц пожилого возраста [67]. Возможно, что кажущийся протективный эффект высокого ИМТ представляет собой следствие несовершенства показателя ИМТ как критерия ожирения, поскольку он не позволяет отличать влияние ожирения от такового повышенной нежировой массы. И действительно, в тех исследованиях, где влияние бόльшего размера окружности талии и повышенного ИМТ изучали отдельно, прямая взаимосвязь со смертностью не наблюдалась [23, 24]. Кроме того, показано, что как минимум некоторые положительные эффекты, связанные с повышенным ИМТ, объясняются наличием более высокой мышечной массы [63, 68]. Тем не менее существуют доказательства, свидетельствующие, что увеличение количества жировой ткани, особенно подкожной (невисцеральной), также может быть ассоциировано с лучшими исходами у пациентов с тХПН [62]. Такие преимущества действительно могут присутствовать у пациентов с очень низкой ожидаемой ближайшей продолжительностью жизни (как, например, у большинства пациентов с тХПН) [69]. Так, исследования, в которых изучали ассоциацию ИМТ с выживаемостью при тХПН в различные сроки, продемонстрировали резкий контраст между протективными краткосрочными эффектами и неблагоприятными отдаленными последствиями повышенного ИМТ [70]. Предполагается, что существует несколько преимуществ более высокой массы тела, особенно у ослабленных лиц. К ним относятся лучший нутритивный статус, присутствующий, как правило, у лиц с ожирением и обеспечивающий лучшие белково-энергетические резервы в случае острого заболевания; а также более высокая мышечная масса с бόльшим антиоксидантным потенциалом [63], снижение циркулирующего актина и повышение содержания гельсолина в плазме крови [71], что ассоциировано с лучшими исходами. Другими предполагаемыми преимуществами ожирения является более стабильная гемодинамика с уменьшением выраженности ответа на стресс и повышенную активность симпатической и ренин-ангиотензиновой систем [72], увеличение продукции жировой тканью адипонектинов [73] и растворимой формы рецепторов фактора некроза опухоли-α (ФНО-α) [74], нейтрализующей неблагоприятные эффекты ФНО-α; увеличение связывания циркулирующих эндотоксинов [75] за счет повышенного холестерина, как правило характерного для ожирения; секвестрация уремических токсинов в жировой ткани [76].
Учитывая вышеизложенные доказательства чрезвычайно неблагоприятного влияния ожирения на различные патологические процессы, представляется парадоксальным наличие стойкой ассоциации ожирения с более низкой смертностью у пациентов с тяжелой ХБП [19, 61] и тХПН [62, 63]. Аналогичная «парадоксальная» ассоциация также была описана в других популяциях, например у пациентов с застойной сердечной недостаточностью [64], хронической обструктивной болезнью легких [65], ревматоидным артритом [66] и даже просто у лиц пожилого возраста [67]. Возможно, что кажущийся протективный эффект высокого ИМТ представляет собой следствие несовершенства показателя ИМТ как критерия ожирения, поскольку он не позволяет отличать влияние ожирения от такового повышенной нежировой массы. И действительно, в тех исследованиях, где влияние бόльшего размера окружности талии и повышенного ИМТ изучали отдельно, прямая взаимосвязь со смертностью не наблюдалась [23, 24]. Кроме того, показано, что как минимум некоторые положительные эффекты, связанные с повышенным ИМТ, объясняются наличием более высокой мышечной массы [63, 68]. Тем не менее существуют доказательства, свидетельствующие, что увеличение количества жировой ткани, особенно подкожной (невисцеральной), также может быть ассоциировано с лучшими исходами у пациентов с тХПН [62]. Такие преимущества действительно могут присутствовать у пациентов с очень низкой ожидаемой ближайшей продолжительностью жизни (как, например, у большинства пациентов с тХПН) [69]. Так, исследования, в которых изучали ассоциацию ИМТ с выживаемостью при тХПН в различные сроки, продемонстрировали резкий контраст между протективными краткосрочными эффектами и неблагоприятными отдаленными последствиями повышенного ИМТ [70]. Предполагается, что существует несколько преимуществ более высокой массы тела, особенно у ослабленных лиц. К ним относятся лучший нутритивный статус, присутствующий, как правило, у лиц с ожирением и обеспечивающий лучшие белково-энергетические резервы в случае острого заболевания; а также более высокая мышечная масса с бόльшим антиоксидантным потенциалом [63], снижение циркулирующего актина и повышение содержания гельсолина в плазме крови [71], что ассоциировано с лучшими исходами. Другими предполагаемыми преимуществами ожирения является более стабильная гемодинамика с уменьшением выраженности ответа на стресс и повышенную активность симпатической и ренин-ангиотензиновой систем [72], увеличение продукции жировой тканью адипонектинов [73] и растворимой формы рецепторов фактора некроза опухоли-α (ФНО-α) [74], нейтрализующей неблагоприятные эффекты ФНО-α; увеличение связывания циркулирующих эндотоксинов [75] за счет повышенного холестерина, как правило характерного для ожирения; секвестрация уремических токсинов в жировой ткани [76].
Потенциальные возможности лечения ожирения
Ожирение вызывает прямое повреждение почек вследствие нарушенного синтеза жировой тканью различных цитокинов с нефротоксическим действием, а также опосредованное – за счет индукции развития сахарного диабета и АГ, являющихся наиболее значимыми факторами риска ХБП. Возможно, благодаря преимуществам ожирения в отношении выживаемости при ХБП распространенность тХПН достигла пикового значения как в США [77], так и в Европе [78]. Разработка стратегии по контролю на популяционном уровне эпидемии ХБП, связанной с ожирением, и по предупреждению у пациентов с ожирением прогрессирования ХБП до стадии почечной недостаточности является мучительно сложной задачей, с которой в настоящее время сталкиваются организаторы здравоохранения, руководители медицинских учреждений и нефрологическое сообщество.
Борьба с ХБП на популяционном уровне
Крупные нефрологические ассоциации, в т.ч. Международное общество нефрологов (International Society of Nephrology, ISN), Международная федерация почечных фондов (International Federation of the Kidney Foundation, IFKF), Европейская нефрологическая ассоциация (European renal association, ERA-EDTA) и различные национальные сообщества, призывают к проведению на популяционном уровне мероприятий по профилактике и лечению ХБП на ранней стадии. В США 10-летняя целевая программа в сфере здравоохранения «Здоровые люди-2020» (Healthy People 2020), пропагандирующая здоровый образ жизни и профилактику, направлена как на ХБП, так и на ожирение. Первым шагом к разработке мероприятий по охране здоровья служат опросы для выявления больных ожирением, в частности лиц с высоким риском ХБП (например, пациентов с ожирением и АГ и/или сахарным диабетом) и лиц, не получающих лечения в полном объеме. Целью проведения таких опросов является информирование таких пациентов о том, что у них существует потенциальный риск развития ХБП. Приоритетным для определения целей и средств модификации риска служит накопление доказательств того, что современные вмешательства по снижению риска ХБП при ожирении эффективны и доступны. Необходимо адекватно документировать уже накопленные знания о риске ХБП и о пользе мероприятий по первичной и вторичной профилактике ХБП у лиц с ожирением, а также проводить новые исследования в этой популяции для восполнения имеющихся пробелов в знаниях (см. ниже). Наконец, наблюдательные программы для мониторинга прогрессирования ХБП у лиц с выявленным повышенным риском и оценка эффективности уже действующих профилактических программ [79] являются третьим основным элементом стратегии эффективной профилактики ХБП в популяции.
Успешно действующие системы наблюдения за больными с ХБП уже внедрены в некоторых странах, например в Великобритании [80]. Там была развернута кампания по распространению и применению рекомендаций K-DOQI по ХБП на уровне первичного звена оказания медицинской помощи в рамках Национальной службы здравоохранения Великобритании (UK National Health Service). Это постепенно повысило степень внедрения рекомендаций K-DOQI а также благодаря системе поощрения врачей общей практики в Великобритании к выявлению ХБП привело к впечатляющему улучшению диагностики и лечения ХБП, т.е. лучшему контролю АГ и более частому применению ингибиторов ангиотензинпревращающего фермента и блокаторов рецепторов ангиотензина II [80]. Эта система может служить платформой для улучшения профилактики ХБП, ассоциированной с ожирением. Кампании, направленные на снижение бремени ожирения, сейчас в центре внимания во всем мире и настоятельно рекомендуются ВОЗ. Ожидается, что они позволят снизить частоту возникновения связанных с ожирением осложнений, в т.ч. ХБП. Тем не менее цели, непосредственно связанные с ожирением у пациентов с ХБП и ожирением, по-прежнему нечетко сформулированы – во многом из-за недостаточного числа высококачественных доказательств, полученных в интервенционных исследованиях по модификации ожирения у пациентов с ХБП [81].
Профилактика прогрессирования ХБП у пациентов с ХБП и ожирением
Наблюдательные исследования метаболически здоровых лиц с ожирением продемонстрировали, что фенотип ожирения, не ассоциированный с метаболическими нарушениями как таковыми, служит предиктором более высокого риска развития ХБП [82], свидетельствуя, что ожирение само по себе может вызывать дисфункцию и повреждение почек даже в отсутствие сахарного диабета или АГ (см. выше). Показано, что у больных сахарным диабетом с избыточным весом или у пациентов с ожирением изменение образа жизни, включая ограничение калорийности пищи и увеличение физической активности, снижает риск развития ХБП на 30% по сравнению со стандартным ведением, основанным лишь на обучении и поддержке в лечении диабета, хотя и не влияет на частоту развития сердечно-сосудистых событий [83]. Этот протективный эффект отчасти был обусловлен снижением массы тела, уровня гликированного гемоглобина и систолического АД. При этом никаких нежелательных явлений со стороны почек отмечено не было [83]. В недавно проведенном мета-анализе, сравнивавшем результаты экспериментальных исследований пациентов с ХБП и ожирением, вмешательства, направленные на снижение массы тела, демонстрировали последовательное снижение АД, уменьшение клубочковой гиперфильтрации и протеинурии [81]. Тщательный ретроспективный анализ исследования REIN показал, что нефропротективный эффект ингибиторов АПФ у пациентов с ХБП и протеинурией был максимально выражен при ХБП с ожирением и минимален при ХБП с нормальным или низким ИМТ [84]. Следует отметить, что отдельным пациентам с ХБП и тХПН, в т.ч. диализным больным, включенным в лист ожидания трансплантации, предлагается проведение бариатрических операций [85–87].
В целом эти экспериментальные результаты обеспечили доказательства концепции о пользе снижения массы тела и терапии ингибиторами АПФ при лечении ХБП у лиц с ожирением. Результаты некоторых исследований, свидетельствующие о положительном влиянии увеличения ИМТ на выживаемость пациентов с ХБП, по-прежнему требуют объяснений [88]. Эти данные ограничивают наши возможности по формулировке четких рекомендаций относительно пользы и безопасности снижения массы тела у лиц с более поздними стадиями ХБП. Рекомендации по изменению образа жизни с целью снижения массы тела у лиц с ожирением и риском ХБП или с ранней стадией ХБП представляются оправданными, в особенности рекомендации по контролю сахарного диабета и АГ. Поскольку независимое влияние контроля над ожирением на возникновение и прогрессирование ХБП трудно отделить от влияния АГ и сахарного диабета 2 типа, рекомендации по снижению веса у небольшой части метаболически здоровых лиц с ожирением и без АГ остаются по-прежнему не подтвержденными. Все эти соображения свидетельствуют о том, что к лечению избыточного веса и ожирения у пациентов с поздними стадиями ХБП или другими значимыми сопутствующими заболеваниями следует подходить осторожно – с учетом ожидаемой пользы и возможных последствий снижения массы тела на протяжении жизни каждого конкретного пациента.
Заключение
Общемировая эпидемия ожирения многообразно воздействует на население земного шара. Заболевания почек, включая ХБП, нефролитиаз и рак почки, входят в число наиболее пагубных последствий ожирения, но помимо этого имеется широкий диапазон других неблагоприятных последствий, в конечном итоге приводящих к значительному повышению заболеваемости, смертности и увеличению личных и общественных затрат на лечение. Проводимые на популяционном уровне мероприятия по контролю ожирения могут оказывать положительное влияние на профилактику развития или замедление прогрессирования ХБП. На все медицинское сообщество возложена задача по разработке долгосрочной стратегии, направленной на улучшение понимания взаимосвязи между ожирением и заболеваниями почек, определение оптимальных путей противодействия им. Всемирный День почки-2017 дает большие возможности повысить уровень образования и информированности в этом направлении.



