Как известно, эндометриоз (ЭМ) является чрезвычайно распространенным заболеванием, которое чаще всего встречается среди пациенток репродуктивного возраста. В практической деятельности гинеколога-репродуктолога каждая третья пациентка, обращающаяся с проблемой бесплодия, страдает ЭМ. При этом нередко приходится сталкиваться с тем, что ранее у таких женщин уже проводилось специальное лечение. Однако чаще оно соответствовало тактике ведения пациенток с болевым синдромом, не планирующих беременность. Это приводит к необоснованным материальным и временным затратам, что в долгосрочной перспективе снижает шанс на зачатие. Задача настоящей публикации – объединить данные зарубежных и российских руководств по методам лечения пациенток с ЭМ, чтобы сформировать среди всех гинекологов единую тактику ведения данной группы больных и ускорить нелегкий путь женщины к рождению ребенка.
Эндометриоз и бесплодие: а есть ли связь?
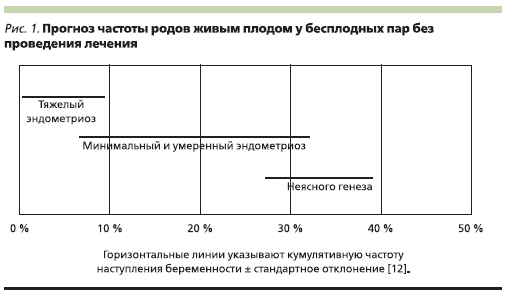
Известно, что бесплодием страдают не все пациентки с эндометриозом (ЭМ), а лишь 35–50 % [35]. Возможно, это связано с разной степенью тяжести заболевания, т. к. частота бесплодия растет по мере усугубления тяжести ЭМ (рис. 1).
Связь между ЭМ и бесплодием продолжает активно изучаться и обсуждаться. Исследования на животных [9] и некоторые клинические исследования [18, 26] свидетельствуют о неблагоприятном влиянии ЭМ на репродуктивную функцию. Так, показатель ежемесячной фертильности у женщин
с ЭМ ниже, чем у женщин без ЭМ (0,02–0,10 и 0,15–0,20 соответственно) [26]. Подтверждена более высокая распространенность этого заболевания среди женщин с бесплодием по сравнению с женщинами, которым проведена добровольная хирургическая стерилизация [17].
Пока отсутствует полное понимание механизмов, лежащих в основе бесплодия, связанного с ЭМ. При более распространенных формах ЭМ бесплодие может быть связано с нарушением анатомии органов малого таза вследствие спаечного процесса, приводящего к механической окклюзии маточных труб, нарушением процессов выхода яйцеклетки из яичника в момент овуляции. Болевой синдром, возникающий при половых актах (глубокая диспареуния), также может являться причиной бесплодия, т. к. затрудняет регулярную половую жизнь. При минимальном или умеренном ЭМ связь со снижением фертильности менее очевидна, и до настоящего времени нет никаких убедительных доказательств, подтверждающих наличие точного биологического механизма бесплодия у таких пациенток [22].
Большинство данных о связи между ранними стадиями ЭМ и бесплодие получено в ходе проспективных исследований с использованием внутриматочной инсеминации спермой донора, при которой показатель ежемесячной фертильности составил 0,12 у женщин без ЭМ и 0,036 у пациенток с минимальными проявлениями болезни [29].
Важную роль в этих нарушениях отводят абсолютной или относительной гиперэстрогении, характерной для ЭМ, которая может приводить к функциональной неполноценности маточных труб, нарушениям процессов овуляции, к формированию синдрома неовулировавшего фолликула, недостаточности лютеиновой фазы цикла. Недавно проведенный обзор литературных данных указывает на возможную роль локального воспаления, нарушения иммунного ответа и неоангиогенеза в сложных механизмах, ведущих к нарушению фертильности при ЭМ [10].
Известно, что у женщин с эндометриоидной болезнью имеется значительное количество перитонеальной жидкости [32], которая характеризуется высоким содержанием активированных макрофагов, продуцирующих цитокины: фактор некроза опухоли α (ФНО-α), интерлейкин-1β (ИЛ-1β),
ИЛ-6, ИЛ-8 [6, 51], а также высоким содержанием фактора роста эндотелия сосудов, фактора роста фибробластов, инсулиноподобного фактора роста-1 и трансформирующего фактора роста-β [12, 44]. Эти факторы роста проявляют абсолютно разные биологические свойства, играют важную роль в миграции, пролиферации и дифференцировке мезенхимальных клеток в процессе эмбриогенеза и влияют на жизнеспособность эмбриона. Неадекватная продукция факторов роста и медиаторов воспаления приводит к дисбалансу процессов пролиферации и апоптоза [20]. Высокие концентрации цитокинов, факторов роста и активированных макрофагов, содержащихся в перитонеальной жидкости, являются токсичными для сперматозоидов [27].
Считается, что одной из причин повышенной выработки различных воспалительных медиаторов при ЭМ является активация толл-подобных рецепторов 4-го типа (Тoll-like receptor-4, TLR4). В 1985 г. при исследовании различных мутаций у мушкидрозофилы знаменитый немецкий биолог К. Нюсляйн-Фольхард обнаружила личинки-мутанты с недоразвитой вентральной частью тела. Ее немедленная
реплика была: “Das war ja toll!” (“Вот это класс!”). Эпитет толл (классный) был позднее дан соответствующему гену в качестве его названия. В 1996 г. выяснилось, что этот ген отвечает не только за дорзо-вентральную поляризацию при эмбриональном развитии, но и за устойчивость дрозофилы к грибковой инфекции. Это открытие французского ученого Ж. Хоффмана было удостоено
Нобелевской премии 2011 г. В настоящее время известно 13 толл-подобных рецепторов млекопитающих, обозначенных аббревиатурами от TLR1 до TLR13, которые связывают различные
лиганды и продуцируются в организме различными типами клеток. У человека существует 10 толл-подобных рецепторов (от TLR1 до TLR10). Было показано, что TLR4 играет важную роль в патогенезе ЭМ. В эктопическом эндометрии экспрессия TLR4 гораздо выше, чем в нормальном.
Появляется все больше данных о влиянии ЭМ на состояние эндометрия и его роль в нарушении имплантации, что также может выступать в качестве причины бесплодия. Пока неясно, является ли это следствием нарушения васкуляризации эндометрия, или связано с иммунными нарушениями.
У женщин с ЭМ в эндометрии можно выявить повышенные уровни аутоантител к антигенам эндометрия (иммуноглобулинам G – IgG и IgA) и лимфоцитов. Недавно было показано, что у таких пациенток значительно снижается синтез лигандов эндометрия к L-селектину – белку, который расположен на поверхности бластоцисты и обеспечивает удержание и нидацию эмбриона в эндометрий [40]. Также накапливаются сведения о мутациях и изменении экспрессии некоторых генов как в эктопическом, так и в нормальном эндометрии в различные фазы цикла.
Мета-анализ по оценке эффективности программ вспомогательных репродуктивных технологий (ВРТ)
показал, что у пациенток с ЭМ частота наступления беременности почти в 2 раза ниже, чем у женщин с трубноперитонеальным бесплодием [7]. Невысокие показатели экстракорпорального оплодотворения (ЭКО) при ЭМ связывают с более низким овариальным резервом, худшим качеством ооцитов и эмбрионов и нарушениями имплантации [45, 47].
После проведения контролируемых проспективных исследований не было выявлено доказательств того, что ЭМ связан с привычным невынашиванием беременности [45, 42], или того, что гормональное лечение ЭМ или оперативное вмешательство снижают частоту выкидышей [28].
Обследования пациенток с эндометриозом
Как правило, пациентка с ЭМ попадает к гинекологу-репродуктологу уже с установленным диагнозом ЭМ после хирургического лечения. Однако бывают ситуации, когда оценка состояния тазовых органов с помощью лапароскопии еще не проводилась, но клиническая картина уже позволяет заподозрить ЭМ (дисменорея, диспареуния, дизурия, овуляторные боли, хроническая тазовая боль и т. п.). В таких
случаях обследование должно включать сбор анамнеза (возраст менархе, характеристики менструального цикла, предыдущие беременности и их исходы, использование гормональной терапии, хирургический анамнез, семейный анамнез, касающийся ЭМ или гинекологических раков), физикальный осмотр (бимануальный и ректовагинальный, более информативны во время менструации) и визуализационные методы исследования: трансвагинальное ультразвуковое исследование (УЗИ), при необходимости – магнитно-резонансная томография, ректальное УЗИ, цистоскопия, колоноскопия. По рекомендациям Канадского руководства по ЭМ (2010), рутинное тестирование на СА-125 как часть диагностического исследования ЭМ выполняться не должно, хотя уровень СА-125 в сыворотке крови может быть несколько повышен при умеренных и тяжелых формах ЭМ [34].Результаты мета-анализа 23 исследований, в которых изучались уровни СА-125 в сыворотке крови у женщин
с хирургически подтвержденным диагнозом ЭМ, чувствительность этого анализа составляла только 28 %, а специфичность – 90 % [33]. Однако при выявлении любого образования яичника, в т. ч. эндометриоидной кисты (ЭМК), для исключения рака уровень СА-125 все же определяют. При наличии ЭМК он, как правило, выше нормы, но гораздо ниже, чем при раке яичников.
“Золотой” стандарт диагностики ЭМ – прямая визуализация в ходе лапароскопии и гистологическое исследование, поэтому в молодом возрасте при нормальных показателях спермограммы у партнера пациентка в обязательном порядке направляется на лапароскопию для уточнения состояния тазовых органов и при необходимости – оперативного лечения. Тактика для пациенток старшего репродуктивного возраста и при тяжелом мужском бесплодии будет рассмотрена ниже.
Лечение бесплодия при эндометриозе
Тактика ведения пациенток с бесплодием и ЭМ зависит от степени тяжести заболевания, возраста пациентки и сопутствующих факторов бесплодия.
Тактика ведения пациенток моложе 35 лет при фертильной сперме партнера
Тактика при эндометриозе I–II степеней тяжести. E. Hughes и соавт. [25] провели мета-анализ всех рандомизированных клинических исследований (РКИ), в которых изучалось подавление овуляции у женщин с ЭМ и влияние этого метода лечения на репродуктивную функцию. Результаты показали,
что подавление функции яичников для повышения фертильности при минимальных и умеренных формах ЭМ не эффективно. Национальные руководства разных стран – США (ASRM – American Society for Reproductive Medicine, 2006), Канады (2010), Британии (RCOG – Royal College of Obstetricians and Gynaecologists, 2006), Европы (ESHRE – European Society of Human Reproduction and Embryology, пересмотр 2008), России (Национальное руководство, 2011) не рекомендуют назначать гормональное
лечение с целью восстановления фертильности [2, 34, 41].
Основным методом лечения молодых пациенток при ЭМ I–II степеней тяжести при фертильной сперме партнера является хирургическое лечение, которое повышает частоту наступления беременности [28]. Хирургическое вмешательство предпочтительно выполнять с помощью лапароскопического доступа, который позволяет добиваться сокращения времени госпитализации и реабилитации, обеспечивая более качественную визуализацию эндометриоидных гетеротопий даже в самых “недоступных” местах и сопровождается меньшим образованием спаек [50]. Очаги ЭМ могут быть удалены во время лапароскопии при помощи эксцизии, коагуляции или вапоризации с использованием лазера (углекислый, калийтитанил-фосфатный или аргоновый лазер). Иссечение патологических
очагов с подлежащей брюшиной считается предпочтительным. На данный момент эффективность антибактериальных препаратов, кортикостероидов, нестероидных противовоспалительных средств и фибринолитиков в отношении профилактики развития спаек после хирургического лечения не подтверждена. Противоспаечные барьеры потенциально полезны. По данным некоторых клинических исследований, они снижают частоту формирования спаек, однако необходимы дальнейшие исследования, направленные на поиск более эффективных профилактических веществ, т. к. пока нет
данных об улучшении фертильности при использовании этих веществ [15].
Гормональное подавление функции яичников, по данным большинства международных рекомендаций, до или после хирургического лечения ЭМ также не показано, т. к. нет никаких свидетельств повышения эффективности терапии сверх того, что позволяет достигать хирургическое лечение [1].
Гормональная терапия лишь продлевает временнóй промежуток, отведенный на лечение, и задерживает наступление беременности.
Тактика ведения пациенток после хирургического лечения должна быть активной, т. к. шансы на наступление беременности максимальны в первые 6 месяцев после операции. В целом на наступление беременности естественным путем отводится 12–18 месяцев. Отслеживается овуляция (т. н. программируемое зачатие), при необходимости проводится индукция овуляции и внутриматочная инсеминация. По данным некоторых РКИ, внутриматочная инсеминация (ВМИ) в стимулированном цикле улучшает фертильность при ЭМ минимальной и средней степенях тяжести. Однако эффективность ВМИ без контролируемой индукции овуляции (КИО) остается неясной [46].
После 3–4 циклов КИО и ВМИ вероятность зачатия характеризуется эффектом плато, поэтому после
нескольких неудачных циклов рекомендуется переходить к лечению с помощью ВРТ (ESHRE, пересмотр 2008).
Тактика при эндометриозе III–IV степеней тяжести. РКИ или метаанализы по оценке эффективности
хирургического лечения ЭМ умеренной и тяжелой степеней на частоту наступления беременности отсутствуют. Результаты трех нерандомизированных исследований свидетельствуют о существовании обратной связи между тяжестью болезни и частотой спонтанной беременности после хирургического лечения ЭМ, хотя статистическая значимость была достигнута только в одном исследовании [1]. Положительное влияние хирургического лечения глубоких инфильтративных форм ЭМ, в т. ч. ректовагинального, на сегодняшний день не доказано [49]. Вследствие этого большинство национальных руководств (канадских, американских, европейских) при ЭМ III–IV степеней тяжести рекомендуют после оперативного лечения переходить на программы ВРТ [1]. Некоторые авторы рекомендуют сразу направлять пациенток на ЭКО при подозрении на тяжелые формы ЭМ без предшествующего оперативного лечения [3].
Поскольку ЭМ является эстрогензависимым заболеванием, существуют опасения относительно негативного влияния сверхфизиологического уровня эстрогенов во время индукции супер-
овуляции. Но риск повторного проявления болезни не является поводом откладывать ЭКО-терапию после оперативного вмешательства при 3–4-й стадиях болезни, поскольку уровень повторных проявлений ЭМ после ЭКО не возрастает (уровень доказательности 2а) (ESHRE, пересмотр, 2008).
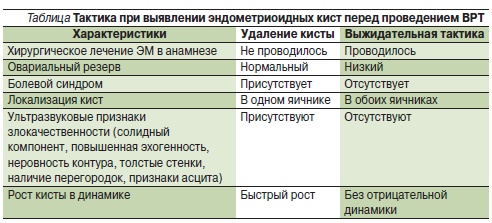
Тактика при эндометриоидных кистах. Основываясь на имеющихся литературных источниках, можно
отметить отсутствие консенсуса касательно метода лечения ЭМК яичников у пациенток с бесплодием. Наличие ЭМК у женщин, планирующих лечение методом ВМИ или ЭКО, предположительно отрицательно влияет на результаты этих методов лечения, хотя литературные источники не предлагают единого мнения по данному вопросу [5, 37]. Преимуществом хирургического лечения кисты перед проведением ВМИ или ЭКО является получение гистологического диагноза. Недостатком является утрата овариальной ткани, окружающей кисту и содержащей фолликулы, что приводит к снижению овариального резерва и плохому ответу яичников на стимуляцию.
Согласно системному обзору Кокрановской базы данных (2010), удаление ЭМК диаметром менее
3 см не дает преимуществ по частоте наступления беременности по сравнению с выжидательной тактикой [8]. Все иностранные руководства по ЭМ рекомендуют удалять ЭМК размером более 3–4 см [1]. Это позволяет получать информацию об удаляемых тканях, может препятствовать развитию злокачественных опухолей, ослаблять тазовые боли и уменьшать дискомфорт при половом акте, снижать риск разрывов кист и перекрута придатков матки, облегчать трансвагинальный доступ к фолликулам в яичниках и, возможно, улучшать ответную реакцию яичников на стимуляцию [34]. В случае рецидива ЭМК, если хирургическое лечение ранее уже проводилось, тактика должна быть пересмотрена. Так как риск малигнизации низок и нет свидетельств об улучшении фертильности в результате проведенного лечения, а риск критической потери фолликулярного аппарата после операции повышается, решение о повторном хирургическом лечении должно быть основано на оценке симптомов и размере кисты: чем значительнее боль или больше размер образования, тем более вероятна потребность в повторном хирургическом вмешательстве (Канадское руководство по эндометриозу, 2010).
В России в связи с высокой онкологической настороженностью в Национальном руководстве пока
сохраняются рекомендации по проведению экономных операций, ставящих задачей удалить кисту с минимальным повреждением здоровой ткани яичников независимо от размера эндометриомы, хотя и обсуждаются тенденции по выжидательной тактике при небольших кистах [2].
J.A. Garcia-Velasco и соавт. (2009) предложили индивидуальный подход к каждой пациентке с ЭМК в зависимости от сопутствующих факторов и данных анамнеза [19] (табл. 1).
Считается, что лапароскопическая цистэктомия крупных ЭМК (диаметром > 4 см) лучше влияет на фертильность, чем дренирование и коагуляция. Коагуляция или лазерная вапоризация ЭМК без эксцизии псевдокапсулы связана с заметно более высоким риском рецидива кисты [11] (уровень доказательности 1b).
Тактика ведения пациенток старше 35 лет при сопутствующих факторах бесплодия
Для пациенток старше 35 лет терапией выбора становятся ВРТ; этого мнения придерживаются все иностранные руководства (уровень доказательности III) [1]. Национальное руководство рекомендует направлять на ЭКО сразу же независимо от формы и тяжести эндометриозного процесса всех пациенток старше 38 лет [2]. Показанием к ЭКО при ЭМ являются также трубноперитонеальное бесплодие, мужской фактор бесплодия и/или неэффективность прочих видов лечения (уровень доказательности 2b). Согласно Национальному руководству, при бесплодии, связанном только с аденомиозом, больным изначально рекомендуют ЭКО, поскольку при внутреннем ЭМ восстановление естественной фертильности с помощью гормонального или эндохирургического лечения представляется бесперспективным [2].
Особенности программ ВРТ у пациенток с эндометриозом
Программы ВРТ при ЭМ имеют свои особенности. Увеличение яичников во время индукции овуляции,
как правило, сопровождается более выраженным болевым синдромом. Раздражение брюшины после пункции фолликулов требует более пристального внимания и более частого проведения дифференциальной диагностики с внутрибрюшным кровотечением. Эффективность программ ВРТ у таких пациенток ниже, чем при других заболеваниях.
Систематический обзор показал, что частота наступления беременности после ЭКО у женщин с ЭМ ниже, чем у женщин с трубно-перитонеальным бесплодием [7]. Обзор включил 22 исследования, состоявших из 2377 циклов для женщин, страдающих ЭМ, и 4383 циклов для женщин без ЭМ.
После корректировки данных оказалось, что пациентки с ЭМ, прошедшие лечение методом ЭКО, имеют на 35 % меньше шансов забеременеть (отношение шансов – 0,63; 95 % доверительный интервал [ДИ] – 0,51–0,77). Прочие параметры, такие как пиковая концентрация эстрадиола, среднее число полученных ооцитов, частота оплодотворения, частота имплантации, также были значимо ниже у женщин с ЭМ по сравнению с пациентками с трубно-перитонеальным бесплодием. Исходя из этого, можно предположить, что наличие ЭМ оказывает влияние на многочисленные факторы, определяющие положительный исход применения метода ЭКО.
Для того чтобы исследовать возможные механизмы сокращения числа беременностей у пациенток с
ЭМ, можно проанализировать данные, полученные из программ ЭКО с донорскими ооцитами. Исследование, в котором были проанализированы результаты 170 доноров ооцитов, не показало статистически значимых результатов, а только тенденцию к более низкой частоте имплантации у реципиентов, если у донора был ЭМ, а также тенденцию к более низкой частоте имплантации у реципиентов, больных ЭМ, что подтвердило влияние ЭМ на эндометрий и качество ооцитов [30]. Однако для окончательных выводов требуется проведение более крупных исследований.
Существует возможность повышения эффективности программ ВРТ при ЭМ с помощью предварительной супрессивной терапии. H.N. Sallam и соавт. [43] представили обзор результатов трех РКИ с участием 165 женщин, у которых для лечения бесплодия при ЭМ использовалась процедура
ЭКО. Частота наступления клинической беременности оказалась намного (почти в 4 раза) выше у тех пациенток, которые в течение 3–6 месяцев перед программой ЭКО получали агонисты гонадотропинилизинг-гормонов (ГнРГ) для подавления функции яичников (относительный риск = 4,28, 95 % ДИ – 2,0–9,15). Однако при длительной подготовке агонистами ГнРГ наблюдается выраженное подавление функции яичников, что проявляется увеличением потребности в гонадотропинах во время стимуляции, медленным ростом фолликулов и эндометрия. В связи с этим канадские и российские руководства рекомендуют проводить супрессивную терапию не более 3 месяцев [2, 34]. По данным
Канадского руководства по ЭМ, подавление функции яичников с помощью агонистов ГнРГ в комбинации с возвратной гормональной терапией перед программой ЭКО у женщин с тазовой болью, ЭМ и бесплодием, значительно улучшает качество жизни и уменьшает дискомфорт во время стимуляции яичников и пункции фолликулов [34].
В качестве более приемлемой для пациенток альтернативы можно использовать комбинированные
оральные контрацептивы (КОК) или прогестины. De Ziegler и соавт. показали, что использование КОК в течение 6–8 недель в непрерывном режиме [16] позволяет женщинам с ЭМ добиваться результатов, сопоставимых с таковыми для пациенток без ЭМ, а доза гонадотропинов на последующую стимуляцию при этом была ниже.
С появлением нового препарата для лечения ЭМ – диеногеста – появились и вопросы о возможности его использования с целью лечения бесплодия при ЭМ. Механизм действия этого препарата при ЭМ связывают не только с подавлением овуляции, но и с влиянием на TLR4. Ингибирование экспрессии гена этого рецептора обеспечивает противовоспалительный эффект, что чрезвычайно важно при
ЭМ [36]. Японские исследователи [52] также показали, что диеногест ингибирует экспрессию ароматазы и циклооксигеназы-2, что приводит к сниже-нию выработки простагландинов Е2, которые играют негативную роль при ЭМ (способствуют синтезу эстрогенов, подавляют апоптоз и способствуют
клеточной пролиферации за счет фактора роста фибробластов-8) [42].
Крупных клинических исследований по применению диеногеста пока немного, тем не менее уже существует один мета-анализ, посвященный сравнению эффективности этого препарата с агонистами ГнРГ. По данным этого исследования, диеногест при непрерывном использовании в дозе 2 мг/сут в течение 24 недель оказался таким же эффективным, как и агонисты ГнРГ при значимо меньшем
влиянии на минеральную плотность костной ткани. Оценка эффективности в лечении ЭМ в исследованиях, вошедших в мета-анализ, проводилась по выраженности болевого синдрома (дисменореи, диспареунии и хронической тазовой боли) [21]. Влияние диеногеста на репродуктивные исходы оценивалось в многоцентровом РКИ M. Cosson и соавт. [14]. После хирургического лечения ЭМ 59 пациенток в течение 16 недель получали диеногест, а 61 женщина – трипторелин в виде депо по 3,75 мг ежемесячно. До лечения 86 пациенток предъявляли жалобы на бесплодие (45 в группе диеногеста и 41 в группе трипторелина). В группе диеногеста беременность наступила в 33 % случаев и завершилась родами для 13 из 15 женщин. В группе трипторелина забеременели 29 % пациенток и родили 9 из 12. Общая частота родов в группе диеногеста составила 29 %, а в группе трипторелина – 22 %. Разница между группами свидетельствует в пользу диеногеста, но была статистически недостоверной. Таким образом, и в случаях бесплодия диеногест не уступал агонистам ГнРГ, при этом он не увеличивал риск самопроизвольных абортов. Исследований об использовании диеногеста перед ЭКО пока нет, однако схожая эффективность диеногеста и агонистов ГнРГ позволяет рассматривать этот гестаген в качестве возможной альтернативы при подготовке к программам ВРТ. Результаты сравнительных исследований позволят сделать окончательные выводы о целесообразности такого подхода.
Однако оценка эффективности в лечении ЭМ во всех исследованиях проведена лишь по выраженности болевого синдрома (дисменореи, диспареунии и хронической тазовой боли); данных о влиянии на репродуктивные исходы пока нет, что не позволяет рекомендовать его для использования в рутинной практике при подготовке к программам ВРТ [21].
Следует упомянуть и о многочисленной группе пациенток, страдающих ЭМ, но не планирующих беременность в ближайшее время. Чаще это молодые женщины, перенесшие лапароскопию по поводу ЭМК, синдрома хронической тазовой боли или диагностическое вмешательство, при котором диагноз ЭМ стал “случайной” находкой. Такие пациентки часто еще не состоят в браке, и беременность в ближайшие месяцы после операции для них не только невозможна, но и нежеланна. С учетом того что “сдерживающая” терапия для этой группы больных должна проводиться длительно, им можно рекомендовать прием КОК, в т. ч. в пролонгированном режиме.
Какой протокол индукции суперовуляции использовать при эндометриозе?
Согласно данным ESHRE пересмотра 2008 г., контролируемая индукция суперовуляции в программе
ЭКО/ИКСИ (от англ. ICSI — Intra Cytoplasmic Sperm Injection) одинаково эффективна при использовании протоколов с агонистами как ГнРГ, так и ГнРГ в отношении имплантации и частоты наступления клинической беременности. Однако предпочтение все же должно быть отдано протоколам с агонистами ГнРГ из-за большего количества получаемых ооцитов в фазе MII и эмбрионов [38] (уровень доказательности 1b).
Эти рекомендации основаны на результатах рандомизированного исследования, в котором оценивали различия между группами пациенток, имевших легкую/среднюю стадиюЭМ, и пациенток, у которых были обнаружены ЭМК. Были проанализированы три группы пациенток: группа 1 – с ЭМ I–II степенями тяжести; группа 2 – после хирургического вмешательства по поводу ЭМК; группа 3 – женщины с одноили двусторонней ЭМК, не подвергавшейся оперативному лечению. В группе 1 не было выявлено значимых различий при разных протоколах стимуляции. В группах 2 и 3 лечение агонистами ГнРГ привело к получению бóльшего числа ооцитов в метафазе II и бóльшему количеству эмбрионов
хорошего качества. Частота наступления клинической беременности и частота имплантации в данных группах были сопоставимыми, однако исследование не обладало достаточной мощностью для оценки данных параметров [38].
Заключение
Эндометриоз – сложное заболевание, влияние которого на фертильность неоднозначно. В практической деятельности можно встретить пациенток со спонтанной беременностью на фоне тяжелых инфильтративных форм ЭМ, и в то же время лечение бесплодия с минимальной формой
ЭМ может закончиться многократными попытками ЭКО. Тактика ведения таких пациенток также очень вариабельна. В нашей стране приветствуется индивидуальный подход к лечению той или иной нозологии, но в то же время нельзя терять драгоценное время, которое так важно, когда речь
идет о репродуктивной функции женщины.
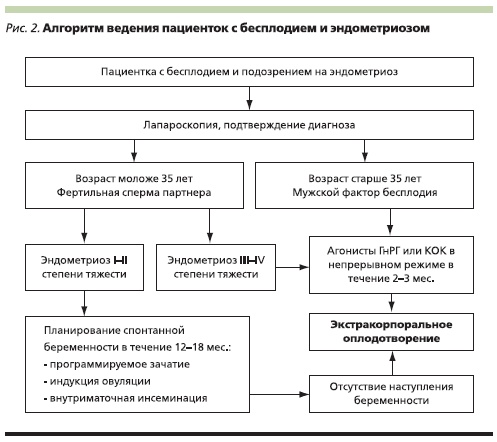
В качестве заключения мы приводим алгоритм ведения пациенток с ЭМ и бесплодием, который может помочь в принятии решения в каждом конкретном случае (рис. 2). Возможно, этот алгоритм изменится с появлением новых крупных исследований, т. к. в настоящее время проведено крайне мало РКИ по ЭМ, на основании которых можно делать достоверные выводы. Самое главное – лечение бесплодия при ЭМ не должно затягиваться, важно вовремя направлять пациенток на оперативное лечение и/или ЭКО
в зависимости от клинической ситуации, пока качество ооцитов позволяет добиваться наступления такой желанной беременности.
1. Богуславская Д.В., Лебович Д.И. Эндометриоз и бесплодие (обзор литературы) // Проблемы
репродукции 2011. № 2. С. 69–73.
2. Гинекология. Национальное руководство / Под ред. В.И. Кулакова, И.Б. Манухина, Г.М. Савельевой. М., 2011. 1120 с.
3. Aboulghar MA, Mansour RT, Serour GI, et al. The outcome of in vitro fertilization in advanced endometriosis with previous surgery: a casecontrolled study. Am J Obstet Gynecol 2003; 188(2):371–75.
4. Allhorn S, B€oing C, Koch AA, et al. TLR3andTLR4expression in healthy and diseased human endometrium. Reprod Biol Endocrinol 2008;6:40.
5. Arici A, Oral E, Bukulmez O, et al. The effect of endometriosis on implantation: results from the Yale
University in vitro fertilization and embryo transfer program. Fertil Steril 1996;65(3):603–07.
6. Arci A. Expression of interleukin-8 receptors in endometriosis. Hum Reprod 2005;29:794–801.
7. Barnhart K, Dunsmoor-Su R, Coutifaris C. Effect of endometriosis on in vitro fertilization. Fertil Steril
2002;77:1148–55.
8. Benschop L, Farquhar C, van der Poel N, Heineman MJ. Interventions for women with endometrioma
prior to assisted reproductive technology. Cochrane Database Syst Rev 2010;11:CD008571.
9. Bergqvist A, D’Hooghe T. Mini symposium on pathogenesis ofendometriosis and treatment of endometriosis-associated subfertility: introduction the endometriosis enigma. Hum Reprod Update
2002;8:79–83.
10. Bulun SE. Endometriosis. N Engl J Med 2009;360:268–79.
11. Chapron C, Vercellini P, Barakat H, et al. Management of ovarian endometriomas. Hum Reprod Update Review 2002;8(6):591–97.
12. Charles O, Omwandho A, Konrad L, et al. Role of TGF-βs in normal human endometrium and endometriosis. Human Reproduction 2010;25:1:101–9.
13. Collins JA, Burrows EA, Wilan AR. The prognosis for live birth among untreated infertile couples. Fertil
Steril 1995;64(1):22–8.
14. Cosson M, Querleu D, Donnez J, et al. Dienogest is as effective as triptorelin in the treatment of endometriosis after laparoscopic surgery: results of a prospective, multicenter, randomized study Fertil
Steril 2002;77(4):684–92.
15. De Wilde RL, Trew RG. Postoperative abdominal adhesions and their prevention in gynaecological
surgery. Expert consensus position. Part 2-stepsto reduce adhesions. Gynecol Surg 2007;4:243–53.
16. De Ziegler D, Gayet V, Aubriot FX, Fauque P. Use of oral contraceptives in women with endometriosis
before assisted reproduction treatment improves outcomes. Fertil Steril 2010;94:7:2796–99.
17. D'Hooghe T, Debrock S, Hill JA, Mauleman C. Endometriosis and subfertility: is the relationship resolved? Semin Reprod Med 2003;21:243–54.
18. Evers JL. The pregnancy rate of the no-treatment group in randomized clinical trials of endometriosis
therapy. Fertil Steril 1989;53:906–07.
19. Garcia-Velasco JA, Somigliana E. Management of endometriomas in women requiring IVF: to touch or
not to touch. Hum Reprod 2009;24(3):496–501. Epub 2008 Dec 4.
20. Gazvani R, Templeton A. Peritoneal environment, cytokines and angiogenesis in the pathophysiology
of endometriosis. Reproduction 2002;123(2):217–26.
21. Gerlinger С, Faustmann T, Hassaland J, Seitz C.Treatment of endometriosis in different ethnic populations:a meta-analysis of two clinical trials BMCWomen's Health 2012;12:9.
22. Giudice LC, Kao LC. Endometriosis. Lancet 2004;364:1789–99.
23. Hansson GK, Edfeldt K. “Toll to be paid at the gateway to the vessel wall”. Arterioscler Thromb Vasc
Biol 2005;25(6):1085–87.
24. Hart RJ, Hickey M, Maouris P, Buckett W. Excisional surgery versus ablative surgery for ovarian
endometriomata. Cochrane Database Syst Rev 2008;16(2):CD004992.
25. Hughes E, Brown J, Collins JJ, et al. Ovulation suppression for endometriosis. Cochrane Database Syst
Rev 2007;(3):CD000155.
26. Hughes EG, Fedorkow DM, Cllins JA. A quantitative overview of controlled trials in endometriosisassociated infertility. Fertil Steril 1993;59:963–70.
27. Illera MJ, Yuan L, Stewart CL, Lessey BD. Effect of peritoneal fluid from women and endometriosis
on implantation in the mouse model. Fertil Steril 2000;74:41–8.
28. Jacobson TZ, Duffy JM, Barlow DH, et al. Laparoscopic surgery for subfertility associated with endometriosis (Cochrane Review). Cochrane Database Syst Rev 2010;20(1):CD001398.
29. Jansen RP. Minimal endometriosis and reduced fecundability: prospective evidence from an artificial
insemination by donor program. Fertil Steril 1986;46(1):141–43.
30. Katsoff B, Check JH, Davies E, Wilson C. Evaluation of the effect of endometriosis on oocyte quality and
endometrial environment by comparison of donor and recipient outcomes following embryo transfer
in a shared oocyte program. Clin Exp Obstet Gynecol 2006;33(4):201–02.
31. Khan KN, Kitajima M, Hiraki K, et al. Toll-like receptors in innate immunity: role of bacterial endotoxin
and Toll-like receptor 4 in endometrium and endometriosis. Gynecol Obstet Invest 2009; 68:40–52.
32. Koninckx PP, Kennedy SH, Barlow DH. Pathogenesis of endometriosis: the role of peritoneal fluid.
Gynecol Obstet Invest 1999;47:23–33.
33. Le T, Giede C, Salem S. Initial evaluation and referral guidelines for management of pelvic/ovarian
masses. J Obstet Gynaecol Can 2009;31:668–73.
34. Leyland N, Casper R, Laberge P, et al. Endometriosis: diagnosis and management endometriosis. J Obstet Gynaec (Canada) 2010;244(2):1–32.
35. Linda C Giudice, Lee C Kao. Endometriosis. Lancet 2004;364:1789–99.
36. Mita S, Shimizu Y, Notsu T, et al. Dienogest inhibits Toll-like receptor 4 expression induced by costimulation of lipopolysaccharide and high-mobility group box 1 in endometrial epithelial cells. Fertil Steril
2011;96(6):1485–89.
37. Olivennes F, Feldberg D, Liu HC, et al. Endometriosis:a stage by stage analysis – the role of in vitro fertilization.Fertil Steril 1995;64(2):392–98.
38. Pabuccu R, Onalan G, Kaya C. GnRH agonist and antagonist protocols for stage I-II endometriosis and endometrioma in in vitro fertilization/intracytoplasmic sperm injection cycles Fertil Steril 2007;88(4):832–9. Epub 2007 Apr 10.
39. Paulson JD, Asmar P, Saffan DS. Mild and moderate endometriosis: comparison of treatment modalities
for infertile couples. J Reprod Med 1991;36:151–55.
40. Practice Committee of the American Society for Reproductive Medicine (ASRM). Endometriosis and
Infertility. Fertil Steril 2006;14:156–60.
41. Royal College of Obstetricians and Gynaecologists. The investigation and management of endometriosis
(green-top guideline; no. 24). London (England):RCOG;2006:3.
42. Sacco K, Portelli M, Pollacco J, et al. The role of prostaglandin E2 in endometriosis. Gynecol Endocrinol
2012;28(2):134–38.
43. Sallam HN, Garcia-(Velasco JA, Dias S, Arici A. Long-term pituitary down-regulation before in vitro fertilization (IVF) for women with endometriosis. Cochrane Data base Syst Rev 2006;25;(1):CD004635.
44. Seli E, Berkkanoglu M, Arici A. Pathogenesis of endometriosis. Obstet Gynecol Clin North Am
2003;30(1):41–61.
45. Tomassetti C, Meuleman C, Pexsters A, et al. Endometriosis, recurrent miscarriage and implantation
failure: is there an immunological link? Reprod Biomed Online 2006;13(1):58–64.
46. Tummon IS, Asher LJ, Martin JS, Tulandi T. Randomized controlled trial of superovulation and insemination for infertility associated with minimal or mild endometriosis. Fertil Steril 1997;68:8–12.
47. Vennes F. Results of IVF in women with endometriosis. J Gynecol Obstet Biol Reprod (Paris) 2003;32:45–7.
48. Vercammen EE, D'Hooghe TM. Endometriosis and recurrent pregnancy loss. Semin Reprod Med 2000;18(4):363–68.
49. Vercellini P, Pietropaolo G, DeGiorgi O, et al. Reproductive performance in infertile women with
rectovaginal endometriosis: is surgery worthwhile? Am J Obstet Gynecol 2006;195:5:1303–10.
50. Winkel CA. Evaluation and management of women with endometriosis. Obstet Gynecol 2003;102:397–408.
51. Wu Y, Kajdacsy-Balla A, Strawn E, et al. Тranscriptional characterizations of differences between eutopic and eutopic endometrium. Endocrinology 2006;147:232–46.
52. Yamanaka K, Xu B, Suganuma I, et al. Dienogest inhibits aromatase and cyclooxygenase-2 expression
and prostaglandin E2 production in human endometriotic stromal cells in spheroid culture. Fertil Steril 2012;97(2):477–82.
Подзолкова Наталия Михайловна – доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии ГБОУ ДПО РМАПО;
Колода Юлия Алексеевна – кандидат медицинских наук, ассистент кафедра акушерства и гинекологии ГБОУ ДПО РМАПО;
Коренная Вера Вячеславовна – кандидат медицинских наук, ассистент кафедры акушерства и гинекологии ГБОУ ДПО РМАПО