Введение
Увеличение продолжительности жизни часто приводит к проблемам, связанным со здоровьем, среди которых зачастую наблюдается белково-энергетическая недостаточность (БЭН). БЭН ассоциируется с задержкой выздоровления от острых заболеваний, ухудшением качества жизни и повышенным риском заболеваемости и смертности [1]. Нарушенный статус питания связан со многими гериатрическими состояниями, такими как повышенный риск хронических заболеваний, снижение антиоксидантной защиты, нарушение функции иммунной системы, повышение риска переломов, старческая астения (СА) [2, 3]. Данные состояния усугубляют друг друга за счет полиморбидности.
Статус питания у пожилых также влияет и на риск развития саркопении. Для поддержания мышечной массы в пожилом возрасте необходимо минимальное ежедневное потребление белка в размере 0;8–1,0 г/кг, более же оптимальным является потребление белка 1,0–1,5 г/кг/сут. [4]. Пациентам с синдромом СА также рекомендовано увеличение потребления белка до 1,0–1,5 г/кг/сут. [5]. При ХБП на додиализных стадиях рекомендуется ограничение потребления животного белка, что у людей пожилого и старческого возраста может давать негативные последствия в виде компенсаторного усиления катаболизма, в т.ч. в мышечной ткани, например, в работе C. D’Alessandro et al. При сравнении двух групп мужчин на додиализных стадиях ХБП (n=80), придерживавшихся малобелковой диеты и соблюдавших необходимый суточный калораж, саркопения значительно чаще развивалась у пациентов в старческом возрасте (55%), чем в группе пожилых пациентов (12,5%) [6].
Для оценки нутритивного статуса пациентов пожилого и старческого возраста признанным средством скрининга и оценки их питания является Краткая шкала оценки питания (MNA – Mini Nutritional Assessment). Точность данный шкалы оценена более чем в 200 исследованиях на 35 тыс. больных различных категорий – амбулаторных и госпитализированных [7, 8]. Изучалась связь показателей шкалы MNA с лабораторными показателями нутритивного статуса: в части исследований показано, что существует корреляция MNA с уровнем альбумина, что абсолютное число лимфоцитов не имеет никакой связи с MNA, но более низкие показатели шкалы MNA были связаны с нарушенной иммунной функцией. Кроме того, шкала MNA может предсказать риск развития нутритивных нарушений (риск недоедания) до возникновения изменений в индексе массы тела и лабораторных показателях нутритивного статуса.
По нашим данным, в популяции пациентов пожилого и старческого возраста на додиализных стадиях наблюдается высокая распространенность нутритивных нарушений по шкале Субъективной глобальной оценки (SGA) – нарушения статуса питания легкой и средней степеней тяжести наблюдались у 43–50% пациентов пожилого и старческого возраста с ХБП стадии 3Б–4 и у 75% с 5-й стадией ХБП. Симптомы тяжелых нутритивных нарушений по шкале SGA встречались у 8% пациентов 60 лет и старше с ХБП стадии 3Б–4 и нарастали у пациентов с ХБП 5-й стадии – частоты выявляемости белково-энергетической недостаточности при ХБП 5-й стадии составила 25% [9]. При этом Краткая Шкала Оценки Питания используется для выявления мальнутриции, которая является более широким понятием, чем БЭН, поскольку включает макро- и микронутриентную недостаточность [10].
Цель исследования – оценить частоту распространенности нутритивных нарушений среди пациентов пожилого и старческого возраста в зависимости от состояния почечной функции.
Материал и методы
Проведено исследование 220 пациентов пожилого и старческого возраста в возрасте 60–90 лет. Критерии исключения пациентов: онкологические заболевания; острые инфекционные заболевания; тяжелые психические заболевания, выраженные когнитивные нарушения (по шкале MMSE или по мнению исследователя). В первую группу вошли пациенты с ХБП стадии 3Б–5 (СКФ по CKD-EPI<=45 мл/мин/1,73 м2) – 150 человек, из них 108 женщин и 48 мужчин. Средний возраст составил 67,2±6,9 года, средний ИМТ – 27, 9±6,22 кг/м2. Во вторую группу вошли пациенты пожилого и старческого возраста без признаков ХБП (СКФ по CKD-EPI>60 мл/мин/ 1,73 м2, отсутствие других критериев ХБП) – 70 человек, их них 42 женщины, 28 мужчин; средний возраст – 68,6±7,6 года, средний индекс массы тела (ИМТ) – 26,6±4,4. Группы были сопоставимыми по возрасту, половой структуре, ИМТ.
Набор пациентов в первую группу проводили в стационаре терапевтического и нефрологического отделений. Причиной хронической болезни почек (ХБП) были сахарный диабет (30%), подагра (4,7%), поликистозная болезнь почек (2,6%), хронический гломерулонефрит (8%). У 66,7% пациентов была артериальная гипертензия, 5,8% имели цереброваскулярные заболевания, 7,6% страдали хронической обструктивной болезнью легких (ХОБЛ), 9,1% имели системные заболевания, у 4,3% в анамнезе была язва, 1,5% имели поражения печени (табл. 1). 60% пациентов с ХБП стадии 3Б–5 страдали анемией смешанного генеза (железодефицитной+нефрогенной).

В группу 2 включили пациентов, госпитализированных в отделения терапии, неврологии, кардиологии. В исследуемой популяции 17,1% пациентов страдали ишемической болезнью сердца, у 17,1% была выявлена застойная сердечная недостаточность, 8,6% находились в стационаре по причине люмбоишиалгии, 5,8% имели цереброваскулярные заболевания, 2,8% страдали бронхиальной астмой, 5,7% имели системные заболевания, у 38,5% была гипертоническая болезнь, 2,8% имели поражения печени, у 22,9% пациентов был диагностирован сахарный диабет. Анемия была диагностирована у 20% пациентов, из них 13% с железодефицитной анемией, 1 пациент с гиперхромной анемией, остальные пациенты с нормохромной анемией. Всем пациентам проводили оценку нутритивного статуса с помощью MNA, антропометрических данных (ИМТ, окружность мышц плеча, окружность мышц голени), лабораторных данных (абсолютное число лимфоцитов, гемоглобин, эритроциты, креатинин, мочевина, глюкоза, общий белок, альбумин крови, общий холестерин, калий крови, оценка протеинурии). Для оценки коморбидности использовался индекс Чарлсона.
Состояние нутритивного статуса было оценено при помощи опросника MNA. Данный опросник состоит из двух частей. В первой части оценивается, снижался ли вес пациента и на сколько именно, отмечает ли пациент снижение аппетита. Также первая часть опросника позволяет получать информацию о подвижности пациента, наличии психоневрологических проблем – нарушений памяти, сильного стресса, ИМТ. Во второй части опросника оценивается частота питания пациента, объем потребления овощей, фруктов и белковой пищи, употребление жидкости. Также в опроснике учитываются условия проживания пациента, количество принимаемых препаратов, возможность самостоятельно приема пищи. Необходимо также учитывать антропометрические данные – указать в опроснике окружность плеча и голени в см. Если пациент набирает от 17 до 23,5 балла, то он находится в риске развития нутритивных нарушений. Если ниже 17 баллов, у пациента мальнутриция [10].
Для оценки коморбидности использовали индекс Чарлсона, разработанный для оценки выживаемости больных в зависимости от возраста и наличия сопутствующих заболеваний. Расчет предполагаемой выживаемости идет по суммированию баллов, соответствующих 18 заболеваниям (сахарный диабет, бронхиальная астма, цирроз и др.), а также добавляется 1 балл за каждую декаду жизни при превышении пациентом 40-летнего возраста.
Дата прохождения Локального этического комитета ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава РФ – 18.12.2018.
Статистическая обработка результатов проводилась с использованием программного обеспечения «Statistica for Windows 12.0» соответственно современным рекомендациям по анализу медицинских данных. Нормальность распределения определялась с помощью критериев Шапиро–Уилка и Колмогорова–Смирнова. Для сравнения групп по количественным признакам применялся параметрический метод с вычислением t-критерия Стьюдента. В случае отличия распределения от ненормального достоверность различий определялась по U-критерию Манна–Уитни.
При корреляционном анализе рассчитывался коэффициент непараметрической (ранговой) корреляции Спирмена. Коэффициент корреляции до 0,5 соответствовал низкой корреляционной связи, 0,5–0,7 – умеренной, 0,7–0,9 – сильной. Значимыми различия считали при p<0,05.
Результаты
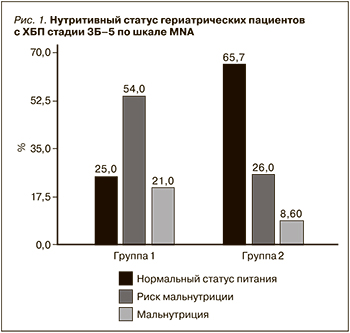
При оценке статуса питания по MNA нормальный статус питания определен у 25% пациентов группы 1, в группе 2 – у 72%. В риске развития мальнутриции находились 54% пациентов группы 1 и 26% группы 2. БЭН наблюдалась у 21% пациентов на додиализных стадиях ХБП и только у 8,6% пациентов с сохранной фильтрацией.
При сравнении двух групп по показателям нутритивного статуса обнаружено, что нутритивные нарушения по шкале MNA преобладают в группе 1 с ХБП стадии 3Б–5 (p<0,05) (рис. 1). Средний балл по шкале MNA в группе 1 составил 16 (12–24) баллов, в группе 2 – 13,5 (10–16).
Пациенты группы 1 достоверно чаще отмечали снижение количества потребляемой пищи за последние 3 месяца (р=0,0001) и потерю массы тела (p=0,004). У пациентов группы 1 число полноценных приемов пищи за день было ниже (p=0,0001) по сравнению с пациентами группы 2, а также отмечалось значительное снижение количества белковой пищи в рационе (p=0,033). При опросе пациенты с ХБП стадии 3Б–5 отмечали, что тяжело соблюдать рекомендуемую малобелковую диету, нет четкого понимания объема и состава пищи. Также пациенты группы 1 отмечали меньшее потребление овощей и фруктов (p=0,015), а также жидкости (p=0,0018). Пациенты с ХБП при самооценке питания и своего здоровья оценивали его хуже, чем пациенты без ХБП (p=0,0001, p=0,033).
Группы не различались по условиям проживания (т.к. все пациенты были стационарными), по наличию пролежней и язв, а также по антропометрическому показателю – окружности голени (p>0,05).
Анализ лабораторных показателей нутритивного статуса показал достоверную разницу между группами по показателям креатинина и мочевины, что логично. Но в группе 1 также выявлено достоверное снижение уровня общего белка и более высокая распространенность анемии: она выявлена у 60% пациентов с ХБП стадии 3Б–5 и у 20% пациентов без ХБП (табл. 2).
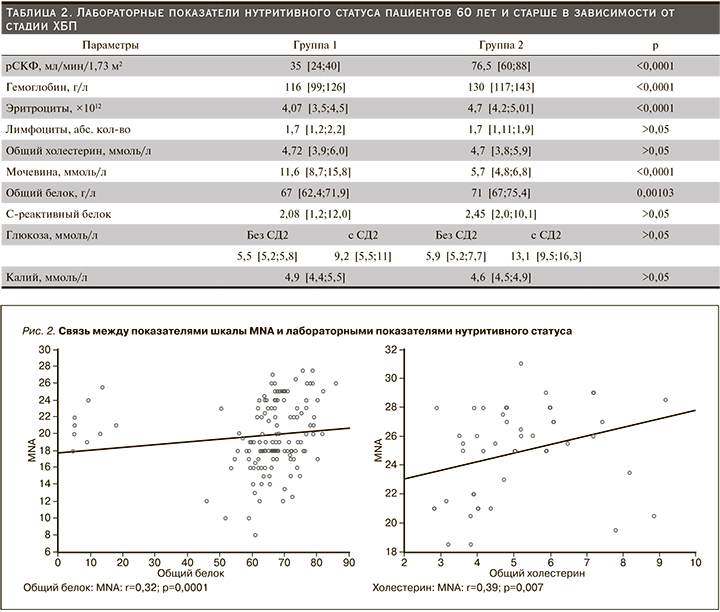
Анализ взаимосвязи нутритивных нарушений с лабораторными данными показал, что cо снижением показателя по Краткой шкале оценки питания наблюдалось прогрессирование анемии (r=0,53, p=0,00001), гипопротеинемии (r=0,31, p=0,0001), снижение уровня общего холестерина (r=0,39, p=0,007) – см. рис. 2.
Изучение индекса коморбидности Чарлсона в группах показало, что средний балл в группе 1 составил 5 (4–6) баллов (средняя предполагаемая 10-летняя выживаемость – 53%), что достоверно выше показателя индекса коморбидности в группе 2: средний балл – 3 (2–5) (p<0,001) – средняя предполагаемая 10-летняя выживаемость – 90%, 47,7% пациентов с ХБП 4–5-й стадий имели крайне высокий индекс коморбидности Чарлсона (7 и более баллов), что предполагает 10-летнюю выживаемость 0,01%. Не выявлено зависимости между нутритивными нарушениями по шкале MNA и индексом коморбидности по шкале Чарлсона (r=-0,19). Наоборот, имеется достоверная зависимость между уровнем рСКФ и выживаемостью пациентов с ХБП стадии 3Б–5 (r=-0,44).
Обсуждение
Систематический обзор 2019 г. [1] показал, что, согласно шкале MNA, у 19–23% пожилых людей наблюдаются признаки мальнутриции – распространенность зависела от условий нахождения пациентов: от 8,5% среди пожилых людей, обследованных амбулаторно, до 28,0% пациентов, находившихся в стационаре. Риск развития нутритивных нарушений по шкале MNA имели 48,4% пациентов. Средний возраст в этой популяции составил 77,2±6,7 года. Из тех, у кого был выявлен риск развития нутритивных нарушений 49,2%, были с симптомами старческой астении. Также показано, что пациенты с коморбидными заболеваниями чаще подвержены риску развития нарушений питания.
В изучаемой нами популяции пациентов пожилого и старческого возраста без признаков ХБП (средний возраст – 68,6±7,6 года) частота нарушений питания составила 8,6%, в риске развития нутритивных нарушений находились 25,7% пациентов. Различия в распространенности нутритивных нарушений могут быть связаны с различиями в тяжести состояния госпитализируемых пациентов: общеизвестно, что в России пациенты госпитализируются, в т.ч. для обследования и подбора терапии.
Распространенность нарушений нутритивного статуса у пациентов 60 лет и старше, по нашим данным, составила 21%, в риске развития нутритивных нарушений находились 54% пациентов. В изученной нами группе пациентов пожилого и старческого возраста с ХБП стадии 3Б–5 нарушения питания выявлялись значительно чаще (p<0,05), чем в группе пациентов без признаков ХБП. При этом лабораторные показатели нутритивного статуса в обеих группах коррелируют с результатами Краткой шкалы оценки питания: с нарастанием нутритивных нарушений наблюдается прогрессирование анемии, гипопротеинемии, снижение уровня общего холестерина. Более высокая распространенность нутритивных нарушений в гериатрической популяции пациентов с ХБП стадии 3Б–5 по сравнению с гериатрической популяцией пациентов без признаков ХБП дает возможность предполагать, что именно ХБП усугубляет имеющиеся метаболические нарушения за счет преобладания БЭН (катаболизма, ацидоза, различных гормональных нарушений, включая инсулинорезистентность) [12], а также за счет преобладания коморбидных заболеваний. БЭН остается одним из основных клинических состояний, значительно ухудшающих прогноз пациентов и наряду с саркопенией приводящих к снижению качества жизни и нередко к инвалидизации и смерти [13].
Заключение
Пациенты пожилого и старческого возраста на додиализных стадиях ХБП имеют более высокий риск развития нутритивных нарушений, чем пациенты без признаков ХБП, и более высокий индекс коморбидности Чарлсона (7 и более баллов), что предполагает более низкую 10-летнюю выживаемость (0,01%).



