До недавнего времени летальность при острых нарушениях мозгового кровообращения (ОНМК) достигала 50 %, а частота инвалидизации выживших составляла 92 %. Внедрение современных стратегий лечения ОНМК позволяет добиваться полной независимости 1 пациента на 10 пролеченных и существенно снижает затраты на лечение и социальное бремя государства по оплате инвалидности. Комплекс мероприятий по лечению и профилактике ОНМК включает первичную профилактику, раннюю госпитализацию (в первые часы ОНМК), современный диагностический комплекс, реперфузионные методы лечения, раннюю активизацию и реабилитацию с помощью мультидисциплинарной бригады (МДБ), раннее начало вторичной профилактики, продолженную реабилитацию с помощью МДБ, мониторинг эффективности вторичной профилактики. Перечисленные мероприятия являются эффективными с точки зрения доказательной медицины и входят в национальные, а также международные рекомендации по ведению больных ОНМК.
К сожалению, рекомендаций по нейропротекции при ОНМК в настоящий момент не сформулировано. Несмотря на многочисленные исследования в настоящее время не установлено ни одного лекарственного средства с доказанной эффективностью в отношении нейропротекции при ишемии мозга (Рекомендации ESO, 2008). В качестве нейропротекторов предложено достаточно большое число препаратов с различными механизмами действия (K.K. Jain, 2011). Эффективность большинства из них была продемонстрирована в эксперименте, но не нашла достаточного подтверждения в клинике (М.М. Brown, 2006; N.G. Walgren и соавт., 2004).
Метаболические, функциональные и морфологические особенности нервной ткани, многофакторность патогенеза, зональность и этапность ишемического повреждения создают чрезвычайно сложные условия для успешного использования препаратов нейропротективного действия.
Сложилась такая ситуация, при которой доклинические исследования нейропротективных субстанций на экспериментальных моделях ишемии продемонстрировали достоверный эффект, а клинические исследования (II и III фазы) показывают неэффективность или небезопасность препаратов. Неудача клинического применения подавляющего большинства нейропротекторов обусловлена рядом
следующих объективных причин.
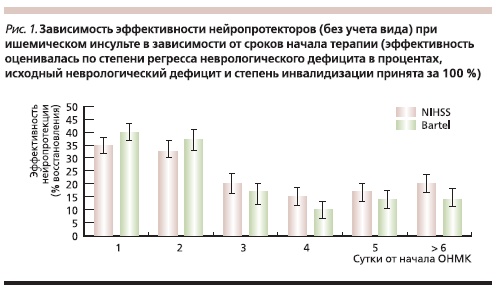
1. Cроки начала терапии в клинике в отличие от эксперимента оказываются в основной массе случаев за пределами т. н. терапевтического окна. Поэтому изменения, происходящие в тканях, по скорости значительно опережают применяемое воздействие. В наших работах без учета механизма действия нейропротективного препарата была показана зависимость (рис. 1) защитного эффекта от сроков начала терапии (Е.В. Мельникова, 2009). Часто при доклинических исследованиях препарат вводят только профилактически до ишемии, поэтому он демонстрирует защитный эффект. Однако такой эффект недостаточен для защиты во время ишемии и реперфузии. Так, в нашем исследовании введение α-липоевой кислоты до фокальной ишемии приводило к уменьшению размера повреждения мозга, а использование во время ишемии не вызывало защитного эффекта (А.А. Шмонин, 2011).
2. Особенностью нарушений мозгового кровообращения является значимый вклад реперфузии как в
процесс сохранения клеток, так и в их повреждение. Отсутствие реперфузии предполагает, что очаг займет максимальный объем, к тому же в условиях отсутствия кровотока затруднена или вообще невозможна доставка препарата к месту событий. Таким образом, отсутствие гиперили гипоперфузии может быть одной из причин неэффективности нейропротекторов при ишемии мозга.
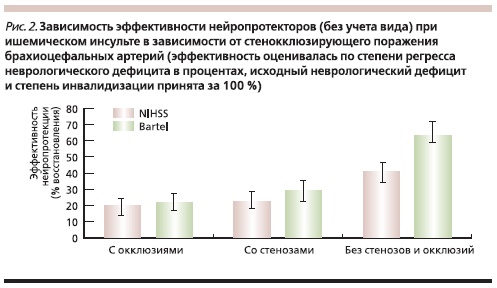
В нашем исследовании было показано, что наличие стенозов или окклюзий брахиоцефальных артерий снижает эффективность нейропротективной терапии у больных инсультом (рис. 2) (Е.В. Мельникова, 2009).
3. Средства, предлагаемые для нейропротекции, по своим свойствам могут быть далеки от идеального препарата: плохо проникают через гематоэнцефалический барьер, не попадают в зону пенумбры, не реализуют свой эффект на уровне сосудистой стенки. Часть нейропротекторов не эффективна у людей в отличие от животных, не работает в данный момент (механизм повреждения, на который действует препарат, еще или уже неактивен) или в данных условиях (ацидоз, ферментная инактивация медиаторов, измененная аффинность рецепторов и т. д.).
4. Зачастую используются недостаточно эффективные дозы, тогда как в достаточных дозировках препарата побочные эффекты нивелируют положительный результат или препарат обладает слишком слабым действием (эффект слишком мал, чтобы стать ощутимым).
5. Предшествующее ишемии повреждение мозга могло создать такие условия, при которых эффект нейропротекции может быть минимальным (сахарный диабет, высокая артериальная гипертензия, сосудистая деменция, старческие изменения метаболизма мозга).
6. Ишемический инсульт – состояние гетерогенное не только по патогенезу, но и по локализации и размерам очагов поражения, что предполагает некоторую разницу в создавшихся при ишемии метаболических и гемодинамических условиях и соответственно потребностях (нейромедиаторные особенности различных областей мозга, особенности кровоснабжения).
7. Особую сложность для оценки эффективности нейропротективных средств в клинике в отличие
от эксперимента представляет собой стандартизация групп исследуемых пациентов, адекватная рандомизация, обеспечивающая равномерное распределение признаков и случайных факторов. Проблему представляет собой также выбор оценки исходов (J. Grotta, 2002; K.R. Lees, 2002; S.M. Davis, G.A. Donnan, 2002).
Нейропротекция – любая стратегия или комбинация стратегий, препятствующая или замедляющая повреждение ткани мозга, способствующая морфологическому, метаболическому и функциональному восстановлению нейронов и их окружения.
Нейропротекция – направление в терапии ишемического поражения головного мозга, при котором защитный эффект развивается за счет блокирования механизмов повреждения нейронов, глии, сосудов головного мозга и/или стимулирования защитных механизмов. Нейропротекцию часто рассматривают с позиций цитопротекции, когда принцип патогенетической терапии применяется для
других органов. Некоторые препараты способны вызывать защитный эффект при поражении нескольких органов. Так, при ишемии мозга и сердца эффективны цитопротекторы эритропоэтин, триметазидин, убихинон, сукцинат и др.
Отдельные механизмы повреждения нейронов и глии при ишемии не являются специфичными только для нее. Ишемия – это типовой патологический процесс, и в различных органах она протекает по универсальным механизмам, финалом которых будет гибель от апоптоза, некроза, нефроптоза или аутофагии. Повреждение реализуется в зависимости от уровня организации живого. На клеточном уровне это энергетическая недостаточность, свободнорадикальное повреждение, повышение уровня внутриклеточного кальция, внутриклеточные отек и ацидоз, потеря калия, повышение проницаемости мембран, разрушение четвертичной структуры белков, патологический апоптоз и др. (U. Dirnagl,
2008). На тканевом уровне – эксайтотоксичность, распространяющаяся корковая депрессия, воспаление, эндотелиальная дисфункция и феномен невосстановления кровотока. На органном уровне – вазоспазм, патологическое тромбообразование, феномен обкрадывания, отек мозга и вклинение. Таким образом, нейропротекция способна защитить от различных видов повреждения, таких как ишемия, гипоксия, травмы, воспаление, нейродегенерация, температурный стресс и токсическое воздействие, в основе которых лежат типовые механизмы гибели.
Универсальность механизмов повреждения клеток и тканей при различных заболеваниях позволяет применить нейропротективные средства не только при ишемии мозга, но и при других заболеваниях: травме головного и спинного мозга, субарахноидальных кровоизлияниях, внутримозговых гематомах, повреждении периферических нервов, спинальном инсульте, нейродегенеративных заболеваниях (болезнь Паркинсона, хорея Гентингтона, боковой амиотрофический склероз, болезнь Альцгеймера),
эпилепсии, рассеянном склерозе и других демиелинизирующих заболеваниях, нейроинфекции, повреждении сетчатки и зрительного нерва (K.K. Jain, 2010). Однако общность патогенетических механизмов не позволяет переносить результаты клинических испытаний нейропротективных препаратов с одних заболеваний на другие. Каждое из вышеупомянутых заболеваний требует отдельных доклинических и клинических испытаний для использования нейропротекции в клинике. Недопустимым, с нашей точки зрения, является использование для создания рекомендаций лишь данных логических умозаключений без проверки гипотез на практике.
Термин "нейропротекция" применяется также для группы препаратов, которые длительно используются в лечении артериальной гипертензии. Так, известно, что блокаторы рецепторов ангиотензина 1-го типа (сартаны) при длительном применении способны остановить прогрессирование когнитивных нарушений у пациентов с артериальной гипертензией. Механизм данного эффекта в полной мере не изучен. Существует гипотеза, согласно которой сартаны реализуют свой защитный эффект за счет более интенсивного воздействия ангиотензина II на ангиотензиновые рецепторы 2-го
типа. То есть положительное влияние сартанов на головной мозг связано не столько с их гипотензивным эффектом, сколько с прямым воздействием на рецепторы в нейронах и эндотелии мозговых сосудов (Н. Lithell, 2003; J. Schrader, 2005).
Создание нейропротекторов – одно из самых старых направлений в борьбе с ишемическим повреждением нервной ткани. Ежегодно публикуется огромное число новых исследований, посвященных данной теме.
В настоящий момент можно выделить две концепции развития нейропротективной терапии при ишемии мозга:
• Монотерапия с основным тезисом “Один препарат для всех видов ишемии мозга независимо от причин, сопутствующей патологии, возраста и т. д.”.
• Комплексная (многофакторная) терапия – подбор нейропротекторных препаратов в зависимости от
патогенетического варианта инсульта, размера и локализации очагов, наличия реперфузии. Комплексный подход не исключает применения комбинации нескольких нейропротективных препаратов с различными механизмами действия, а также их возможного последовательного применения в зависимости от стадии ишемического повреждения.
Монотерапевтический подход возник значительно раньше многофакторной терапии. Наиболее перспективным нейропротектором с позиции доказательной медицины является цитиколин. Он упоминается в Европейских рекомендациях как единственный препарат, продемонстрировавший нейропротективный эффект в остром периоде инсульта, согласно данным мета-анализа.
Многофакторный подход позволяет выработать более гибкую и специфическую терапию ишемического инсульта. Согласно данным литературы, острое ишемическое и реперфузионное повреждение вызывает этапную морфологическую и функциональную перестройку ткани головного мозга как в очаге ишемии, так и на отдалении, включающую адаптационные изменения и события, способствующие распространению и хронизации повреждения. Комплекс, включающий основные этиологические факторы, размеры и локализацию формирующегося очага, темпы развития ишемических и реперфузионных событий, предшествующее повреждение мозга, оказывает существенное влияние на выживаемость ткани головного мозга, патогенез ишемического и реперфузионного повреждения, эффективность нейропротекции. Поэтому нейропротективная терапия ишемического повреждения головного мозга в условиях многофакторного патогенеза требует последовательного применения средств с разными механизмами действия, соответствующими патогенетическому этапу ишемического и реперфузионного процесса и особенностям очага (Е.В. Мельникова, 2008).
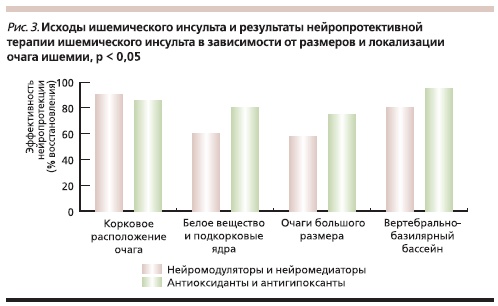
Применение многофакторного подхода позволило выявить группы эффективных нейропротекторов
в зависимости от размеров и локализации очагов ишемии (рис. 3). В исследовании оценивались защитные свойства двух групп нейропротекторов на 28-й день лечения. Первую группу составили средства преимущественно нейромедиаторного и нейромодуляторного действий: холина альфосцерат
(1000 мг/сут), пирацетам (2,4–4,8 г/сут), Кортексин (20 мг/сут). Во вторую группу вошли препараты антиоксидантного действия и антигипоксанты: α-липоевая кислота (600–120 мг/сут), Цитофлавин (10 мл/сут), Мафусол (400 мл/сут), нимодипин (10 мг/сут), магния сульфат (10 мл 25 %-ного раствора в сутки). Все препараты вводились максимально рано в соответствии с инструкцией. Курс лечения составлял в среднем 10 дней. При корковых очагах процент улучшения по сравнению с исходным состоянием по индексу Barthel не различался статистически значимо в группах. При больших очагах (более трети полушария), очагах подкорковой локализации, поражении белого вещества или при очагах в вертебрально-базилярном бассейне более эффективными были антиоксиданты и антигипоксанты (Е.В. Мельникова, 2008).
Инновационным является персонализированный подход, базирующийся на сборе в короткие сроки как можно большего количества информации о патогенетическом варианте ишемического события с применением новых лабораторных исследований (маркеры церебральной ишемии, маркеры атеросклероза), современных методов нейровизуализации (в т. ч. магнитно-резонансной спектроскопии) и детального анализа клинических данных. Информация, собранная таким способом, позволяет достоверно установить характер, временную стадию и степень компенсаторных возможностей очага ишемического поражения, разработать на этой основе индивидуализированную терапию для конкретного клинического случая. В настоящее время внедрение подобного метода ограниченно, т. к. требует отлаженной работы системы помощи больным инсультами и использования дорогостоящего оборудования. Развитие нейропротекции в сторону персонализации представляется одним из наиболее перспективных
направлений.
Ниже представлены возможные варианты нейропротекции при ОНМК:
• профилактическая (до ОНМК);
• ранняя терапевтическая (в остром периоде инсульта: 0–3 дня);
• поздняя терапевтическая (в остром периоде инсульта: 3–21 день);
• нейрепаративная (более 21 дня после ишемии мозга).
Профилактическая нейропротекция может быть показана пациентам с потенциально высоким риском
инсульта. Это больные с повторными транзиторными ишемическими атаками (особенно в варианте “крещендо”), наличием субокклюзии или нестабильной бляшки в сонной артерии, пароксизмальной формой мерцательной аритмии, наличием флотирующего тромба в левом желудочке сердца, диссекции брахиоцефальных артерий. У 10 % пациентов после транзиторной ишемической атаки в течение месяца развивается инсульт (S.C. Johnston, 2000). При субарахноидальном кровоизлиянии развивается вторичный вазоспазм, и в 20–30 % случаев это приводит к развитию отсроченного
неврологического очагового дефицита (N.F. Kassell, 1985). Все выше упомянутые клинические ситуации очень гетерогенны по патогенезу, что может быть препятствием к проведению успешных
клинических испытаний.
Особого внимания заслуживает применение профилактической нейропротекции при операциях на брахиоцефальных сосудах, рентгенхирургических вмешательствах и операциях с применением аппарата искусственного кровообращения. Многие нейрохирургические манипуляции сопровождаются окклюзией церебральных сосудов. Так, при операциях по открытому клипированию церебральных артериальных аневризм, высок риск ятрогенного ишемического инсульта. Причем эта
категория молодых лиц и пациентов среднего возраста без сопутствующей патологии (!). Согласно данным литературы, у 20–30 % больных наблюдаются умеренные когнитивные нарушения спустя 2–6 месяцев после операций с применением аппарата искусственного кровообращения (M.F. Newman, 2001; D. van Dijk, 2000).
По мнению ряда авторов (E.J. Heyer, 1998, 2002), после каротидной эндоатрэтомии в 25 %
случаев наблюдается ранний нейрокогнитивный дефицит, а интраоперационный инсульт может развиваться у 3–6 % больных. Таким образом, пациенты перед операцией, во время оперативного вмешательства и в раннем послеоперационном периоде должны получать нейропротективную терапию с профилактической целью.
При геморрагическом инсульте развивается перифокальный отек и как результат – зона циркуляторных нарушений. Эту зону условно можно сравнить с зоной пенумбры при ишемическом инсульте. Развитие очаговых симптомов при кровоизлиянии может быть связано не только с разрывом волокон белого вещества и непосредственной гибелью нейронов вблизи гематомы, но и со своеобразным сном – “гибернацией”. Поэтому при кровоизлиянии обычно наблюдается более значимый, чем при ишемическом инсульте, регресс симптомов. А нейроны в зоне отека могут быть целью для нейропротекции.
В некоторых клинических ситуациях, у пациентов, ранее перенесших инсульт, при повышении нагрузки на нейроны головного мозга при компенсированном неврологическом дефекте может возникать декомпенсация, что проявляется симптомами инсульта. Этот патофизиологический механизм
был использован А.И. Шваревым для поиска неврологических микросимптомов у пациентов с последствиями травмы и инсульта, больных эпилепсией и аггравантов (А.И. Шварев, 1954). Применение нейропротекторов позволяет быстро снижать степень неврологических расстройств в условиях функциональной декомпенсации очага ишемии.
Все нейропротективные стратегии можно разделить по механизму действия на фармакологические и нефармакологические.
С другой стороны, классификация нейропротективных методик по механизму действия может выглядеть следующим образом:
1. Ингибирующая терапия:
• противовоспалительные средства (нестероидные противовоспалительные средства, глюкокортикостероиды);
• антагонисты рецепторов цитокинов (например, фактор некроза опухоли α);
• антиоксиданты;
• тормозные медиаторы (глицин);
• антиэксайтотоксические препараты;
• антиапоптические средства;
• гипотермия;
• препараты, снижающие метаболизм мозга (нейровегетативная стабилизация – медикаментозный сон);
• антагонисты кальция.
2. Заместительная терапия при абсолютном или относительном дефиците:
• метаболическая коррекция (Цитофлавин);
• предшественники фосфолипидов;
• коррекция трофической недостаточности (дисфункции “эндогенной системы защиты”).
3. Стимулирующие воздействия в условиях ишемии:
• факторы роста и нейротрофические факторы;
• пре- и посткондиционирование (патологический стимул в малой – терапевтической – дозе ).
4. Стратегии с неизвестным механизмом действия.
При оценке механизма действия нейропротективного препарата необходимо учитывать два момента. Во-первых, нейропротективным эффектом потенциально может обладать любой препарат, не относящийся к нейропротекторам. Так, например, некоторые антибиотики и цитостатики способны оказывать защитный эффект при ишемии мозга за счет своего угнетающего влияния на метаболизм нейронов. А некоторые препараты обладают свойствами антиоксидантов и поэтому могут защищать от перекисного окисления липидов при ишемии мозга (лекарство от кашля ацетилцистеин, гепатопротектор – адеметионин). Во-вторых, при проведении доклинических испытаний нередко не учитывается тот факт, что если, например, нейропротектор блокирует свободнорадикальное окисление, то в последующем будет снижаться объем повреждения, а значит, активность повреждения, развивающегося за счет других механизмов, будет ниже (апоптоз). Поэтому может сложиться впечатление, что препарат обладает несколькими механизмами действия. Чтобы избежать этого, необходимо оценивать механизм действия путем использования антагонистов и с применение нескольких дублирующих методов.
В отношении заместительной терапии справедливо правило “метаболической конкуренции органов”.
То есть при использовании метаболических неспецифических средств (Цитофлавин, амиды креатина, АТФ, кофермент Q) возможно, что препарат будет в большей степени захватываться более метаболически активным органом. Так, после еды эти препараты в отношении цитопротекции мозга будут менее эффективны, чем в отношении печени и кишечника. А при сахарном диабете эффективность может снижаться из-за большего потребления препарата вне очага ишемии нейронами и глией, страдающими от хронической гипергликемии, но находящимися в условиях лучшей перфузии.
Большой интерес представляет изучение эндогенных механизмов защиты мозга при ОНМК. Организм никогда не пребывает в покое. И повреждение возникает, когда есть взаимодействие с внешним миром (эмоции, мышление, питание, движение и др.). Все эти процессы в реальной жизни способны создать некий конститутивный уровень повреждения. Это повреждение стимулирует постоянную работу системы эндогенной защиты. Поэтому в крови и других биологических жидкостях всегда присутствует постоянная концентрация факторов роста, выполняющих защитные функции. При наличии более сильного, чем существующий на конститутивном уровне, стимула возникает ответная реакция по перестройке метаболизма всего организма или его части на новый уровень. В литературе эта реакция наиболее ярко продемонстрирована при феномене прекондиционирования.
Защитные эффекты ишемического прекондиционирования проявляются двумя фазами: ранней (длительностью нейропротекции 60–120 минут) и поздней (возникает через 24 часа после ишемического прекондиционирования и сохраняется около 7 суток) (Т.Д. Власов, 2004). Как было показано на примере ишемического прекондиционирования, эндогенная нейропротекция способна осуществлять активную защиту и способствовать наилучшему восстановлению после повреждения. В отличие от традиционных методов нейропротекции эндогенная нейропротекция не направлена на блокирование каких-либо механизмов (например, оксидантного стресса), а обеспечивает активацию ресурсов, заложенных в организме. Применение в перспективе эндогенной нейропротекции должно быть ассоциировано с ослаблением побочных эффектов за счет приближения метода к естественным процессам.
В условиях многофакторного патогенеза острых и хронических нарушений мозгового кровообращения
наиболее перспективными являются средства, активные в отношении универсальных механизмов повреждения. Это препараты, применение которых может быть патогенетически обоснованным в самые ранние сроки и на более поздних этапах ишемического повреждения, обладающие наилучшим
профилем безопасности и применимые у разных категорий пациентов в условиях гетерогенности нарушений мозгового кровообращения.
Одним из препаратов нейротрофического и нейропротекторного действия является Кортексин, представляющий собой комплекс полипептидов коры головного мозга скота. Кортексин оказывает воздействие на различные этапы патологической цепи молекулярных событий, приводящих к гибели нейронов, ограничивает интенсивность процессов апоптоза, уменьшает повреждающее действие
глутаматной эксайтотоксичности, способствует увеличению пула АТФ, за счет усиления ее синтеза уменьшает степень накопления ионов кальция в нейронах, тем самым предупреждая гибель клеток [5].
Большой интерес представляет собой нейротрофическое действие содержащихся в Кортексине нейропептидов, проявляющееся восстановлением поврежденных клеточных отростков, предупреждением гибели нейронов, культивируемых в среде, лишенной ростовых факторов [1]. По мнению авторов, эти процессы обусловлены изменением экспрессии генов, регулирующих синтез мозгового нейротрофического фактора и фактора роста нервов. В условиях экспериментального геморрагического инсульта (самцы крыс) было показано, что введение Кортексина в значительной степени уменьшает интенсивность отека нейронов, ограничивает число погибших клеток [3].
Кортексин хорошо зарекомендовал себя при лечении больных с цереброваскулярными расстройствами.
Получены сведения об эффективности применения Кортексина в комплексном восстановительном лечении больных с ишемическим инсультом [2].
Наибольший эффект наблюдается при раннем начале лечения и широком применении методов немедикаментозной терапии [4]. В первую очередь авторы отметили достоверное улучшение в виде более полного восстановления нарушенных когнитивных функций.
В клинике нервных болезней СПбГМУ им. И.П. Павлова было проведено исследование эффективности
препарата Кортексин для пациентов с впервые развившимся острым полушарным ишемическим инсультом. В исследование были включены 12 пациентов (6 мужчин и 6 женщин), средний возраст которых составил 65,4 ± 2,9 года. У 6 пациентов ОНМК локализовалось в бассейне левой средней мозговой артерии, у 6 – в бассейне правой средней мозговой артерии. Терапия была начата в первые 12 часов (5,7 ± 0,8 часа) с момента появления первых симптомов. У 10 пациентов инсульт развился по атеротромботическому варианту, у 2 – по тромбоэмболическому. Все пациенты имели артериальную гипертензию, церебральный атеросклероз, 5 больных – ишемическую болезнь сердца, 2 – постоянную
форму мерцательной аритмии.
В первые 12 часов от момента появления первых симптомов ОНМК пациентам внутримышечно начинали вводить Кортексин в суточной дозе 20 мг. Курс лечения Кортексином продолжался 10 дней. Кроме того, все пациенты получали антигипертензивную терапию, антиагреганты, инфузионную терапию (без использования иных препаратов нейропротективного действия).
Оценка состояния больных проводилась до начала терапии, на 3-й, 7, 11 и 28-й дни исследования. Было установлено, что десятидневный курс лечения Кортексином в суточной дозе 20 мг, начатый в первые 12 часов с момента развития ОНМК, является эффективным и безопасным методом лечения при впервые развившемся полушарном ишемическом инсульте. Было отмечено уменьшение общемозговых и очаговых симптомов (NIHSS), улучшение общего клинического состояния (CGI-I) и показателей повседневной двигательной активности (индекс Бартела).
Оценивая эффективность нейропротективных средств при сосудистых заболеваниях головного мозга необходимо помнить об основных патологических состояниях, которые привели к сосудистым событиям и возможным необратимым изменениям мозговых тканей. Адекватная профилактика, качественная многолетняя терапия артериальной гипертензии и атеросклероза могут создать значительно
более благоприятный фон для эффективной нейропротекции при развитии сосудистой катастрофы.



