Введение
Урогенитальный реактривный артрит (РеА) – аутоиммунное заболевание, поражающее различные органы и системы, характеризующееся классической триадой, реже – тетрадой признаков: сочетанным поражением мочеполовых органов (в форме негонококкового – хламидийного – уретрита), суставов (по типу асимметричного серонегативного реактивного артрита), глаз, кожи и слизистых оболочек (псориазиформные высыпания, кератодермия, ксеротический, цирцинарный баланит, уранит, ониходистрофия), изменениями в сердечно-сосудистой системе, нервно-психической сфере [1–4].
УРеА, заболеваемость которым оценивается в 4,6–5,0 случаев на 100 тыс. населения [1], наряду с псориатическим артритом (ПсА) входит в группу серонегативных спондилоартритов, связанных с поражением подвздошно-крестцовых сочленений и позвоночника. Код по Международной классификации болезней 10-го пересмотра – М02.
Патогенез
Патогенез связан с иммунным ответом на патогены урогенитального тракта и характеризуется выявлением в суставной жидкости больных Chlаmydia trachomatis [5], а наиболее ярким проявлением служит поражение опорно-двигательного аппарата. Заболевание может приводить к инвалидности и летальному исходу, включая персистирующие формы возбудителя [6]. Хламидии выявляются в соскобе со слизистой оболочки урогенитального тракта или конъюнктивы больных УРеА, в синовиальной жидкости и моноцитах периферической крови [7], но in vivo практически не культивируются.
УРеА возникает при генетической предрасположенности, может приобретать хроническое течение или рецидивировать, даже несмотря на элиминацию инфекционного агента [8]. Он развивается спустя дни или недели после инфекции урогенитального тракта и обусловлен ненормальной пролиферацией CD4+клеток, ведущей к нарушению эрадикации тригерных агентов и хронизации воспаления за счет нарушения баланса цитокинов Тh1 (интерферона-γ, фактора некроза опухоли-α) и Тh2 (интерлейкин-2 – ИЛ-2, -10)-типа [9]. В формировании аутоиммунных реакций при УРеА особая роль отводится перекрестному реагированию HLA-B27 с белком теплового шока (БТШ) C. trachomatis с молекулярной массой 60 кД (БТШ-60) [10].
Наиболее ярким проявлением УРеА, определяющим тяжесть и прогноз заболевания, считается поражение опорно-двигательного аппарата, прежде всего суставов [11–13].
Прогноз в острых случаях УРеА благоприятный. В затяжных и при хронической форме болезни возможны инвалидизация и летальные исходы, которые И.И. Ильин и Ю.Н. Ковалев (1985) наблюдали в 1,2%, R. Fox et al. (1979) – в 1,5%.
Таким образом, УРеА – это важная междисциплинарная проблема, в решении которой принимают участие ревматологи, дерматовенерологи, окулисты, педиатры.
Весьма важной проблемой УРеА остается его выявление. Особенно сложна дифференциальная диагностика УРеА и ПсА.
При клинико-рентгенологическом обследовании 58 больных УРеА и 50 – ПсА отмечено, что основными признаками суставного процесса при УРеА являются:
- острое начало;
- ограниченное число воспаленных суставов, преимущественно нижних конечностей;
- асимметричность поражения суставов и осевого скелета;
- вовлечение сухожильно-связочных структур;
- наличие внесуставных проявлений;
- возможность рецидивов;
- нередкая хронизация воспаления с локализацией в периферических суставах и позвоночнике;
- энтезопатии.
Эти признаки во многом сходны с таковыми при ПсА. Среди ярких проявлений ПсА мы выделили такие присущие УРеА признаки, как:
- асимметричный периферический артрит с преимущественным поражением суставов нижних конечностей;
- поражение позвоночника;
- поражение дистальных межфаланговых суставов;
- наличие дактилита;
- воспалительная боль в позвоночнике;
- асимметричный сакроилеит;
- энтезиты;
- отсутствие ревматоидного фактора;
- наличие костных пролифераций;
- оссификация краев сустава.
Особо следует подчеркнуть, что для дебюта УРеА характерна асимметрия поражения суставов нижних конечностей, которая сохраняется и при генерализации патологического процесса, но при этом меняется сторона поражения (симптом «лестницы»).
Что касается асимметричного сакроилеита, который при ПсА, по данным литературы, выявляется с частотой от 19 до 85% [16, 17], при УРеА – примерно у трети больных [18–20], то при II стадии УРеА он отмечается в 43% случаев и характеризуется различиями в степени тяжести патологического процесса. Так, мы чаще выявляли сочетание 1-й степени тяжести поражения, с одной стороны, и 2-й (или 2–3-й) степени, с другой. Кроме того, почти во всех случаях УРеА больные предъявляли жалобы на боли в крестце (42%) как проявление сакроилеита, тогда как при ПсА рентгенологические находки зачастую являлись первыми в обнаружении патологии илеосакральных сочленений.
Итак, отсутствие надежных клинических, рентгенологических критериев дифференциальной диагностики между ПсА и сопровождающимся псориазиформными или кератодермическими высыпаниями во II стадии УРеА требует разработки новых методов их различия.
Исходя из этого, в дифференциальной диагностике этих заболеваний был использован метод прямой иммунофлуоресценции (ПИФ) видимо здоровой кожи. Были исследованы биоптаты очагов поражения 20 больных УРеА II стадии (все мужчины в возрасте от 22 до 45 лет) и 40 больных распространенным псориазом и ПсА (31 мужчина и 9 женщин в возрасте от 16 до 52 лет); у 20 больных псориаз был в прогрессирующей, у 10 – в стационарной, у 10 – в регрессирующей стадиях.
Гистологически кератодермические и псориазиформные очаги УРеА существенно не отличались от псориатических. Так, в биоптатах очагов поражения при УРеА определяли гиперкератоз, акантоз, обращала на себя внимание лимфоцитарно-лейкоцитарная инфильтрация сосочкового и субсосочкового слоев дермы с лейкостазами в капиллярах, а также были обнаружены признаки, характерные для пустулезного псориаза, в частности спонгиотические и интракорнеальные пустулы. В биоптате больных псориазом и ПсА в каждом случае имелись акантоз, паракератоз, гиперкератоз, микроабсцессы Мунро, отек в сосочковом слое дермы, менее выраженный периваскулярный отек в сетчатом слое.
Методом ПИФ биоптатов кожи очагов поражения при УРеА, а также при псориазе и ПсА существенных различий в исследуемых депозитах обнаружено не было. Так, в каждом из пяти псориазиформных очагов УРеА выявлены диффузные отложения IgG в основном веществе сосочкового и верхней части сетчатого слоя дермы, а также в сосудах сосочкового слоя и в паракератотически измененном роговом слое; в одном случае они ассоциировались с IgM, в двух – с IgA и С3-компонентом комплемента. При исследовании очагов кератодермии 35 больных УРеА выявлены диффузные, линейные и мелкогранулярные отложения IgG в сосочковом и верхней частях сетчатого слоях дермы, а также отложения IgG, IgA и С3-компонента комплемента вдоль базальной мембраны, IgA– в сосудах дермы. При ПИФ псориатических кожных элементов 23 больных ПсА IgG выявлен в виде диффузных отложений в сосочковом слое; в 6 случаях эти депозиты сочетались с наличием отложнений IgA и IgM.
Методом ПИФ в биоптатах видимо здоровой кожи больных УРеА II стадии и ПсА выявлены существенные различия в депозитах IgG. Так, при УРеА отложения IgG диффузного характера обнаружены в сосочковом и сетчатом слоях дермы, причем выраженность реакции варьировалась от 1+ до 3+ (рис. 1, 2). В 8 случаях этот постоянный признак сочетался с наличием IgM (в некоторых участках базальной мембраны эпидермиса с незначительным накоплением в дермоэпидермальной зоне и следов IgA в дерме, С3-компонента комплемента – мелкогранулярно, умеренно – в сосочковом и сетчатом слоях дермы), фибрина в сосудах сетчатого и сосочкового слоев, а также с гранулярным характером накопления IgG в дерме и в сосудах сосочкового слоя.
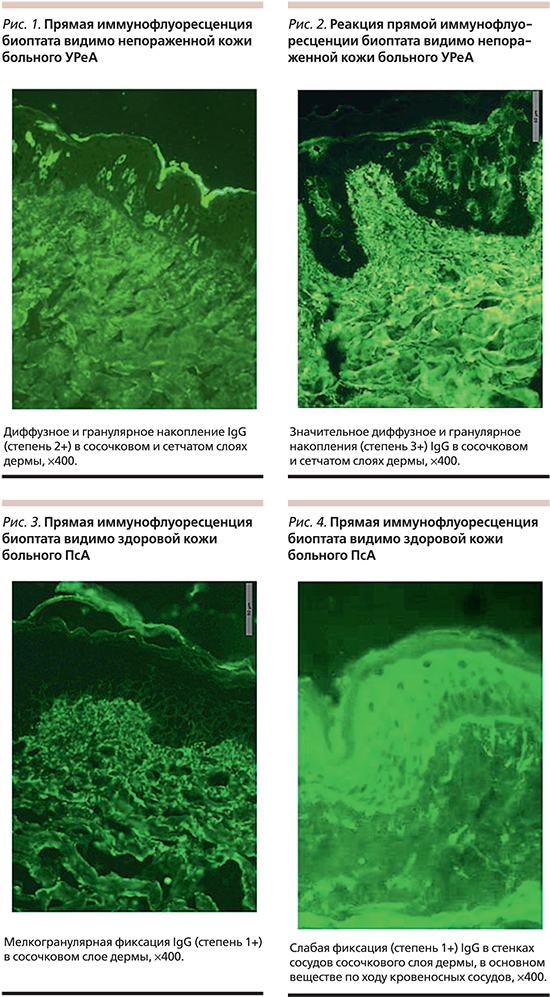
В видимо здоровой коже больных ПсА были обнаружены депозиты IgG только в сосочковом слое (в стенках сосудов сосочкового слоя дермы, в основном веществе диффузно и гранулярно по ходу кровеносных сосудов) (рис. 3, 4); в одном случае они ассоциировались с гранулярными отложениями IgG в шиповатом слое эпидермиса.
Контролем в настоящем исследовании служили 10 биоптатов кожи (5 – видимо здоровых людей и 5 биоптатов, полученных во время оперативного вмешательства по поводу паховой грыжи [2], острого аппендицита [2] и острого холецистита [1]). Реакция ПИФ с эллюатом чистых антител к иммуноглобулинам человека, а также с сыворотками к основным классам иммуноглобулинов (G, A, M) во всех случаях была отрицательной.
Исчезновение депозитов IgG в видимо здоровой коже после успешного лечения УРеА, сопровождавшегося нормализацией уровня циркулирующих иммунных комплексов, могло быть обусловлено тем, что связанные с кожей IgG являлись антителами к определенным белкам кожи.
Клинический случай 1
Пациент Б. 30 лет поступил с жалобами на высыпания на коже стоп, ладоней, туловища, конечностей, половом члене, боли и утреннюю скованность в суставах нижних конечностей, боли в паху, общую слабость, повышение температуры тела до 37,5–38°С, снижение массы тела за последние полгода на 8 кг. Самостоятельно не передвигался из-за выраженных болей в суставах и болезненных высыпаний на подошвах стоп.
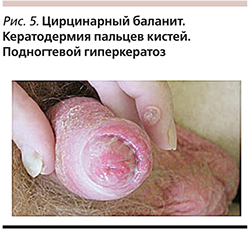 Болен около 5 лет, когда через 3 недели после случайного полового контакта с незнакомой женщиной появились прозрачные выделения из уретры и высыпания розового цвета на головке полового члена. Венерологом в материале из уретры были выявлены С. trachomatis. После приема сумамеда выделения прекратились, но высыпания после аппликаций крема Тридерм не регрессировали.
Болен около 5 лет, когда через 3 недели после случайного полового контакта с незнакомой женщиной появились прозрачные выделения из уретры и высыпания розового цвета на головке полового члена. Венерологом в материале из уретры были выявлены С. trachomatis. После приема сумамеда выделения прекратились, но высыпания после аппликаций крема Тридерм не регрессировали.
За последующие 8 месяцев розовые шелушащиеся высыпания распространились на кожу правой стопы, боли в суставах нижних конечностей усилились и распространились на плечевые суставы, появилась субфебрильная температура. Получал амбулаторно и в терапевтическом стационаре по месту жительства по поводу «псориаза» и «полиартрита» гемодез, антибиотики, нестероидные противовоспалительные средства, циклоферон, лазеротерапию. В связи с неэффективностью лечения госпитализирован в наше отделение.
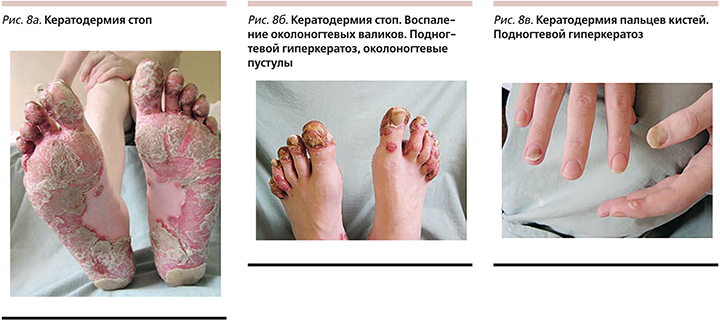
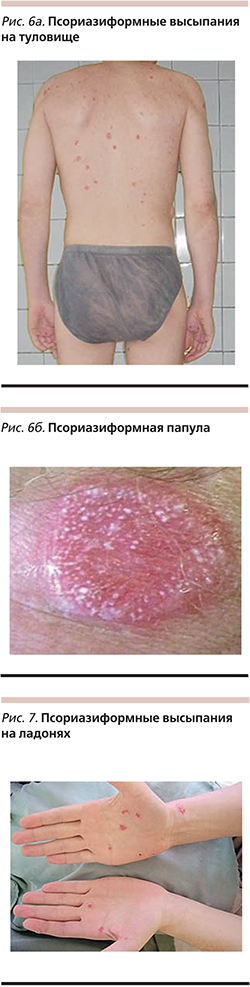 При осмотре в области головки полового члена у наружного отверстия уретры и на внутреннем листке крайней плоти – розовые пятна с четкими границами кольцевидной формы (рис. 5). В области туловища (преимущественно на груди и спине), ладоней – папулы розового цвета с четкими границами величиной от 1-копеечной до 1-рублевой монет с серебристо-белыми чешуйками на поверхности (рис. 6а,б; рис. 7). В области подошв – кератодермические очаги на фоне гиперемии (рис. 8а). В области дистальных и проксимальных отделов пальцев стоп – рупеоидные высыпания с венчиком гиперемии по периферии, с массивными серозногнойными корковыми наслоениями (рис. 8б). На коже пальцев кистей – единичные пустулы (рис. 8в, рис. 5). Ногтевые пластинки стоп и в незначительной степени кистей утолщены с участками подногтевого гиперкератоза (рис. 8б,в , рис. 5).
При осмотре в области головки полового члена у наружного отверстия уретры и на внутреннем листке крайней плоти – розовые пятна с четкими границами кольцевидной формы (рис. 5). В области туловища (преимущественно на груди и спине), ладоней – папулы розового цвета с четкими границами величиной от 1-копеечной до 1-рублевой монет с серебристо-белыми чешуйками на поверхности (рис. 6а,б; рис. 7). В области подошв – кератодермические очаги на фоне гиперемии (рис. 8а). В области дистальных и проксимальных отделов пальцев стоп – рупеоидные высыпания с венчиком гиперемии по периферии, с массивными серозногнойными корковыми наслоениями (рис. 8б). На коже пальцев кистей – единичные пустулы (рис. 8в, рис. 5). Ногтевые пластинки стоп и в незначительной степени кистей утолщены с участками подногтевого гиперкератоза (рис. 8б,в , рис. 5).
Диагноз: цирцинарный баланит, бленнорейная кератодермия стоп и ладоней, псориазиформные высыпания туловища.
В общем клиническом анализе крови: лейкоцитоз – 12,4×109/л; СОЭ – до 24 мм/ч, в остальном – без патологии. Ревматоидный фактор отрицательный. В общем анализе мочи лейкоциты до 20 в поле зрения, в остальном без патологии.
Методом полимеразной цепной реакции (ПЦР) в уретре обнаружены C. trachomatis; методом иммуноферментного анализа (ИФА) в крови выявлен диагностически значимый титр антител IgG БТШ60 C. trachomatis 1:100.
При пальпаторном исследовании предстательная железа асимметричная, бугристая, в соке предстательной железы лейкоциты до 20 в поле зрения, лецитиновые зерна в небольшом количестве. Через 6 часов после массажа предстательной железы отмечен подъем температуры тела до 38°С и усиление болей в суставах. При сухой уретроскопии диагноз: тотальный уретрит, мягкий инфильтрат передней уретры, литтреит, катаральный колликулит.
На электрокардиограмме: синусовая тахикардия с частотой сердечных сокращений (ЧСС) – 115 в минуту, метаболические изменения миокарда.
Консультация офтальмолога: ангиопатия сетчатки.
При рентгенологическом исследовании таза выявлен асимметричный сакроилеит (2-й ст. тяжести справа, 1-й ст. слева).
Консультация ревматолога: реактивный полиартрит. Акт 2-й ст., ФН 1-й ст.; асимметричный сакроилеит (2-й ст. тяжести справа, 1-й ст. слева); подпяточный бурсит справа. Умеренная миодистрофия левого бедра.
Консультация психоневролога (по поводу status prostaticus): астено-ипохондрическое состояние у психастенической личности.
Иммуногистохимический анализ биоптата видимо непораженной кожи: фиксация IgG диффузно в дерме в сетчатом и сосочковом слоях и в стенках сосудов (3+) (рис. 9).
На основании клинической картины и данных обследования установлен клинический диагноз: урогенитальный реактивный артрит 2-й стадии, хронический хламидийный тотальный уретрит, мягкий инфильтрат передней уретры, литтреит, катаральный колликулит, хронический фолликулярный простатит; реактивный полиартрит 2-й ст., ФН 1-й ст.; асимметричный сакроилеит (2-я ст. тяжести и 1-я ст. слева); подпяточный бурсит справа; миодистрофия левого бедра; псориазиформные высыпания туловища, бленорейная кератодермия стоп и ладоней, цирцинарный баланит.
Клинический случай 2
Пациент П. 28 лет, рабочий. Поступил с жалобами на высыпания на коже туловища, конечностей, волосистой части головы, зуд; болезненность и скованность правого коленного сустава, боли в правом тазобедренном суставе. Повышение температуры тела до 38°С. Слабость, утомляемость. Покраснение глаз.
Болен более 10 лет, первые высыпания появились после перенесенного нервного стресса, в анамнезе, со слов пациента, – лечение у венеролога по месту жительства по поводу хламидийной инфекции (выписки нет). Обострения ежегодно, обычно в осеннее время года. Лечился ежегодно амбулаторно и в стационаре по месту жительства по поводу псориаза (тиосульфат натрия в/в капельно, хлорид кальция в/в капельно, супрастин в/м, местно: акридерм) с положительным эффектом в виде уменьшения интенсивности зуда, шелушения. Настоящее ухудшение отметил в начале сентября 2016 г., когда появились ноющая боль, выраженный отек и скованность в движении правого коленного сустава, болезненность левого плечевого сустава, а также новые распространенные высыпания, отметил повышение температуры тела в вечернее время до 37,8°С, общую слабость. Лечился самостоятельно диклофенаком в/м с кратковременным эффектом в виде уменьшения суставных болей. В течение последней недели отметил усиление зуда и гиперемии на фоне контакта с лакокрасочной продукцией. Обратился в КВД по месту жительства и был госпитализирован в отделение дерматоонкологии и дерматовенерологии для обследования и лечения.
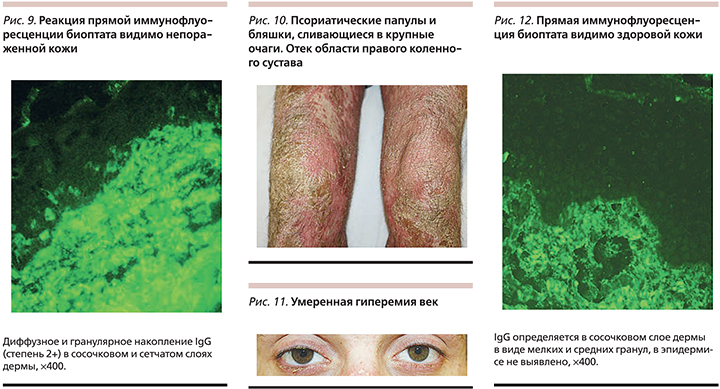
При поступлении: кожный процесс распространенный, подостровоспалительный, симметричный, локализован на коже верхних и нижних конечностей, туловище, волосистой части головы. Представлен папулами и бляшками ярко-красного цвета, сливающимися на нижних конечностях в крупные очаги, со среднепластинчатым шелушением на поверхности; на бляшках на голенях – желтоватые чешуекорки (рис. 10). Псориатическая триада положительная. На коже ладоней и стоп эритемосквамозные участки, линейные мелкие трещины. Ногтевые пластинки на стопах и кистях изменены по типу масляного пятна, утолщены, с участками подногтевого гиперкератоза. Умеренная гиперемия век (рис. 11). Умеренный отек в области правого коленного сустава (рис. 10). Умеренная утренняя скованность в правом коленном суставе (30–40 минут).
Обследование на RW, ВИЧ, гепатит В и С – отрицательно.
Общий анализ крови: гемоглобин – 119,5 г/л, эритроциты – 4,05×1012/л, тромбоциты – 441×109/л, средний объем тромбоцита – 8 fL, лейкоциты – 10,24×109/л Лимфоциты отн. (прибор) – 15,5%, лимфоциты абс. (прибор) – 1,6×109/л, моноциты отн. (прибор) – 12,5%, моноциты абс. (прибор) – 1,3×109/л, нейтрофилы отн. (прибор) – 69,70%, нейтрофилы абс. (прибор) – 7,1×109/л, эозинофилы отн. (прибор) – 1,8%, эозинофилы абс. (прибор) – 0,2×109/л, базофилы отн. (прибор) – 0,5%, базофилы абс. (прибор) – 0,1×109/л, палочкоядерные – %, сегментоядерные – 74,0%, лимфоциты – 13,0%, моноциты – 11,0%, анизоцитоз+СОЭ (ALI FAX) – 58 мм/ч.
Анализ мочи (общий): в пределах нормы.
Биохимический анализ крови: билирубин общий – 14,6 мкмоль/л, холестерин общий – 4,2 ммоль/л, общий белок – 62 г/л, глюкоза – 4,9 ммоль/л, аланинаминотрансфераза – 41 ЕД/л, аспартатаминотрансфераза – 42 ЕД/л, фосфатаза щелочная – 209 ЕД/л, γ-глутамилтрансфераза – 129 ЕД/л.
Ревмопробы: антистрептолизин О в 1 мл (№ 200) – 400 AE, С-реактивный белок положительный – 384 мг/л, ревматоидный фактор отрицательный, прокальцитонин в крови отрицательный. Исследования на флору (посев с очагов на коже голеней): выделен микроорганизм Staphylococcus aureus.
Электрокардиограмма: ритм синусовый, ЧСС– 85 уд/мин. Нормальное расположение электрической оси сердца.
Консультация гастроэнтеролога. Диагноз: хронический гепатит неуточненного генеза (не исключен токсический лекарственный на фоне самостоятельного неконтролируемого приема нестероидных противовоспалительных средств).
Обзорная рентгенография грудной клетки: легкие без свежих очаговых и инфильтративных теней. Легочный рисунок обогащен по смешанному типу в прикорневых отделах. Корни легких структурны, не расширены. Диафрагма обычно расположена, куполы четкие. Видимые синусы свободные. Аорта без особенностей. Сердце в поперечнике не увеличено. Умеренно выраженный правосторонний сколиоз.
Консультация ревматолога: Дебют ПсА (моноартрит правого коленного сустава) с эпизодами миалгии (поражение шейных мышц).
Методом ПЦР в уретре C. trachomatis не обнаружены; методом ИФА в крови не выявлены антитела к БТШ60 C. trachomatis.
Иммуноморфологическое исследование (ПИФ) биоптата кожи (вне очага поражения): IgG определяется преимущественно в сосочковом слое дермы в виде мелких и средних гранул, в эпидермисе не выявлено (рис. 12).
C3-компонент комплемента – незначительно в сосочковом слое дермы, в эпидермисе нет. IgA – следы в сосочковом слое дермы.
IgM – следы в дерме. Фибрин – незначительно в дерме.
Заключение: иммуногистохимических признаков аутоиммунного дерматоза не выявлено, отложения иммунных комплексов гранулярного характера преимущественно в сосочковом слое дермы.
Диагноз заключительный клинический: распространенный вульгарный псориаз, прогрессирующая стадия. Псориатический артрит (моноартрит правого коленного сустава). Сопутствующие: вторичная пиодермия. Токсидермия. Хронический гепатит неясного генеза.
Таким образом, в результате исследований у представленных пациентов выявлено отличие: наличие диффузных отложений IgG в сетчатом слое дермы при проведении реакции ПИФ в препаратах клинически здоровой кожи при УРеА (II стадии) и отсутствие их в препаратах здоровой кожи больного ПсА.
Заключение
Полученные данные свидетельствуют о важной роли иммунных нарушений в патогенезе УРеА и ПсА, в частности о существенных различиях в характере отложений IgG в видимо здоровой коже этих пациентов, и могут быть использованы в диагностике и дифференциальной диагностике УРеА. ПИФ-биоптата видимо здоровой кожи также может быть использована для оценки эффективности лечения этого заболевания.



