Актуальность проблемы язвенного колита (ЯК) и болезни Крона (БК), объединенных сегодня общим термином “воспалительные заболевания кишечника” (ВЗК), обусловлена продолжающимся ростом частоты и распространенности этой патологии, прогрессирующим течением и тяжестью осложнений, приводящих к инвалидности и смерти. Развитие ЯК и БК преимущественно в молодом возрасте делает эту проблему не только медицинской, но и социальной.
Несмотря на то что ЯК как нозологическая форма известен со второй половины XIX в., когда он был выделен из группы инфекционных колитов, этиология его остается неизвестной. Не известна и причина второго ВЗК, впервые описанного в 1932 г. B. Crohn, L.Ginzburg, G. Oppenheimer в их совместной статье как “regional ileitis” и получившего впоследствии имя Крона. В последующие десятилетия в изучении ВЗК наметился прогресс. Результаты многочисленных экспериментальных и клинических исследований позволили представить следующую концепцию патогенеза ВЗК. Под влиянием экзогенных и генетических факторов, кишечной микрофлоры и, возможно, еще нераспознанных микробиологических агентов местная иммунная система патологически и непрерывно стимулируется. Это приводит к активации Т- и В-клеток, макрофагов, а также других иммунных и неиммунных клеток, секретирующих антитела, цитокины, реактивные метаболиты кислорода, которые опосредуют неспецифическую форму разрушения ткани [1, 2].
Анализ клинических наблюдений показывает, что течение ВЗК за последние три десятилетия изменилось. Так, острые (молниеносные) формы ЯК наблюдаются сегодня реже. Однако увеличилось число хронических форм [3]. Наряду с описанным Кроном аппендицитоподобным вариантом клинического течения терминального илеита выделен малосимптомный вариант, при котором заболевание длительное время проявляется одним каким-либо признаком, часто внекишечным. Среди детей с таким симптомом может быть отставание в росте. Возросло число осложненных форм [2, 4].
Результаты нашего долгосрочного проспективного исследования (1980–2011) в группе ЯК (n = 277) и БК (n = 242) свидетельствуют, что осложненные формы ВЗК наблюдаются сегодня более чем у трети (35,4 %) больных этими заболеваниями.
Среди них выделяются формы, характеризующиеся:
1) выраженными внекишечными (системными) проявлениями;
2) собственно кишечными осложнениями;
3) сочетанием внекишечных проявлений и кишечных осложнений.
Системные проявления в свою очередь подразделяются на зависящие и не зависящие от активности воспалительного процесса в кишечнике. Первые (периферические артриты, узловатая эритема, гангренозная пиодермия, эписклерит, увеит, иридоциклит) обратимы и исчезают по мере снижения активности ЯК и БК. Связь вторых (первичного склерозирующего холангита [ПСХ], спондилоартрита, сакроилеита) с активностью процесса в кишечнике не подтверждается ни данными литературы, ни результатами наших долгосрочных исследований.
Поражения суставов чаще наблюдались при БК. Они составили 32,8 % всех внекишечных проявлений при этом заболевании. В группе ЯК на долю поражения суставов пришлось 16,2 %. В процессе обследования больных ВЗК с поражением суставов у 20 пациентов были диагностированы периферические артриты. Результаты динамического наблюдения позволили выявить следующие особенности периферических артритов при ВЗК: асимметричность поражения; вовлечение крупных и мелких суставов как нижних, так и верхних конечностей; ограниченное число вовлеченных суставов; мигрирующий характер болевого синдрома; отсутствие деструктивных изменений и деформации суставов; нормальный уровень мочевой кислоты в крови, отсутствие антинуклеарного и ревматоидного факторов.
Кожные проявления ВЗК (узловатая эритема и гангренозная пиодермия) в нашей серии наблюдений имели место как при ЯК, так и при БК (7,1 и 14,7 % соответственно). Как правило, они наблюдались в периоды наиболее высокой активности ВЗК и являлись свидетельством генерализации процесса.
Увеит, эписклерит и иридоциклит также возникали при высокой активности процесса в кишке и нередко сочетались с поражениями суставов и кожи, описанными выше. Их доля среди всех внекишечных проявлений составила 5,0 % при ЯК и 3,2 % – при БК. Механизм развития внекишечных проявлений при ЯК и БК не ясен. Предпринимаются попытки объяснить развитие внекишечных проявлений васкулитами, развивающимися при миграции из кишечника иммунных комплексов АГ–АТ (антиген–антитело) и имеющими в зависимости от локализации различные проявления. Недавно выдвинута концепция клеточной миграции, позволяющая объяснить многие системные проявления ЯК и БК [5, 6].
Частота гепатобилиарных поражений при ВЗК четко не определена, хотя внимание на поражение гепатобилиарной системы у больных ВЗК было обращено еще в XIX в., когда впервые была описана большая “жирная печень” у больного, умершего от ЯК [2]. Поскольку жировой гепатоз чаще всего обнаруживали при аутопсии или во время операции на кишечнике, первоначально был сделан вывод, что жировая инфильтрация является осложнением самых тяжелых форм ВЗК. Однако дальнейшие наблюдения показали, что это поражение связано не столько с тяжестью заболеваний кишечника, сколько с их хроническим непрерывным течением, сопровождающимся нарушением обменных процессов, питания и токсемией. Наши наблюдения также подтверждают, что жировой гепатоз сочетается в основном с тотальными формами ЯК, для которых характерно хроническое непрерывное течение, и отличается малосимптомностью клинической картины. В клинике жирового гепатоза преобладала умеренно выраженная гепатомегалия (50 % случаев) и незначительная иктеричность склер (10 % случаев). Изменений функциональных печеночных проб отмечено не было, состояние печени оставалось стабильным.
Гранулематозный гепатит встречается в 1 % случаев при БК [2]. Мы располагаем данными лишь двух случаев этого редкого поражения печени. По мнению Ш. Шерлок и Дж. Дули [5], наличие гранулем в печени свидетельствует о генерализации патологического процесса и отражает клеточный иммунный ответ организма. При морфологическом исследовании отмечается четкое отграничение гранулем и отсутствие изменений печеночной архитектуры за их пределами. Гистологически гранулемы подобны тем, что обнаруживаются в кишечной стенке или стенке желудка. Течение заболевания либо асимптомно, либо возможна незначительная дисфункция печени. Регресс гранулем отмечается после хирургического лечения ВЗК, когда иссекается пораженный участок кишечника. Выявление гранулем в печени требует дифференциации с заболеваниями, проявляющимися гранулематозом, такими как саркоидоз, туберкулез, бруцеллез.
В ряде случаев при биопсии печени у больных ВЗК выявлялся перихолангит. Гистологическая картина заболевания хорошо изучена. В последние годы перихолангит рассматривается исследователями как часть спектра клинических проявлений первичного склерозирующего холангита (ПСХ), в отличие от которого при перихолангите происходит поражение только внутрипеченочных протоков. В связи с этим перихолангит получил название “первичный склерозирующий холангит малых протоков”. Полученные нами данные проспективного наблюдения показали, что ПСХ малых протоков прогрессирует либо в ПСХ с поражением внутрипеченочных и внепеченочных протоков, либо сразу в цирроз печени.
В спектре изменений гепатобилиарной системы при ВЗК особое место занимает ПСХ. Установлено, что частота возникновения ПСХ при ВЗК составляет 12–15 %, в то время как у 70–80 % пациентов, наблюдавшихся по поводу ярко выраженной картины ПСХ, диагностируют ЯК или БК.
Улучшение диагностики привело к увеличению частоты выявления этого поражения, и сегодня факт сочетания ПСХ и ВЗК сомнений не вызывает. Считается, что частота встречаемости ПСХ до сих пор недооценивается [7]. Существовавшее ранее мнение о преимущественном сочетании ПСХ и ЯК в настоящее время изменилось. По оценке исследователей около 10 % пациентов с БК имеют такое же поражение печени [8]. Результаты последних эпидемиологических исследований свидетельствуют о том, что распространенность ПСХ составляет 2–7 случаев на 100 тыс. населения, причем мужчины страдают в 2 раза чаще, чем женщины [5, 9].
Этиология ПСХ не известна, а патогенез пока еще недостаточно изучен. Большое внимание уделяется бактериальным и токсическим факторам, несомненна роль иммуногенетических нарушений. Предполагается, что повышение проницаемости кишечного эпителия при ВЗК облегчает проникновение эндотоксинов и токсических бактериальных продуктов через собственную пластинку слизистой оболочки в воротную вену и далее в печень. Токсины могут вызывать перихолангит, нарушение экскреции желчи и поражение желчных протоков. Не исключается их энтерогепатическая циркуляция. Сложности, возникающие на пути решения проблемы ПСХ, по мнению Ш. Шерлок, связаны с тем, что “трудно соединить воедино все имеющиеся генетические, иммунологические и инфекционные факторы и объяснить связь заболевания с ВЗК. По-прежнему вероятным представляется наличие инфекционного агента, поражающего генетически и иммунопредрасположенных людей” [5].
Клиническое течение ПСХ отличатся вариабельностью. Начало часто бессимптомное. При скрининговом обследовании больных в этот период можно обнаружить повышение уровня щелочной фосфатазы (ЩФ) сыворотки крови. Первые проявления неспецифичны: больные отмечают общее недомогание, слабость. Затем периодически появляется кожный зуд – симптом, наиболее значимый и требующий дальнейшего целенаправленного обследования. Появление желтухи, боли в правом верхнем квадранте живота, лихорадки свидетельствует о прогрессировании процесса. В терминальной стадии развивается цирроз печени с явлениями портальной гипертензии и печеночной недостаточности.
При биохимическом исследовании сыворотки крови вслед за повышением активности ЩФ начинают выявляться и другие характерные для синдрома холестаза изменения: повышение уровня гамма-глутамилтранспептидазы (ГГТ) и билирубина. При этом значительное повышение уровня билирубина наблюдается на поздних стадиях ПСХ. Активность сывороточных аминотрансфераз увеличивается в начале заболевания. В дальнейшем их активность хотя и остается повышенной, но значительно ниже активности ЩФ и ГГТ.
Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) рассматривается как основной метод, позволяющий подтвердить или отвергнуть диагноз ПСХ у больных, имеющих признаки холестаза. Типичные для этого заболевания поражения желчных протоков (диффузные или сегментарные четкообразные сужения, симптом “мертвого дерева”) можно выявить даже при нормальной активности ЩФ, их обнаруживают во время целенаправленного обследования пациентов с ВЗК на наличие у них ПСХ (рис. 1).
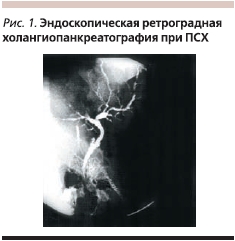
В диагностике ПСХ установлению диагноза может способствовать биопсия печени, в печеночной ткани при гистологическом исследовании биоптатов обнаруживают типичные изменения. На ранней стадии это резко выраженная воспалительная инфильтрация, умеренный фиброз портальной стромы, деструкция отдельных желчных протоков, на поздней – редукция одних, эктазия других желчных протоков и выраженный перидуктальный фиброз. Однако результаты, полученные при изучении маленьких по размеру биоптатов, не всегда могут быть корректными из-за очаговости поражения печени.
В диагностике ПСХ также применяют ультразвуковое исследование (УЗИ). С помощью этого метода можно получить информацию о паренхиматозных изменениях при развитии цирроза печени, обнаружить признаки портальной гипертензии, асцит. Иногда с помощью УЗИ удается выявить характерные признаки ПСХ – утолщение стенок и сегментарное расширение протоков, обнаружить симптом “двустволки” – признак расширения внутрипеченочных желчных протоков.
Компьютерная томография (КТ) применяется с той же целью, что и УЗИ. В ряде случаев удается оценить состояние системы желчных протоков при ПСХ и выявить минимально расширенные участки на протяжении желчных протоков [10]. Кроме КТ в последние годы в практическое здравоохранение внедряются новые скоростные программы получения магнитно-резонансных изображений. Речь идет о магнитно-ядерной холангиопанкреатографии (МРХПГ), позволяющей получить прямое целостное изображение желчевыделительной системы и протоков поджелудочной железы без введения контрастных веществ и интервенции в панкреатобилиарную зону. Следует отметить необходимость комплексного использования вышеуказанных методов для улучшения диагностики ПСХ. В нашей серии наблюдений ЭРХПГ способствовала диагностике ПСХ в 92,9 % случаев, морфологический метод (биопсия печени) – в 36,8 %.
Из числа наблюдавшихся нами больных ВЗК ПСХ развился в 19,8 % случаев и при прогрессировании определял неблагоприятный прогноз. Как представлено на рис. 2, к настоящему времени из числа пациентов с ВЗК, имеющих ПСХ, у 31 % заболевание продолжает прогрессировать; в 14 случаях это привело к летальному исходу, причинами которого были в 3 случаях холангиокарцинома; в 8 – печеночно-клеточная недостаточность; 3 пациента погибли после трансплантации печени. Стабильное течение процесса отмечено в 69 % случаев.
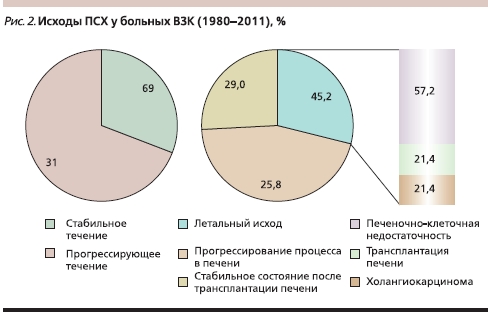
Выявлены некоторые закономерности сочетания ПСХ и ВЗК:
1) тотальное или субтотальное поражение толстой кишки в случаях ЯК;
2) стопроцентное вовлечение в процесс толстой кишки в случаях БК;
3) мягкое течение ВЗК при выраженной активности процесса в печени.
Прогноз ПСХ неблагоприятный. Продолжительность жизни с момента установления диагноза в среднем составляет 11,9 года [5, 11]. M.K. Porayko и соавт. в результате шестилетнего наблюдения за больными ПСХ в 70 % случаев выявили прогрессирование процесса, в трети из них наблюдалось развитие печеночной недостаточности. Холангиокарцинома осложняет течение ПСХ примерно в 10 % случаев и чаще наблюдается при сочетании ПСХ с ВЗК.
Проблема развития рака толстой кишки (РТК) при сочетании ПСХ с ВЗК заслуживает особого внимания. Известно, что риск развития РТК при ЯК в 8 раз выше, чем в общей популяции. Присоединение ПСХ повышает этот риск на 50 % [3, 4, 12, 13].
В последние годы к гепатобилиарной патологии при ВЗК кроме вышеописанных заболеваний стали относить и поражения желчного пузыря. Считается, что желчекаменная болезнь (ЖКБ) у пациентов с БК встречается в 2 раза чаще, чем в общей популяции. Несмотря на то что контролируемых исследований, посвященных этому вопросу, практически нет, накоплены малые серии наблюдений, показывающих, что абсолютное число резекций, длина резецированного участка кишки, послеоперационная гипотония желчного пузыря с развитием сладжа и последующим образованием конкрементов могут рассматриваться как основные факторы риска развития холелитиаза. При этом выяснилось, что ЖКБ развивается как у пациентов, перенесших резекцию значительного участка тонкой кишки по поводу БК, так и у больных с обширным воспалительным процессом в тонкой или тонкой и толстой кишке, находящихся на длительном консервативном лечении.
К настоящему времени патогенез поражения желчного пузыря при БК остается неясным. Наиболее четкой представляется гипотеза [13, 14], предполагающая, что в основе камнеобразования в данной ситуации лежат билиарная недостаточность, приводящая к нарушению энтерогепатической циркуляции желчных кислот; усиление процессов деконъюгации желчных кислот в дистальном отделе тонкой кишки, обусловленное воспалительными изменениями в тонкой кишке или ее резекцией; увеличение поступления желчных кислот в толстую кишку, где они солюбилизируют неконъюгированный билирубин, способствуя его абсорбции.
Среди наблюдаемых нами больных с БК (242) изменения желчевыводящих путей были выявлены у 137 (56,6 %). Среди обнаруженных изменений обращали на себя внимание билиарный сладж, холестероз желчного пузыря и ЖКБ. На долю этой патологии пришлось 57,9 % выявленных изменений. Спектр липидов крови достоверно не отличался от такового в группе сравнения. В то же время было отмечено перенасыщение желчи холестерином у всех больных при нормальном или сниженном уровне холестерина крови. Был подтвержден тот факт, что ЖКБ у больных БК развивается при поражении обширных участков тонкой или тонкой и толстой кишки (n = 44), а также в случаях резекции этих отделов (n = 6).
Таким образом, представленные выше результаты долгосрочного проспективного изучения свидетельствуют о развитии у больных ВЗК более чем в трети (35,4 %) случаев системных проявлений, осложняющих течение процесса в кишечнике и влияющих на прогноз ЯК и БК. Механизм развития системных проявлений неоднозначен. Одни из них зависят от активности ЯК и БК и требуют агрессивного лечения основного заболевания, другие не зависят от течения ВЗК и нуждаются в дополнительной терапии.
Несмотря на неясность этиологии ВЗК, достигнутые успехи в изучении механизмов развития этих заболеваний дали возможность разработать программы патогенетической терапии и совершенствовать методы лечения. Базисная терапия ЯК и БК применяется вне зависимости от наличия системных проявлений и включает аминосалицилаты, кортикостероиды и иммуносупрессанты, назначаемые в зависимости от степени выраженности процесса в кишечнике. Аминосалицилаты используются при легких и среднетяжелых формах заболеваний. Особенности высвобождения активного вещества в желудочно-кишечном тракте определяют выбор препарата в случае различной локализации воспалительного процесса в кишечнике.
При наличии системных проявлений, связанных с активностью процесса в кишечнике, проводится терапия базисными препаратами в максимальных дозах. В случае сочетания ВЗК с периферическими артритами аминосалицилаты (производные месалазина) комбинируют с сульфасалазином, состоящим из 5-AСA (5-аминосалициловая кислота) и сульфапиридина, которому принадлежит ведущая роль в реализации лечебного эффекта при артритах.
В случаях неэффективности препаратов 5-AСA при среднетяжелых и тяжелых формах ВЗК назначают кортикостероиды. Наиболее многообещающим кортикостероидом считаются будесонид, синтетический глюкокортикоид, обладающий высокой афинностью к глюкокортикоидным рецепторам, выраженной противовоспалительной активностью и низкой системной биодоступностью (10–15 %) [6]. Данные проведенных международных контролируемых исследований с участием пациентов нашей группы показали эффективность применения будесонида в суточной дозе не менее 9 мг. Препарат может быть использован в лечении активной формы БК, при рецидивах этого заболевания после хирургических вмешательств, а также при ЯК, требующем применения стероидов.
Для лечения рефрактерных и стероидзависимых форм БК в течение последних двух десятилетий стал использоваться циклоспорин А. Этому препарату свойственно мощное иммуносупрессивное действие в отсутствие цитотоксических эффектов.
При внекишечных проявлениях, не связанных с активностью процесса в кишечнике, в комплексную терапию включают дополнительные препараты. При спондилоартрите наряду с базисной терапией применяют нестероидные противовоспалительные средства. В последние два десятилетия при обнаружении изменений в печени и желчевыводящих путях (ПСХ, билиарного сладжа, холестероза) стали использоваться препараты урсодеоксихолевой кислоты (УДХК). При ПСХ с их помощью удается добиваться уменьшения активности процесса в печени у части больных, особенно в случаях применения препаратов на ранних стадиях развития этого заболевания. Использование УДХК в нашей группе больных ВЗК дало возможность стабилизировать процесс в печени и увеличить число пациентов со стабильным течением заболевания (36,8 % в 1995 г., 52,8 % в 2010-м). Механизм действия УДХК обусловлен ее свойствами замещать токсичные желчные кислоты, стабилизировать клеточные мембраны, оказывать иммуномодулирующее действие, нормализовывать коллоидную стабильность желчи и моторно-эвакуаторную функцию желчного пузыря, улучшая его тонус [15]. Назначают препараты УДХК в суточной дозе 15–20 мг/кг при ПСХ и 12 мг/кг при билиарном сладже и холестерозе желчного пузыря. Лечение начинается с небольшой дозы препарата (250 мг/сут) с последующим постепенным ее увеличением в случае удовлетворительной переносимости. В процессе лечения показано обследование пациентов в динамике, включающее УЗИ каждые 2 месяца и контроль биохимических показателей крови каждые 3 месяца. При этом следует отметить, что такие пациенты должны получать препараты пожизненно. Особого внимания требует подбор дозы препарата, т. к. у данного контингента больных возможно развитие диареи. При прогрессировании ПСХ единственным методом лечения является трансплантация печени.
Жировой гепатоз при ВЗК и гранулематозный гепатит при БК диктуют необходимость коррекции обменных нарушений и агрессивного лечения основного заболевания.
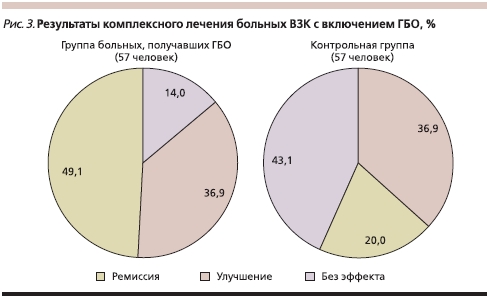
Программа мероприятий в период ремиссии ВЗК в нашей серии наблюдений включала поддерживающие дозы базисных препаратов и профилактические курсы гипербарической оксигенации (ГБО) – 1 курс из 12 сеансов в год в течение 6 лет. Метод ГБО используется нами для профилактики рецидивов ВЗК с 1980 г. [16]. Отдаленные результаты свидетельствуют об эффективности его применения, что проявляется в уменьшении гипоксии тканей, постепенном уменьшении активности воспалительного процесса в кишечнике и восстановлении кишечной микрофлоры. Как показано на рис. 3, в группе больных ВЗК, получавших ГБО, пятилетняя ремиссия составила 49,1 %, в то время как в контрольной группе – 20,0 %, что доказывает целесообразность включения повторяющихся курсов ГБО в комплексное лечение ВЗК на этапе как достижения ремиссии, так и ее поддержания.
Новое направление в лечении ВЗК связано с блокаторами фактора некроза опухоли (ФНО). Накоплен 10-летний опыт применения одного из представителей этого направления (инфликсимаба) в России. Несмотря на значительный прорыв, связанный с применением биологических методов лечения и перспективностью их использования, нельзя не отметить повышенный риск развития тяжелых инфекций при их применении (пневмоний, сепсиса), вероятность реактивации латентной инфекции, в первую очередь туберкулеза. На этом фоне не исключается усиление некоторых системных проявлений ВЗК. Об этом свидетельствуют накопленный нами опыт, результаты ряда других зарубежных и отечественных исследователей [8, 17, 18].
В связи с этим при отборе больных на лечение инфликсимабом необходимо:
• провести более тщательный сбор эпиданамнеза;
• повысить информированность врача и пациента о возможных побочных эффектах лечения блокаторами ФНО;
• разработать совместно с фтизиатрами расширенный алгоритм скрининга на туберкулез;
• осуществить постоянное наблюдение за пациентами с целью выявления ранних признаков инфекции.
Таким образом, проблема ВЗК продолжает оставаться актуальной и требует продолжения исследований по изучению патогенеза системных проявлений ВЗК. Доказана эффективность блокаторов ФНО в индукции ремиссии ВЗК. Их роль на втором этапе лечения (сохранении ремиссии) пока еще четко не определена. Представляется необходимым расширение сети центров антицитокиновой терапии (ЦАТ). Лечение в этих центрах даст возможность минимизировать побочные эффекты блокаторов ФНО, будет способствовать дальнейшему сбору информации об эффективности и безопасности этих препаратов, поможет избежать диагностических ошибок и тяжелых осложнений.



