Введение
Пациенты с воспалительными заболеваниями кишечника (ВЗК) имеют повышенный риск развития гематологических и сосудистых осложнений. Тромбоэмболические осложнения (ТЭО; венозные и артериальные) являются серьезным внекишечным проявлением, утяжеляющим течение ВЗК и повышающим смертность данной категории пациентов. Согласно многочисленным литературным данным, пациенты с болезнью Крона (БК) и язвенным колитом (ЯК) более склонны к ТЭО по сравнению с общей популяцией [1]. Патогенетическая связь между ВЗК и тромбоэмболией пока недостаточно изучена, но можно предположить, что ведущую роль играет изменение плазменного звена гемостаза: повышение уровня прокоагулянтов (в т.ч. тромбина) и понижение уровня эндогенных антикоагулянтов (активированных протеинов S и С) [2], однако нельзя исключить влияние тромбоцитарного (гипертромбоцитоз) и сосудистого звеньев гемостаза на риск развития ТЭО. Необходимо также учитывать воздействие генетических дефектов, клинически не реализуемых в обычных обстоятельствах, но приводящих к избыточной гиперкоагуляции при обострении хронического воспалительного процесса. Осведомленность клиницистов о рисках возникновения ТЭО, а также умение оперативно диагностировать и лечить ТЭО имеют жизненно важное значение для пациента. В этом обзоре мы представим данные об эпидемиологии, клинических проявлениях ТЭО, патофизиологии гиперкоагуляции при ВЗК в зависимости от активности воспалительного процесса и протяженности поражения кишки, а также принципах лечения и методах первичной и вторичной профилактики ТЭО у пациентов с ВЗК.
ВЗК и ТЭО
В 1936 г. J. Bargen и N. Barker [3] впервые сообщили о случаях артериальных и венозных тромбозов у больных ЯК. R. Talbot et al. в ходе широкомасштабного исследования клиники Mейо [4] обнаружили, что 1,3% пациентов с ВЗК имеют клинические проявления ТЭО, в то время как ранние исследования сообщили о еще более высокой частоте данных осложнений – до 7% [5–8]. Кроме того, важное и интересное наблюдение получено по результатам аутопсий: обнаружена значительно более высокая частота венозных ТЭО (до 39%) у пациентов с ЯК. Вероятно, данные тромбозы не имели клинических проявлений и оставались недиагностированными. Наиболее часто встречался тромбоз глубоких вен (ТГВ) нижних конечностей и малого круга кровообращения [4], который оказался причиной смерти 10% пациентов с ВЗК [9]. Также описаны цереброваскулярные осложнения, окклюзия внутренней сонной артерии [12], тромбоз брыжеечной и воротной вен [13], синдром Бадда–Киари [14], окклюзия вен сетчатки [16–18] и ишемическая болезнь сердца (ИБС) [19] у больных ВЗК.
Венозная тромбоэмболия
За последнее десятилетие по всему миру в центрах ВЗК проведены крупные когортные исследования, сосредоточенные на изучении и определении ассоциации ВЗК с риском развития венозной тромбоэмболии (ВТЭ), внесшие свой вклад в выяснение эпидемиологических и понимание клинических особенностей ВТЭ при ВЗК [1, 2, 20]. Некоторые оценивали частоту и риск ВТЭ для пациентов с ВЗК по сравнению с населением в целом [21–25], другие определяли риск ВТЭ для госпитализированных пациентов с ВЗК по сравнению с пациентами, госпитализированными с другими диагнозами [26–30]. Было проведено несколько исследований среди беременных женщин с ВЗК [31, 32] и проанализированы риски развития у них ВТЭ. Проанализированы риски ВТЭ у послеоперационных больных ВЗК [33], оценивали риск рецидива ТГВ у взрослых пациентов с ВЗК [34] и наконец были представлены данные по венозным тромботическим осложнениям у госпитализированных детей и подростков с ВЗК [35]. В мета-анализах с многолетними и многочисленными наблюдениями (33 исследования, включившие 207 814 пациентов с ВЗК, 5 774 898 пациентов контрольных групп без ВЗК) оценен общий риск ВТЭ, ТГВ и легочной эмболии (ЛЭ) у пациентов с ВЗК [1, 36]. Несмотря на неоднородность исследований, показано, что риск ВТЭ у пациентов с ВЗК приблизительно в 2 раза выше по сравнению с контрольной группой.
Н. Yuhara et al. [36] сообщили, что относительный риск (ОР) для ТГВ и ЛЭ у больных ВЗК по сравнению с пациентами без ВЗК составил 2,20 (95% доверительный интервал [ДИ]: 1,83–2,65). Аналогичные данные представили М. Fumery et al. [1], которые сообщили, что суммарный риск развития ВТЭ у пациентов с ВЗК больше на 96% по сравнению с общей популяцией (ОР=1,96; 95% ДИ: 1,67–2,30).
В многоцентровом исследовании, проведенном в Австрии, P. Papay et al. [37] оценили распространенность ВТЭ среди 2811 пациентов с ВЗК и описали характерные клинические признаки. Распространенность всех ВТЭ составила 5,6% (157/2811), частота всех ВТЭ – 6,3/1000 человек. Большинство ВТЭ представлены ТГВ и/или ЛЭ (около 90%; 142/157), в то время как другие локализации венозного тромбоза, включая портальную, верхнюю брыжеечную, селезеночную, внутреннюю яремную и мозговые вены (около 10%; 15/157), встречались реже. Не выявлено различий между БК и ЯК для частоты всех ВТЭ, хотя распространенность и заболеваемость ТГВ и/или ЛЭ немного выше у пациентов с БК.
Установлено, что ВТЭ встречаются в более молодом возрасте у пациентов с ВЗК чаще, чем у пациентов без ВЗК [21, 26, 38, 39]. C. Bernstein et al. проанализировали данные пациентов, госпитализированных с ВЗК и без ВЗК, установив, что общий риск ВТЭ, ТГВ и/или ЛЭ выше у госпитализированных пациентов с ВЗК. Самое значительное различие в риске развития ВТЭ наблюдалось у пациентов с ВЗК моложе 40 лет (коэффициент заболеваемости – 4,5 при ЯК и 9,6 при БК) по сравнению с пациентами той же возрастной группы, не страдавшими ВЗК.
Наряду с кровотечением, токсической дилатацией кишки и пр. ТЭО являются одной из ведущих причин смерти у пациентов с ВЗК [39–42].
В исследовании R. Talbot et al. [4] причиной смерти 25% пациентов с ВЗК явились ТЭО. G. Nguyen и J. Sam [27] также сообщили о более высокой частоте случаев ВТЭ у пациентов, госпитализированных с ВЗК, по сравнению с пациентами, госпитализированными не с ВЗК. У пациентов с ВЗК, госпитализированных с клиническим тромбозом, наблюдался более высокий риск внутрибольничной смертности по сравнению с госпитализированными пациентами с ВЗК без тромбоза (OР=2,5, 95% ДИ: 1,8–3,43) и пациентами с тромбозом, не страдавшими ВЗК (ОР=2,1; 95% ДИ: 1,6–2,9). Кроме того, возникновение ВТЭ у госпитализированных пациентов с ВЗК значительно увеличивало продолжительность пребывания в стационаре и финансовые затраты на лечение больных ЯК и БК.
Пациенты F. с ВЗК имеют более высокий риск послеоперационных ВТЭ [43]. Исследователи A. Merill и Millham [33] сообщили, что пациенты с ВЗК подвержены повышенному риску развития послеоперационного ТГВ или ЛЭ по сравнению с пациентами, не страдавшими ВЗК, особенно после хирургических вмешательств.
J. Wallaert et al. [34] изучали развитие ТЭО в течение первых 30 послеоперационных дней в большой когорте пациентов с ВЗК в отделении хирургической колопроктологии (10 431 человек: 5001 – с ЯК и 5430 – с БК) и выявили ТЭО у 2,3% (242 – ВТЭ, 178 – ТГВ и 46 – ЛЭ). Частота ТЭО оказалась выше у пациентов с ЯК по сравнению с пациентами с БК (3,3 против 1,4%). Установлено, что ТЭО развивались в среднем через 10 дней после операции и сопряжены с повышенной летальностью данной категории пациентов.
Следует подчеркнуть, что повторные тромбоэмболии происходят у 10–13% пациентов с ВЗК. G. Novacek et al. [35] сообщили, что у 30% пациентов с ВЗК произошел повторный рецидив ВТЭ через 5 лет после прекращения терапии антикоагулянтами от момента первого эпизода ВТЭ. Риск повторной ВТЭ выше у пациентов с ВЗК по сравнению с больными, не страдавшими ВЗК. Важно отметить, что ВЗК независимо от степени активности заболевания являются самостоятельным фактором риска для рецидива ВТЭ (ОР=2,5; 95% ДИ: 1,4–4,2). I. Papay et al. [37] сообщили, что при рецидиве в большинстве (70%) случаев ВТЭ были одного и того же типа (ТГВ или ЛЭ) и имели ту же локализацию, как и в случае первого эпизода.
Тромбоэмболические события значительно чаще встречаются при обострении ВЗК и коррелируют с протяженностью поражения кишки; большинство из них происходит без очевидных провоцирующих факторов [4, 22, 40, 44]. Осложнения ВЗК (свищи, стриктура, абсцесс) [22, 27], использование глюкокортикостероидов [24] и недавняя госпитализация при ВЗК [24] связаны с повышенным риском ВТЭ. C. Solem et al. [40] сообщили, что 80% пациентов с ВЗК (39 с БК, 59 с ЯК) имели обострение заболевания в период выявления ВТЭ. По распространенности заболевания у пациентов с ВТЭ 76% пациентов с ЯК имели тотальный колит, у 79% пациентов с БК в поражение вовлечена толстая кишка. Противоположные результаты представил R. Talbot et al. [4]. Они установили, что у больных ВЗК почти в 30% случаев ВТЭ имелась ремиссия заболевания и в 77% случаев периферические ВТЭ происходили спонтанно, без провоцирующих факторов.
В ретроспективном когортном исследовании 2010 г. в Англии [25] проанализировали данные 13 756 пациентов с ВЗК с ноября 1987 по июль 2001 г., оценив риск развития ВТЭ на различных стадиях активности ВЗК (обострение, непрерывное течение, ремиссия), и сопоставили с 71 672 пациентами контрольной группы. Они установили, что существует более высокий общий риск ВТЭ у пациентов с ВЗК по сравнению с контролем при всех степенях активности ВЗК (ОР=3,4; 95% ДИ: 2,7–4,3). Наиболее высокий риск значимо повышен в период обострения заболевания (ОР=8,4; 95% ДИ: 5,5–12,8) по сравнению с непрерывным течением заболевания (ОР=6,5; 95% ДИ: 4,6–9,0) и периодами клинической ремиссии (ОР=2,1; 95% ДИ: 1,6–2). В этом исследовании общий относительный риск ВТЭ у амбулаторных пациентов с ВЗК по сравнению с контрольной группой оказался выше, чем у госпитализированных пациентов с ВЗК по сравнению с контролем (ОР=4,3; 95% ДИ: 3,3–5,7 против ОР=2,1 и 95% ДИ: 1,4–3,2). Эта статистически значимая разница в риске ВТЭ между амбулаторными и госпитализированными пациентами с ВЗК по сравнению с контролем статистически значимо выше в периоды обострения заболевания (ОР=15,8 против 3,2). Однако при статистической обработке выявления частоты ВТЭ на 1000 пациентов, страдавших БК и ЯК, очевидно, что госпитализированные пациенты с ВЗК более склонны к тромбозу (25,2), чем негоспитализированные пациенты с ВЗК (1,8), с наибольшей частотой в период обострения заболевания (37,5 против 6,4). Риск ВТЭ также статистически значимо выше при обострении заболевания и при непрерывном характере течения заболевания по сравнению с периодом ремиссии как у амбулаторных, так и у госпитализированных пациентов с ВЗК. Эти данные также подтверждены исследованием P. Papay в 2012 г. [37], который сообщил, что у пациентов с ВЗК в 77% случаев ВТЭ происходили спонтанно, в 77% случаев у амбулаторных пациентов и в 66% случаев при обострениях заболевания.
Суммируя все исследования, рассмотренные нами выше, можно утверждать, что пациенты с БК и ЯК имеют примерно двукратно повышенный риск ВТЭ по сравнению с общей популяцией или с пациентами, не страдающими ВЗК. ВТЭ, в основном ТГВ и/или ЛЭ (ТЭЛА), имеют тенденцию возникать спонтанно в более молодом возрасте и чаще в периоды обострения болезни как у амбулаторных, так и у госпитализированных пациентов. Однако также существует повышенный риск ТЭО во время периодов ремиссии, во время беременности и после хирургических вмешательств. ТЭО у больных ВЗК часто рецидивируют после первого эпизода (табл. 1).

Артериальная тромбоэмболия
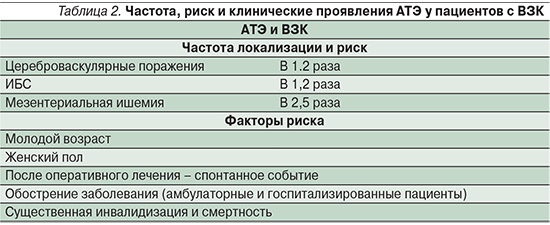
Артериальные тромбоэмболии (АТЭ) у пациентов с ВЗК встречаются реже, чем ВТЭ, и могут проявляться тромбозом и/или окклюзией мозговых артерий [11, 16], артерий сетчатки [16, 17], каротидного синуса [12, 45, 46], коронарных артерий [19], артерий внутренних органов [47], подвздошных артерий [48, 49], почечных артерий [48, 49], артерий конечностей (верхних и нижних) [50, 51] или аорты [48, 49, 52]. АТЭ чаще встречаются после хирургических вмешательств, но могут возникать и спонтанно [4, 51].
Исследования, проведенные с 2009 по 2014 г. [53–59], и мета-анализ 2014 г. [60] свидетельствуют, что имеется связь между ВЗК и ATЭ, аналогичная существующей между ВЗК с ВТЭ. Однако ряд исследований демонстрирует противоречивые результаты [30, 61, 62], отличные от результатов мета-анализа. В своем мета-анализе S. Singh et al. [60] проанализировали данные 9 исследований и установили, что ВЗК ассоциируются с умеренным увеличением риска сердечно-сосудистой патологии. В частности, в 5 исследованиях сообщалось о 2424 случаях острого нарушения мозгового кровообращения (ОНМК) среди 98 240 пациентов с ВЗК, а в 6 исследованиях зарегистрировано 6478 случаев ИБС среди 123 907 пациентов с ВЗК, что выражается в умеренном увеличении на 18% как для ОНМК (OР=1,18; 95% ДИ: 1,09–1,27), так и для ИБС (OР=1,18, 95% ДИ: 1,08–1,31). Кроме того, риск выше у женщин и у пациентов молодого и среднего возраста (<40–50 лет). Не отмечено различий между пациентами с ЯК и БК. В 2 исследованиях сообщалось о 148 пациентах с болезнью/синдромом Рейно среди 25 559 пациентов с ВЗК, но анализ показал, что ВЗК и болезнь/синдром Рейно не связаны между собой (OР=1,15; 95% ДИ: 0,96–1,38).
Общенациональное исследование в США 2011 г. [30], в котором изучалась связь сердечно-сосудистых заболеваний у 148 229 госпитализированных пациентов с ВЗК по сравнению с контрольной группой из 17 261 952 человек, продемонстрировало повышенный риск ишемии брыжеечной артерии (OР=3,4; 95% ДИ: 2,9–4,0) у госпитализированных пациентов с ВЗК.
В 2014 г. М. Fumery et al. [1] по результатам мета-анализа пришли к выводу, согласно которому ВЗК связаны с повышенным риском развития ВТЭ и ишемии брыжеечной артерии и в меньшей степени – артериальной тромбоэмболии и ИБС. Несмотря на то что Fumery et al. не обнаружили увеличения смертности от сердечно-сосудистой патологии среди пациентов с ВЗК, S.L. Kristensen et al. в 2013 г. [54] выявили в общенациональной датской когорте больных ВЗК корреляционную зависимость между активностью заболевания и риском инфаркта миокарда и инсульта.
Резюмируя вышесказанное, последние данные демонстрируют, что пациенты с ВЗК, как с БК, так и с ЯК, имеют повышенный риск развития АТЭ, главным образом ОНМК, ИБС и ишемии брыжеечной артерии, хотя и в меньшей степени, чем ВТЭ. АТЭ, как правило, происходят спонтанно или после хирургического вмешательства в молодом или среднем возрасте, в основном у женщин – чаще в периоды обострения заболевания, приводя к значительному утяжелению течения основного заболевания и повышенной смертности (табл. 1, 2).
Ведение пациентов с ВЗК при тромбоэмболии
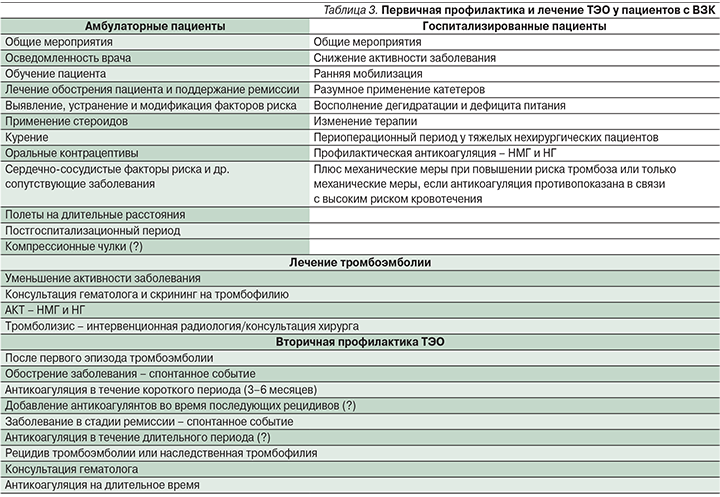
Ведение пациентов с ВЗК должно включать первичную профилактику ТЭО, лечение ТЭО и вторичную профилактику рецидива ТЭО (табл. 3). В настоящее время нет четких специфических рекомендаций для ведения пациентов с тромбоэмболией при ВЗК в различных клинических ситуациях, за исключением первичной профилактики ВТЭ у госпитализированных пациентов с ВЗК, имеющих высокую активность заболевания, что нашло свое отражение в рекомендациях ЕССО по внекишечным проявлениям, опубликованных в 2016 г. [63–68].
Первичная профилактика осложнений ВТЭ
Госпитализация служит существенным фактором риска развития ВТЭ для многих групп больных, включая пациентов с ВЗК [25, 27]. Согласно рекомендациям Американского колледжа врачей пульмонологов (ACCP) по профилактике ВТЭ, несмотря на умеренный риск развития ТГВ (10–40%) у госпитализированных пациентов с ВЗК, рекомендована профилактика ВТЭ с целью улучшения прогноза заболевания [63].
К препаратам первой линии относятся низкомолекулярные гепарины (НМГ), малые дозы нефракционированных гепаринов (НГ) или фондапаринукс. Механическая тромбопрофилактика рекомендуется пациентам с высоким риском кровотечения или в случае абсолютного противопоказания к назначению антикоагулянтов [63]. Международные и национальные организации и общества ВЗК в Северной Америке и Европе приняли эти рекомендации в своих недавних руководствах для лечения пациентов с ВЗК, требующих госпитализаций [63–68]. Наиболее четко изложены рекомендации для пациентов с тяжелым ЯК [64–68]. Однако есть некоторые вопросы, касающиеся антикоагулянтной терапии (АКТ) госпитализированных пациентов с ВЗК, которые нуждаются в особом рассмотрении. Ректальное кровотечение является основным симптомом для пациентов с ВЗК (главным образом при ЯК), и поэтому у врачей практического звена существует оправданное беспокойство по поводу усиления кишечного кровотечения. Данные, полученные из рандомизированных исследований, в которых использовался НГ [69, 70] или НМГ [71, 72] в качестве лечения активных ВЗК (в частности, ЯК), и данные мета-анализа [73] показали, что, несмотря на отсутствие явного преимущества использования гепаринов для улучшения течения ВЗК и уменьшения степени активности, их использование безопасно без развития серьезных неблагоприятных явлений. Гепарин может быть идеальным препаратом для лечения ВЗК, особенно для ЯК, благодаря его антикоагулянтному, противовоспалительному и иммуномодулирующему действию. Для внесения определенности в этот вопрос необходимы более крупные исследования, которые помогут определить оптимальную дозу гепарина, продолжительность лечения и особенности подгруппы пациентов с активным ЯК, которые помогут определить эффективность применения НМГ.
Недавно G. Ra et al. [74] ретроспективно оценили безопасность профилактической АКТ у госпитализированных пациентов с ВЗК. Они сообщили, что 80% пациентов получали антикоагулянты в форме НМГ. Применение антикоагулянтов приоритетно для пациентов с ВЗК, имеющих хирургические осложнения, с тотальным поражением толстой кишки и без признаков выраженного кровотечения. Они установили, что частота кровотечений у пациентов, получавших профилактическое лечение антикоагулянтами, не выше по сравнению с теми пациентами, которые не получали НМГ. Авторы пришли к выводу, согласно которому использование антикоагулянтов у пациентов, госпитализированных с ВЗК, безопасно даже при наличии ректального кровотечения в отсутствие признаков гемодинамической нестабильности [74].
Есть еще одна проблема, нуждающаяся в обсуждении: следует ли назначать антикоагулянтную профилактику только тяжелым госпитализированным пациентам с ВЗК или всем госпитализированным пациентам с ВЗК? Помимо госпитализации, являющейся независимым фактором риска ВТЭ, пациенты с ВЗК имеют дополнительные факторы риска развития тромбоза (хроническое воспаление, катетеризация, иммобилизация и пр.). С учетом всех имеющихся факторов риска целесообразно принимать меры, направленные на минимизацию дополнительных факторов риска развития ТЭО: своевременно и адекватно проводить противовоспалительную терапию, начинать раннюю мобилизацию, обоснованно проводить катетеризацию, своевременно корригировать водно-электролитные нарушения, восполнять дефицит белка, а также сводить к минимуму применение лекарственных препаратов, предрасполагающих к тромбозу. Многие авторы считают, что целесообразно расширить показания к профилактике ТЭО пациентам с ВЗК, ограниченных строгим постельным режимом [25, 27] или госпитализированных по другим показаниям, имея ремиссию ВЗК, поскольку в этих группах также значительно повышается риск ВТЭ и иных ТЭО [25]. Профилактика ВТЭ у госпитализированных пациентов с ВЗК может иметь существенный экономический эффект по сравнению с дорогостоящими скрининговыми тестами, определяющими вероятность ТЭО [75].
Другим важным вопросом, который требует ответа, является определение продолжительности профилактической антикоагулянтной терапии пациентов с ВЗК, не имеющих хирургических осложнений, после выписки из стационара. Исследования показали, что многие ВТЭ возникают в течение ближайшего времени после выписки из стационара, это характерно для пациентов как с ВЗК [24, 25], так и без ВЗК [76]. Пациенты с ВЗК, как правило, выписываются из стационара с улучшением, но не с полной ремиссией заболевания. В настоящее временя нет данных о целесообразности и продолжительности профилактики ВТЭ в период после выписки из стационара, однако профилактика ВТЭ и ТЭО может быть оправданна для пациентов с ВЗК, имеющих повышенный риск тромбоза [76].
Пациенты с ВЗК имеют повышенный риск послеоперационных ВТЭ [33, 34, 43]. Согласно данным исследований и рекомендациям ACCP, пациенты с БК имеют умеренный риск ВТЭ после оперативного вмешательства на кишечнике, тогда как пациенты с ЯК имеют высокий риск послеоперационных ВТЭ [77]. Кроме того, М. Scarpa et al. [78] сообщили, что стандартная профилактическая доза НМГ неадекватна, чтобы предотвратить ВТЭ у пациентов с ВЗК при обширных оперативных вмешательствах, особенно у пациентов с ЯК. Эти данные свидетельствуют о том, что предоперационная профилактика ТЭО у пациентов с ВЗК должна включать более высокие дозы НМГ на более длительные периоды после операции, иногда сочетаться с дополнительными механическими методами [77, 78].
Недавние данные подтвердили, что амбулаторные больные ВЗК с обострением заболевания подвержены повышенному риску ВТЭ [25, 37]. Хотя М. Grainge et al. [25] сообщили, что риск ВТЭ значительно выше в период обострения заболевания по сравнению с периодами ремиссии как у амбулаторных, так и у госпитализированных пациентов с ВЗК, в настоящее время нет ни рекомендаций по первичной профилактике ВТЭ, ни достаточных данных о профилактическом применении антикоагулянтов в амбулаторной практике [78]. Общие профилактические меры в амбулаторных условиях могут включать осведомленность и информирование пациентов о наличии рисков ТЭО с описанием клинических симптомов, характерных для ТЭО; активное купирование обострения ВЗК и оптимальную противорецидивную терапию, раннее выявление и устранение модифицируемых факторов риска ТЭО (использование глюкокортикостероидов, курение, прием оральных контрацептивов, заместительная гормональная терапия, длительные перелеты) [79, 80]. G.C. Nguyen и М. Sharma [79] изучали экономическую эффективность фармакологической профилактики ВТЭ у амбулаторных пациентов с ВЗК и пришли к слежующему выводу: при обострении заболевания она не может быть рекомендована в повседневной клинической практике, несмотря на доказанную эффективность, из-за экономической нецелесообразности.
Нет прямых данных о том, что АКТ эффективна для профилактики ВТЭ у пациентов с ВЗК, поскольку нет рандомизированных контролируемых исследований, которые позволили бы установить высокий уровень доказательности. Однако косвенные данные свидетельствуют: фармакологическая профилактика пациентов с тяжелым течением заболевания значительно снижает частоту ВТЭ и летальность [63].
Первичная профилактика АТЭ
Помимо общих мер, упомянутых выше, и антикоагулянтной профилактики во время госпитализации или после операции клиницисты должны регулярно оценивать риск сердечно-сосудистых заболеваний у пациентов с ВЗК (гипертония, диабет, гиперлипидемия, ожирение, гипергомоцистеинемия, положительный семейный анамнез) и применять профилактические меры и/или лечение этих факторов риска [2].
Терапия ВТЭ и вторичная профилактика
Терапия острой тромбоэмболии у пациентов с ВЗК схожа с таковой пациентов, не страдающих ВЗК. АКТ НГ или НМГ обычно назначают при легком и умеренном ТЭО, тогда как фармакологический или механический тромболизис показан при тяжелых ТЭО, включающих массивный тромбоз с полной окклюзией сосудов [21, 50]. Терапевтические дозы антикоагулянтов или тромболитиков для лечения ТЭО у пациентов с ВЗК представляют серьезную практическую проблему в связи с риском геморрагических осложнений. Решение о назначении АКТ должно быть принято с учетом клинических проявлений, индивидуальной оценки гемостазиограммы, наличия/отсутствия предшествовавших эпизодов ВТЭ, что требует мультидисциплинарного подхода [21, 50]. Безопасность НГ и НМГ доказана в исследованиях, оценивающих эффективность и безопасность гепарина в комплексной терапии активного ВЗК [73]. J.H. Tabibian et al. [81] в систематическом обзоре оценили клинические исходы ТЭО у пациентов с ВЗК при проведении АКТ и механическом тромболизисе. Авторы сообщили об удовлетворительной переносимости пациентами с ВЗК обоих методов. Они предположили, что механический тромболизис целесообразно использовать пациентами с тяжелыми ТЭО в жизнеугрожающих ситуациях, тогда как AКТ может быть предпочтительна для пациентов с менее клинически значимой тромбоэмболией или для больных с более высоким риском кровотечения. Кроме того, они продемонстрировали безопасность обоих методов, даже для пациентов с ректальным кровотечением в отсутствие угрожающего кишечного кровотечения.
Длительность антикоагуляции является важной проблемой для пациентов с ВЗК из-за высокого риска повторных ТЭО. Продолжительность антикоагуляции после первичного лечения тромбоэмболии колеблется от 3 месяцев до пожизненного приема в зависимости от конкретной ситуации. В случаях когда при активном заболевании произошло тромбоэмболическое событие, антикоагуляция должна продолжаться до тех пор, пока не произойдет клиническое улучшение. G.C. Nguyen и C.N. Bernstein [82] предположили, что эффективность пожизненной антикоагуляции в период ремиссии заболевания незначительно выше, чем АКТ в течение 6 месяцев после первого случая ВТЭ. Для длительного лечения ТЭО могут использоваться НМГ, антагонисты витамина К (АВК; варфарин) или прямые пероральные антикоагулянты (ПОАК; ривароксабан, дабигатран, апиксабан и эдоксабан). Новые результаты исследований по эффективности ПОАК демонстрируют сопоставимую эффективность с АВК с более благоприятным профилем безопасности, но доказательная база по их применению пациентами с ВЗК пока недостаточная [83].
Клиническая стратификация риска ВТЭ и ее профилактика у пациентов с ВЗК
Как мы неоднократно отмечали в обзоре и о чем свидетельствуют многочисленные клинические исследования, риск тромбоза у пациентов с ВЗК значительно выше по сравнению с общей популяцией, что значительно утяжеляет течение заболевания и повышает риск летального исхода. Для практических врачей важно знать об этом серьезном внекишечном проявлении, а также необходимо уметь своевременно распознавать и эффективно лечить ТЭО. Как уже упоминалось ранее, международные и национальные общества по изучению ВЗК в Северной Америке и Европе недавно опубликовали рекомендации по профилактике ТЭО у пациентов с ВЗК [63–68]. Тем не менее в реальной клинической практики, несмотря на осведомленность врачей о повышенном риске ТЭО у госпитализированных пациентов с ВЗК, профилактика ВТЭ и иных ТЭО не проводится на постоянной основе.
R. Razik et al. [84] сообщили, что среди 56 гастроэнтерологов из Канады 55% знали о существовании стандартных протоколов профилактики ТГВ у госпитализированных пациентов с ВЗК, более 80% сообщили, что проводили профилактику ВТЭ, но только 50% из них знали о наличии международных/национальных рекомендаций по профилактике ВТЭ. J.J. Sam et al. [85] в аналогичном исследовании сообщили, что среди 135 практикующих гастроэнтерологов США только 67% имели протоколы для профилактики ВТЭ, 45% осведомлены о наличии рекомендаций и 14% сообщили, что никогда не будут проводить профилактику ТЭО у пациентов с ВЗК из-за риска кишечного кровотечения.
В целом же большинство гастроэнтерологов, занимающихся проблемами ВЗК, планируют проводить профилактику ВТЭ. В дополнение А. Tinsley et al. [86] сообщили, что гепарин является препаратом выбора для профилактики ВТЭ и ТЭО, преимущественно у гастроэнтерологов, занимающихся проблемами ВЗК и имеющих стаж работы более 5 лет. Они ретроспективно оценили степень фармакологической профилактики ВТЭ в стационарных условиях при многократной госпитализации в течение одного года и пришли к выводу, что фармакологическая профилактика пациентов с ЯК не была системной, осуществлялась в большинстве случаев неадекватными дозами антикоагулянтов и носила эмпирический характер, несмотря на существующие рекомендации. Таким образом, данные многочисленных исследований демонстрируют, что имеются существенные недостатки в профилактике ВТЭ у госпитализированных пациентов с ВЗК, обусловленные низким уровнем осведомленности практикующих врачей о существующих рекомендациях. Есть необходимость обучения гастроэнтерологов, целью которого является клиническая оценка симптомов и своевременная первичная и вторичная профилактика ТЭО [87]. Ассоциация гастроэнтерологов Канады (АГК) опубликовала конкретные рекомендации по профилактике и лечению ВТЭ у пациентов с ВЗК в различных клинических ситуациях [88]. Рекомендации восполнили многие пробелы, существующие в ведении пациентов с ВЗК. Практические рекомендации АГК по избранным вопросам изложены в табл. 3.
Заключение
Данные литературы свидетельствуют: тромбозы – это характерные и грозные осложнения ВЗК и могут играть роль в патогенезе непосредственно заболевания. Этиопатогенетическая связь между ВЗК и развитием ТЭО пока недостаточно изучена, но можно предположить, что помимо приобретенных факторов гиперкоагуляции существуют и наследуемые факторы, способствующие развитию ТЭО. Гиперкоагуляция, как полагают, участвует в патогенезе ВЗК, и будущее изучение этого феномена поможет выявить потенциальные терапевтические мишени для лечения ВЗК. Артериальные и венозные ТЭО являются грозными внекишечными проявлениями и осложнениями ВЗК, представляющими сложность в лечении пациентов с ЯК и БК, ухудшающие прогноз заболевания и повышающие летальность. Тем не менее осведомленность врачей о рисках развития ТЭО, мерах первичной и вторичной их профилактики, о способах лечения имеет важное значение для предотвращения развития ВТЭ и ТЭО у пациентов с ВЗК. В будущих клинических исследованиях следует уточнить спорные проблемы тромбопрофилактики амбулаторных пациентов с активным заболеванием, тромбопрофилактики у пациентов в период после выписки из стационара, а также ее продолжительность. Кроме того, клинические исследования должны предоставить клиницистам надежные методы или маркеры оценки протромботического риска у пациентов с ВЗК, чтобы иметь возможность оперативно применять профилактические меры в отношении ТЭО.



