Введение
Витамин D необходим для нормального функционирования многих физиологических систем организма. Препараты витамина D традиционно используются для лечения остеопороза и компенсации недостаточного поступления с пищей кальция и витамина D, особенно при низкой инсоляции. В частности, витамин D влияет на пролиферацию, дифференциацию и апоптоз клеток, а также модулирует активность иммунной системы и регулирует массу тела. При недостатке витамина D в организме нарушаются фундаментальные клеточные процессы, что приводит к абнормальному развитию скелета, кардиоваскулярным и онкологическим заболеваниям. В представленной работе сформулирована физиологическая модель влияния витамина D и кальция на возникновение, течение и исход онкологических заболеваний и проводится сравнение с доказательными данными. Модель учитывает мультимодальность взаимосвязей между уровнями активных форм витамина D в сыворотке и рядом генетических факторов и факторов внешней среды, что делает ее весьма полезной при планировании дальнейших клинических исследований противоопухолевых эффектов препаратов на основе витамина D и кальция.
Минералы и витамины поступают с пищей и необходимы для поддержания нормального гомеостаза организма человека. Каждый из микронутриентов оказывает свое уникальное физиологическое воздействие через специфические молекулярные механизмы.
В частности, витамин D также вызывает смерть раковых клеток, что связано с иммуномодулирующей активностью его рецептора [1, 2], кальций необходим для активации каскада кальпаинов, вызывающих апоптоз [1], и т. д.
Противоопухолевый эффект витамина D основан на прямом его влиянии на транскрипцию более 3000 генов, вовлеченных в регуляцию роста, деления и апоптоза клеток [3]. Апоптоз (программированная клеточная смерть) важен для элиминации опухолевых клеток.
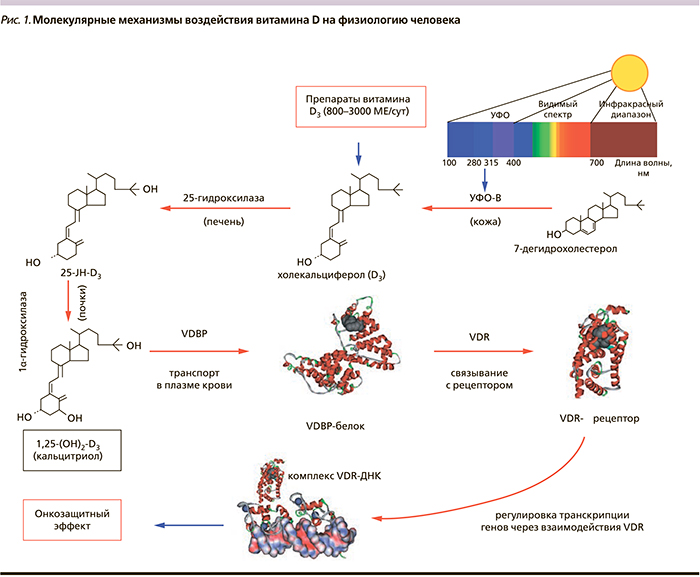
Для того чтобы витамин D оказывал защитный эффект, его молекула должна пройти несколько последовательных стадий активации. Витамин D сначала посредством биотрансформаций преобразуется в активную форму, которая затем взаимодействует со специфическими рецепторами (VDR). Биотрансформация витамина D начинается в коже под воздействием ультрафиолетового облучения (УФО) и продолжается в печени и почках (рис. 1).
Следует помнить, что 3 диапазона УФО: УФО-А (315–400 нм), УФО-В (280–315 нм) и УФО-С (100–280 нм), оказывают разное биологическое действие. Витамин D в коже вырабатывается под воздействием УФО-В, которое достигает поверхности земли только при условии чистого воздуха, отсутствия облаков, при определенной высоте солнца над горизонтом.
С увеличением географической широты уровень УФО-В уменьшается и, соответственно, уменьшается синтез витамина D. В частности, для многих регионов России характерен низкий уровень УФО-В, что вносит вклад в формирование хронического дефицита витамина D у населения. В России только 3% женщин старше 45 лет имеют нормальные показатели витамина D при определении гидроксивитамина D в плазме крови [4].
Эффекты УФО-В на биосинтез витамина D могут быть сведены к нулю при использовании солнцезащитных кремов, у людей с темной кожей и др. Искусственное облучение (в соляриях) характеризуется очень высоким уровнем УФО-А, не оказывающего существенного влияния на биосинтез витамина D, более того – имеющего проканцерогенное действие [5].
В печени витамин D3 гидроксилируется и превращается в 25-оксихолекальциферол (25-ОН-D3) при посредстве фермента 25-гидроксилазы.
В почках при их нормальном функционировании 25-ОН-D3 трансформируется в 1,25-диоксихолекальциферол (1,25-(ОН)2-D3), наиболее активную форму витамина. Эта активная форма переносится в кровяном русле витамин D-связывающим белком (VDBP). Биологическое воздействие активной формы витамина оказывается через связывание с VDR (рис. 1).

Как следует из рис. 1, взаимосвязь между приемом витамина D и уменьшением риска онкологических заболеваний многоступенчата и включает ряд дополнительных факторов, способных повлиять на терапевтическую эффективность препаратов на основе витамина D. Схема на рис. 1, например, указывает на наличие по крайней мере 6 стадий, опосредующих влияние витамина D на транскрипцию генов. На каждой из этих стадий действуют определенные факторы (например, суммарный уровень УФО-В-облучения, получаемого данным пациентом, уровни экспрессии генов ферментов-гидроксилаз, наличие веществ, ингибирующих гидроксилазы, метаболическая активность печени и почек, полиморфизмы генов гидроксилаз, транспортного белка, рецептора и т.д.), влияющие на выраженность терапевтического эффекта при приеме витамина D.
 Например, при заболеваниях почек (метаболическая нефропатия, редкие наследственные аномалии обмена витамина D и др.) применение холекальциферола может быть недостаточно эффективным, что требует назначения активированных форм витамина D3. В то же время для широкомасштабной профилактики активные формы витамина не всегда подходят в силу необходимости титрования дозы и контроля возможной гиперкальциемии у индивидуальных пациентов. В данной работе мы формулируем обобщенную физиологическую модель противоопухолевого воздействия витамина D и проводим сравнение с данными доказательной медицины и генетической эпидемиологии. Систематическое рассмотрение соответствующих белков проведено с использованием современной технологии системно-биологического анализа – метода функциональных взаимосвязей [6].
Например, при заболеваниях почек (метаболическая нефропатия, редкие наследственные аномалии обмена витамина D и др.) применение холекальциферола может быть недостаточно эффективным, что требует назначения активированных форм витамина D3. В то же время для широкомасштабной профилактики активные формы витамина не всегда подходят в силу необходимости титрования дозы и контроля возможной гиперкальциемии у индивидуальных пациентов. В данной работе мы формулируем обобщенную физиологическую модель противоопухолевого воздействия витамина D и проводим сравнение с данными доказательной медицины и генетической эпидемиологии. Систематическое рассмотрение соответствующих белков проведено с использованием современной технологии системно-биологического анализа – метода функциональных взаимосвязей [6].
Системно-биологический анализ противоопухолевых эффектов витамина D
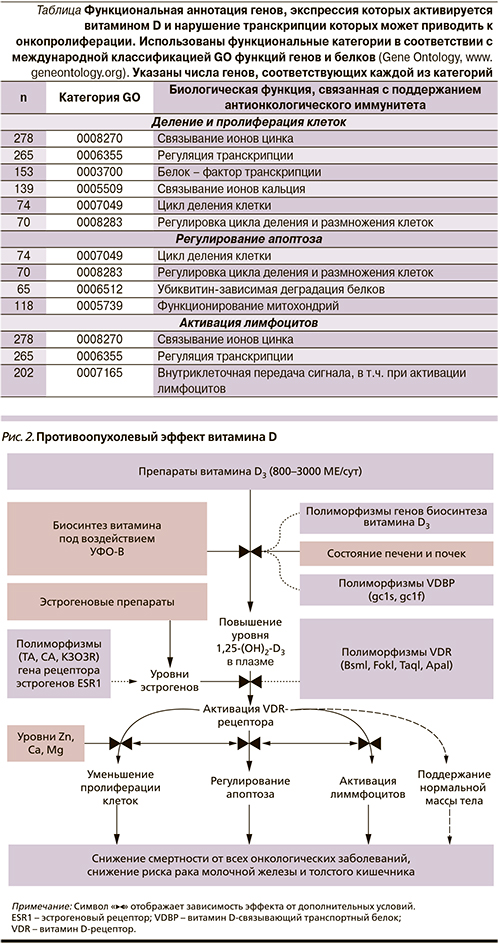
Как было отмечено выше, биологические эффекты витамина D осуществляются через взаимодействие с VDR. Активированная витамином молекула VDR взаимодействует с ДНК более 3000 генов, оказывая комплексное воздействие на процессы транскрипции генома. В настоящей работе данные изменения транскрипции моделировались методом функционального связывания с использованием функциональных категорий стандартной аннотации генома человека (Gene Ontology). В результате моделирования было установлено, что витамин D может приводить к изменениям в экспрессии более 700 генов, активность которых чрезвычайно важна для онкопротекции (табл. 1). Данные гены можно условно подразделить на 3 большие группы: деление и пролиферация клеток, регулирование апоптоза, активация лимфоцитов.
На основе систематического анализа уровней биологической функции и суммированных в табл. 1 данных моделирования транскрипции под воздействием витамина D мы сформулировали качественную модель взаимосвязи между риском онкологических заболеваний и витамином D (рис. 2). В сформулированной нами модели известные противоопухолевые эффекты витамина D (уменьшение риска возникновения заболевания, интенсивности заболевания и онкологической смертности) объединены.
Любой противоопухолевый эффект витамина D обусловлен иммуномодулирующей и антипролиферативной активностью активированного VDR. Этот рецептор экспрессируется во многих клетках иммунной системы: моноцитах, макрофагах, Т- и В-лимфоцитах. Активация транскрипции посредством VDR в этих и других типах клеток имеет антипролиферативный, продифференцирующий и иммуномодулирующий эффекты [7].
VDR индуцирует регулирующие Т-клетки, а также воздействует на секрецию противовоспалительных и антипролиферативных цитокинов [8]. Активная форма витамина увеличивает активность Т-киллеров и макрофагов. Сигнал от VDR достигает белка «NF-κВ-транскрипционный фактор», регулирующего дифференцировку и рост клеток [9]. Так как рецепторы витамина D представлены практически во всех тканях тела, общий механизм противоопухолевого воздействия витамина одинаков для всех тканей. Однако степень активации вышеупомянутых процессов рецептором витамина D зависит от ряда дополнительных факторов.
Например, уровни метаболитов эстрогенов, повышенная экспрессия разных типов рецепторов к эстрогену, обеспеченность витамином D3 и риск онкологических заболеваний взаимозависимы. Взаимодействие между уровнями эстрогенов (которые повышены при регулярном приеме эстроген-содержащих препаратов) и витамином D осуществляется, по всей видимости, на уровне внутриклеточных сигнальных путей. Экспрессия функциональной формы рецептора витамина D зависит от ERK1/2 фосфорилирования, вызываемого активацией эстрогеновых рецепторов [10, 11].
Несколько исследований доказательной медицины указывают на взаимосвязь между эффективностью терапии витамином D и приемом эстроген-содержащих препаратов. Так, зависимость между увеличением уровней 25(OH)D плазмы с уменьшением риска рака молочной железы (РМЖ) была намного более ярко выражена (р<0,0001) у пациенток, никогда не проходивших курс гормональной терапии [12]. Более того, результаты одного исследования [13] даже указывают на возможность того, что у пациенток, находящихся на гормональной терапии эстрогенами, применение витамина D может приводить к увеличению риска колоректального рака (КРР). В то же время у пациенток, не употребляющих эстрогены, наблюдается уменьшение риска КРР даже при применении таких небольших доз витамина D3, как 400 МЕ/сут (относительный риск [ОР] – 0,7; 95% доверительный интервал [ДИ] – 0,5–1,1).
Сопоставление результатов системно-биологического анализ противоопухолевых эффектов витамина D с данными доказательной медицины
Данные фундаментальной медицины подтверждаются доказательной медициной. Например, дотации витамина D (1100 МЕ/сут) в осенне-весенний период приводят к уменьшению на 60% заболеваемости раком (всех видов) в течение 4 лет клинических наблюдений [5]. Далее приведены результаты крупномасштабных эпидемиологических исследований и мета-анализов, подтверждающих важность витамина D в профилактике и терапии раковых заболеваний. Использованные нами критерии отбора достоверных исследований по доказательной медицине описаны в работе [15]. Цитируемые далее исследования выполнены преимущественно на популяционных выборках европеоидов.
Биосинтез витамина под воздействием УФО-В
Витамин D синтезируется под воздействием УФ, и, следовательно, суммарные уровни облучения солнцем могут влиять на уровни витамина D в крови. Наблюдаются значительные различия между заболеваемостью раком в странах с разной инсоляцией [16]. Сезонные колебания кальцитриола в плазме связаны с изменением роста заболеваемости раком в период недостаточной инсоляции. Максимальный уровень витамина D3 в сыворотке крови отмечается с июля по сентябрь, умеренный дефицит витамина D (25-(OH)-D3 < 20 нг/мл) наблюдается среди 13% обследованных, а в зимне-весенний период эта цифра возрастает до 36% [17]. В зимний период уровень 25-(OH)-D3 в сыворотке снижается на 20–120 %, и эти колебания коррелируют с ростом заболеваемости раком зимой [18–20]. В исследовании, проведенном в Канаде, регулярная естественная инсоляция у девушек 10–19 лет была ассоциирована со значительным снижением риска РМЖ (ОР – 0,65; 95% ДИ – 0,50–0,85, р=0,0006). Данный возрастной период соответствует интенсивному росту и развитию организма [21].
Поступление витамина D с пищей и со специальными препаратами является значительно более важным, чем инсоляция (позитивный эффект которой зависит от многочисленных факторов, см. Введение), источником необходимого организму витамина. Регулярное употребление в пищу продуктов, богатых витамином D, таких как печень трески и молоко, приводит к значительному снижению риска РМЖ [21, 22]. По сравнению с крайне низким уровнем употребления витамина D (менее 80 МЕ/сут) даже чуть более высокие уровни (более 200 МЕ/сут) соответствовали уменьшенному риску РМЖ в пременопаузе (ОР – 0,50; 95% ДИ – 0,26–0,96) [22]. Уменьшение риска рецидива КРР также соответствовало более высокому уровню принимаемого витамина [23, 24].
Витамин D, поступающий с пищей, лекарственными препаратами или синтезированный под воздействием солнечного света, приводит к повышению уровней биологически активных форм витамина [25-(ОН)-D3 и 1,25-(ОН)2-D3] в плазме крови. Общепринятым методом мониторинга метаболизма витамина D считается определение концентрации 1,25-(ОН)2-D3 в плазме: уровни 0–10 нг/мл соответствуют дефициту витамина, 10–30 нг/мл – недостатку, 30–100 нг/мл – норме. Верхняя граница интервала нормы – 56 нг/мл [1 нг/мл 1,25-(ОН)2-D3 соответствует 2,496 нмоль/л] [25].
Большинство исследований витамина D в сфере доказательной медицине ориентированы именно на установление корреляций между уровнями активных форм витамина в плазме крови и риском различных онкологических заболеваний. Более высокие уровни 25-(OH)-D соответствуют уменьшению онкологической смертности (ОР – 0,52; 95% ДИ – 0,29–0,94) [26], снижению риска КРР на 40–70% [27, 28], а также снижению риска развития более тяжелых форм и рецидивов КРР [29, 30]. Увеличение уровня 25-(OH)-D от 12,5 до 30,0 нг/мл соответствовало уменьшению риска РМЖ на 25% [31].
Ассоциации различных онкологических заболеваний с обеспеченностью организма пациента витамином D подтверждаются, в частности, данными по взаимосвязи нуклеотидных полиморфизмов генов, вовлеченных в гомеостаз витамина D. Величина защитного противоопухолевого эффекта, производимого активными формами витамина D, зависит от генетических факторов, прежде всего – от функциональных полиморфизмов генов VDR и VDBP. Генотип Gc2-2 гена VDBP соответствовал уменьшению риска РМЖ (ОР – 0,72; 95% ДИ – 0,54–0,96) [32] наряду с генотипом BB полиморфизма BsmI гена VDR [33]. Генотип Tt полиморфизма VDR-TaqI соответствовал уменьшенному риску (ОР – 0,70; 95% ДИ – 0,54–0,90) меланомы кожи [34], а менее функциональный генотип ff полиморфизма VDR FokI был ассоциирован с увеличением риска рака простаты и, в частности, с более агрессивным течением заболевания [17]. Полиморфизмы в гене VDR взаимодействуют с другими факторами, например с семейной историей РМЖ [35] или с инсоляцией [20]. Генотипы, характеризующиеся более высокой активностью рецептора (такие, как FokI FF/Ff, TaqI tt, BglI BB), соответствовали понижению риска рака простаты при условии достаточной инсоляции [20].
 Мета-анализ показал, что наличие у пациентов варианта «f» полиморфизма Fok1 гена рецептора витамина было ассоциировано с 26%-ным увеличением риска рака кожи (ОР – 1,26; 95% ДИ – 1,04–1,53), вариант «t» был ассоциирован с 88%-ным повышением риска заболевания (ОР – 1,88; 95% ДИ – 1,29–2,74), а вариант «а» полиморфизма Apa1 – с 27%-ным повышением риска (ОР – 1,27; 95% ДИ – 1,05–1,53). Мета-анализ 39 исследований подтвердил, что генотип «ff» гена VDR был ассоциирован с повышением риска РМЖ на 9% (ОР – 1,09; 95% ДИ – 1,02–1,16, р=0,007) [36].
Мета-анализ показал, что наличие у пациентов варианта «f» полиморфизма Fok1 гена рецептора витамина было ассоциировано с 26%-ным увеличением риска рака кожи (ОР – 1,26; 95% ДИ – 1,04–1,53), вариант «t» был ассоциирован с 88%-ным повышением риска заболевания (ОР – 1,88; 95% ДИ – 1,29–2,74), а вариант «а» полиморфизма Apa1 – с 27%-ным повышением риска (ОР – 1,27; 95% ДИ – 1,05–1,53). Мета-анализ 39 исследований подтвердил, что генотип «ff» гена VDR был ассоциирован с повышением риска РМЖ на 9% (ОР – 1,09; 95% ДИ – 1,02–1,16, р=0,007) [36].
Полногеномное генетическое ассоциативное исследование когорты 4501 европейца показало, что уровни активной формы витамина D в крови, 25-гидроксивитамина D, ассоциированы с полиморфизмами генов, кодирующих ферменты биосинтеза витамина: никотинамидадениндинуклеотид (NAD) синтетазы, 7-дегидрохолестеринредуктазы (синтезирует холестерин из 7-дегидрохолестерола), ацил-коэнзим-дегидрогеназы (биосинтез холестерина и витамина D) и С-25-гидроксилазы (преобразует витамин D3 в активную форму) [37].
Помимо приведенных выше данных противоопухолевый эффект витамина D3 подтверждается также весьма обширным кругом результатов доказательной медицины, указывающих на взаимосвязи между дефицитом витамина D и риском РМЖ, КРР и смертностью от других видов онкологических заболеваний.
Доказательные данные: витамин D и РМЖ
Мета-анализ проспективных исследований взаимосвязи уровней 25-гидроксивитамина D в сыворотке крови и риска РМЖ (рис. 3) включил 14 исследований (9110 случаев РМЖ и 16 244 контрольных). Более высокие уровни 25(OH)D были достоверно ассоциированы со снижением риска РМЖ (ОР=0,85; 95% ДИ – 0,75–0,95) [38].
Мета-анализ 9 исследований, включивший 5206 пациенток и 6450 контрольных случаев, оценивал влияние моделирования параметра «доза–ответ» у женщин в постменопаузе на риск РМЖ. Оказалось, что риск снижался на 12% при повышении уровней 25(OH)D в плазме на каждые 5 нг/мл (ОР – 0,88; 95% ДИ – 0,79–0,97) (рис. 4).
Дальнейшего снижения риска не наблюдалось при уровнях 25(OH)D более 35 нг/мл [39]. Мета-анализ эффектов витамина D показал, что в квартиле с самым высоким уровнем 25(ОН)D отмечено достоверное снижение риска РМЖ на 48% (ОР – 0,5; 95% ДИ – 0,40–0,68, р<0,00001) [40].
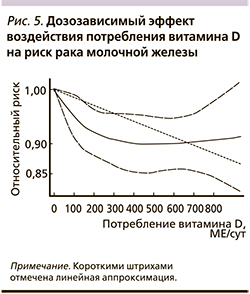
Мета-анализ эффектов потребления витамина D включил данные 10 клинических исследований (n=14450). Анализ дозозависимых эффектов позволил установить, что потребление витамина D не менее 400 МЕ/сут, кальция более 600 мг/сут и уровни витамина в сыворотке более 30 нг/мл соответствовали наименьшему риску заболевания (рис. 5) [41].
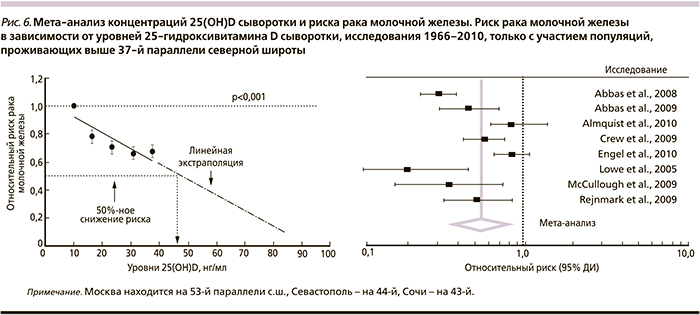
Мета-анализ 11 исследований влияния уровней 25-гидроксивитамина D сыворотки на риск РМЖ показал, что уровни 25(OH)D в самом высоком квартиле соответствовали снижению риска патологии на 39% (ОР – 0,61, 95% ДИ – 0,47–0,80). Уровни 25(ОН)D в 47 нг/мл и более соответствовали снижению риска РМЖ на 50% (рис. 6) [42].
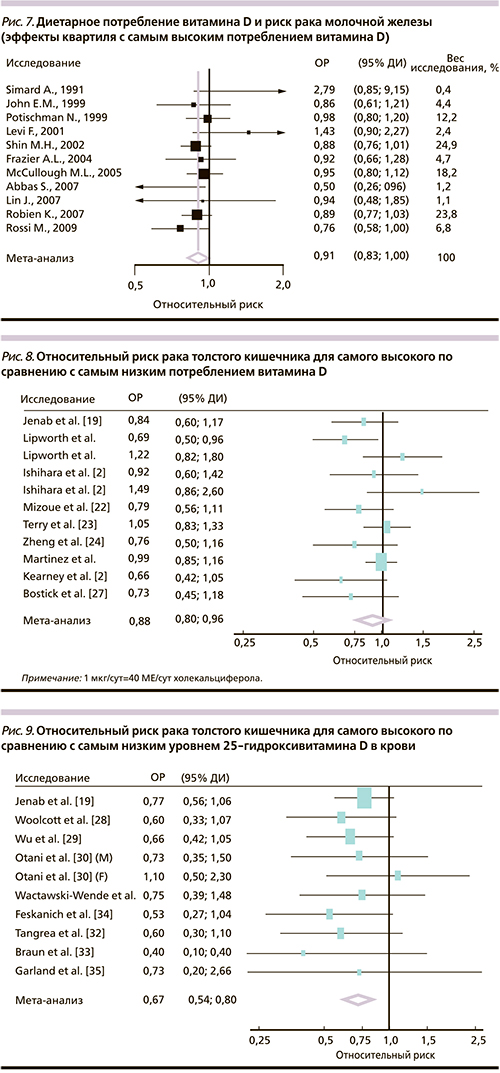
Мета-анализ эффектов высокого потребления витамина D (более 800 МЕ/сут) на риск РМЖ включил 11 исследований по диетарному потреблению витамина, 7 исследований по уровням 25(OH)D и риску РМЖ. Самый высокий квартиль значений уровней 25(OH)D в крови был ассоциирован с 45%-ным (ОР – 0,55, 95% ДИ – 0,38–0,80) снижением риска РМЖ (рис. 7) [43].
Доказательные данные: КРР и дефицит витамина D
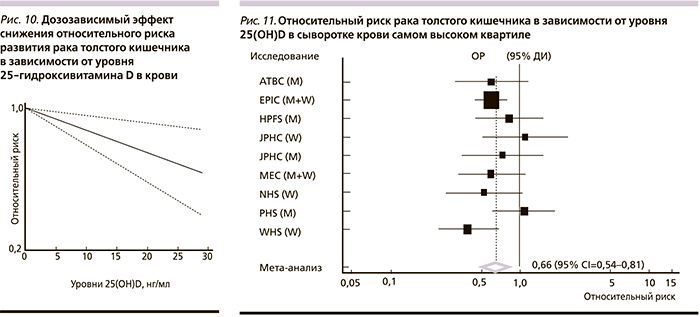
Мета-анализ 28 наблюдательных исследований показал, что увеличение уровней 25(ОН)D в крови на каждые 10 нмоль/л связано с 6%-ным (95% ДИ – 3–9%) снижением риска КРР кишечника [44]. Систематический обзор проспективных исследований взаимодействий между витамином D и риском КРР включил 18 исследований с более 1 млн участников из европейских стран (рис. 8–10). Самый высокий квартиль потребления витамина D соответствовал снижению риска на 12% (ОР – 0,88; 95% ДИ – 0,80–0,96); самый высокий квартиль уровней 25(ОН)D – снижению риска на 33% (ОР – 0,67; 95% ДИ – 0,54–0,80).
Мета-анализ взаимосвязи уровней витамина D в сыворотке крови и риска КРР включил 10 исследований и показал, что увеличение содержания 25(OH)D на каждые 20 нг/мл было ассоциировано со снижением риска патологии на 18% (ОР – 0,82, 95% ДИ – 0,69–0,97) [45].
Мета-анализ 8 проспективных исследований по уровням витамина D в крови и риска КРР включил 2690 пациентов с патологией и контрольную группу лиц соответствующих возрастных групп. По сравнению с квартилем самых низких значений 25(OH)D уровни активной формы витамина в самом высоком квартиле соответствовали 34%-му снижению риска (ОР – 0,66, 95% ДИ – 0,54–0,81) [46] (рис. 11).
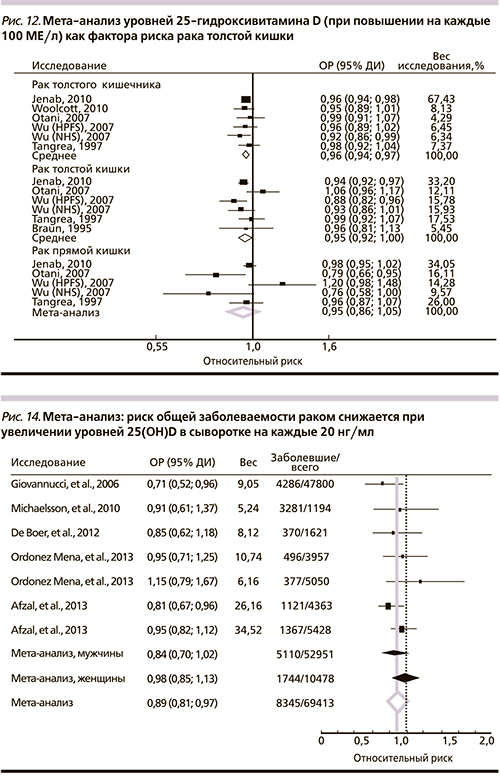
Мета-анализ диетарного потребления витамина D3, уровней 25-гидроксивитамина D сыворотки крови, полиморфизмов гена VDR и риска КРР позволил установить достоверное снижение риска заболевания на 5% при увеличении диетарного потребления витамина D3 на каждые 100 МЕ/сут (ОР – 0,95; 95% ДИ – 0,93–0,98, 10 исследований); наибольшее снижение риска отмечено для дозировок витамина более 700 МЕ/сут. Более высокие уровни 25-гидроксивитамина D сыворотки (диапазон значений – 200–1800 МЕ/л) также были достоверно ассоциированы со снижением риска: повышение на каждые 100 МЕ/л соответствовало снижению риска на 4% (ОР – 0,96; 95% ДИ – 0,94–0,97; 6 исследований). Вариант BB полиморфизма BSMI гена VDR также был ассоциирован со сниженным риском (ОР – 0,57, 95% ДИ – 0,36–0,89) [47] (рис. 12, 13).
Одним из механизмов воздействия недостаточной обеспеченности витамином D служит избыточная масса тела, возникающая при низких уровнях активной формы витамина в крови. Мета-анализ, включивший данные по 13 различным онкологическим заболеваниям, показал, что низкие уровни 25(OH)D соответствуют по меньшей мере 20% случаев рака при высоком индексе массы тела (ИМТ). При этом вклад низких уровней 25(OH)D существенно различен для разных онкологических заболеваний. Например, низкие уровни 25(OH)D ассоциированы с 40 %-ным повышением риска РМЖ при высоком ИМТ, с 26 %-ным повышением риска КРР у мужчин и 75 %-ным – у женщин. Увеличение уровней 25(OH)D в сыворотке на каждые 10 нг/мл соответствует снижению риска развития рака ободочной и прямой кишки на 18 %. В подгруппе пациентов с уровнями 25(OH)D более 38 нг/мл этот риск снижался в 2 раза по сравнению с подгруппой с уровнями менее 16 нг/мл [48].
Доказательные данные: смертность и обеспеченность витамином D
Мета-анализ индивидуальных данных участников (26 018 мужчин и женщин в возрасте 50–79 лет) показал, что за время наблюдения 2227 участников исследования умерли от рака. Уровни 25-гидроксивитамина D в самом нижнем квинтиле (1/5 часть) соответствовали повышению риска на 70% (ОР – 1,70; 95% ДИ – 1,00–2,88) [49].
Мета-анализ влияния долговременного (от 2 до 7 лет) приема препаратов витамина D на смертность показал, что прием 400–833 МЕ/сут витамина D достоверно снижает смертность от рака в среднем на 12% (ОР – 0,88; 95% ДИ – 0,78–0,98) [50].
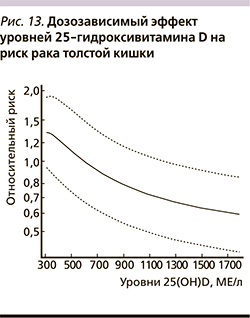
Уровни 25-гидроксивитамина D в сыворотке крови снижают риск заболеваемости раком и смертности. Систематический мета-анализ показал, что повышение уровней 25(OH)D сыворотки на каждые 20 нг/мл приводил к снижению заболеваемости различными формами рака на 11% (ОР – 0,89; 95% ДИ – 0,81–0,97; 5 исследований) и смертности на 17% (ОР – 0,83; 95% ДИ – 0,71–0,96). При этом достоверные ассоциации более высоких уровней 25(OH)D со сниженной смертностью относились преимущественно к подгруппе женщин (ОР – 0,76; 95% ДИ – 0,60–0,98) (рис. 14) [51].
Мета-анализ воздействия долгосрочного приема витамина D (более 3 лет) на смертность включил данные 42 рандомизированных исследований. Терапия витамином D достоверно снижала смертность в среднем на 6% (ОР – 0,94; 95% ДИ – 0,90–0,98). Короткие периоды приема витамина D (менее 3 лет непрерывного приема) не имели достоверных ассоциаций со снижением смертности (ОР – 1,04; 95% ДИ – 0,97–1,12, р=0,1) [52].
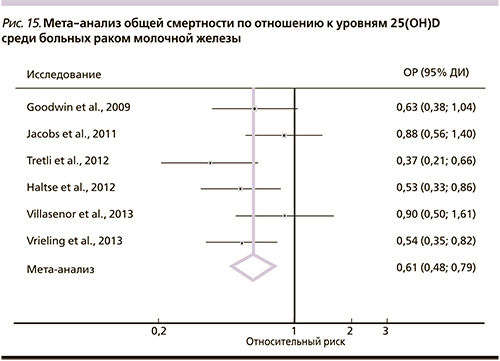
Мета-анализ 30 проспективных исследований заболеваемости (24 исследования, n=31 867) и смертности (6 исследований; 870 смертей) вследствие РМЖ показал, что уровни активной формы витамина 25(OH)D в самом высоком квартиле достоверно снижали смертность от РМЖ – на 42% (ОР – 0,58; 95% ДИ – 0,40–0,5) и смертность от всех причин (ОР – 0,61; 95% ДИ – 0,48–0,79) (рис. 15) [53].
Заключение
Сформулированная в данной работе комплексная молекулярно-физиологическая модель противоопухолевого воздействия витамина D3 убедительно подтверждается данными доказательной медицины. Бо́льшая часть территории России находится в зоне низкой инсоляции. Необходимое для биосинтеза витамина D излучение диапазона УФО-В не достигает поверхности земли в промышленных зонах, мегаполисах, зонах лесных пожаров и пылевых бурь вследствие повышенного загрязнения атмосферы. Более того, в России витамин D не входит в программы профилактики опухолей (напомним, что, по данным Госкомстата РФ за 2012 г., смертность от онкологических заболеваний занимает 3-е место). Сформировавшаяся точка зрения на витамин D как исключительно «витамин для лечения рахита в раннем возрасте» кардинально устарела. И фундаментальные, и клинико-эпидемиологические данные свидетельствуют о необходимости срочной просветительской работы среди населения в отношении важной роли витамина D в профилактике и лечении онкологических заболеваний. С этой целью витамин D следует принимать в дозах 400–800 МЕ/сут в течение достаточно длительных интервалов времени (не менее 3 лет); особенно важен регулярный прием витамина D (800–1000 МЕ/сут) с октября по май. Возможным вариантом для программы профилактики онкологических заболеваний служит использование эффективной и безопасной водорастворимой формы витамина D3 «Аквадетрим» по 1–2 капли (1 кап. = 500 МЕ) ежедневно длительно (не менее нескольких лет). Данный препарат характеризуется безу-пречной фармакологической историей применения пациентами в различные возрастные периоды (новорожденность, раннее детство, дошкольный подростковый, молодой, средний, пожилой возраст), при беременности, пациентами с нарушениями всасывания витамина D (с болезнью Крона, муковисцидозом, заболеваниями тонкого кишечника, дисфункцией печени и др.), что делает перспективным его применение для профилактики и терапии онкологических заболеваний в любом возрасте и при различном состоянии кишечника. В частности, перспективно дополнение Аквадетримом заместительной гормональной терапии пероральными эстрогенами, которая, как известно, характеризуется повышенным риском развития раковых заболеваний (особенно когда применяется в высоких дозах перорально) [54]. Препарат рекомендуется употреблять во время завтрака или обеда по 1–2 капли с питьевой водой.



