Введение
Бактерии образуют биопленки как способ оградить себя от агрессивных факторов внешней среды и выжить. Поэтому биопленки в природе встречаются очень часто. Еще в 1683 г. А. ван Левенгук наблюдал и описывал биопленки, выделенные с поверхности зубов с помощью своего примитивного микроскопа. Однако тема биопленок не особо интересовала исследователей и практикующих врачей до начала 1970-х гг., когда Н. Хойби обнаружил связь между развитием очагов хронического воспаления и большим титром бактерий у пациентов с муковисцидозом [1]. С тех пор признано, что биопленки могут быть причиной большого числа клинических осложнений распространенных заболеваний [2, 3] и вносят отдельный вклад в течение хронических инфекций [4].
Бактериальные биопленки – это скопление бактерий, прикрепленных к поверхности ткани и/или друг к другу. Вокруг этих бактерий образуется матрикс. Матрикс биопленки состоит из таких веществ, как белки (например, фибрин), полисахариды (например, альгинат) и пр. Оставаясь бездействующими и скрытыми от иммунной системы под матриксом, они могут вызывать локальное повреждение тканей, а затем острую инфекцию. Внутри биопленки бактерии адаптируются к аноксии окружающей среды и ограничению питательных веществ, демонстрируя измененный метаболизм, экспрессию генов и выработку белка, что может приводить к более низкой скорости метаболизма и уменьшению скорости деления клеток [3, 5]. Кроме того, эта адаптация делает бактерии более устойчивыми к противомикробной терапии за счет инактивации противомикробных агентов. При формировании очагов бактерий с биопленками ни врожденный, ни приобретенный иммунный ответы не могут достаточно уничтожать бактерии в биопленках, вместо этого ускоряют повреждение коллатеральных тканей [6]. Следовательно, заболевания, связанные с биопленками, обычно представляют собой стойкие инфекции, которые развиваются медленно, редко разрешаются с помощью собственной иммунной системы и сопровождаются непрогнозируемой реакцией на антимикробную фармакотерапию.
Помимо бактерий грибы рода Candida также могут формировать биопленки, например C. albicans, C. glabrata, C. tropicalis и C. parapsilosis.
C. albicans являются наиболее распространенными грибковыми патогенами человека, вызывающими как инфекции на слизистых оболочках, так и системные инфекции. Это объясняется тем, что C. albicans обладает высокой способностью к адаптации, что позволяет этим микроорганизмам изменять статус комменсального микробного агента на статус агрессивного патогена благодаря имеющемуся у них набора факторов вирулентности. В частности, способность изменять морфологию и образовывать биопленки является центральным звеном в патогенезе C. albicans [7].
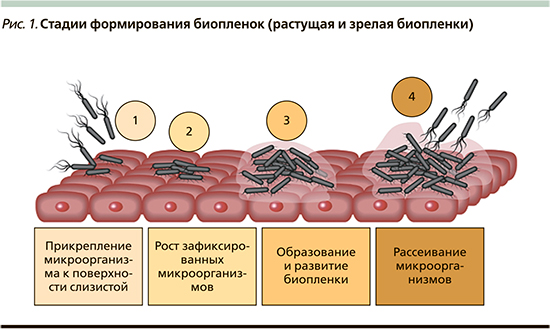
Стоит также отметить, что на сегодняшний день известно о двух типах биопленок – формирующиеся био и зрелые биопленки. Тип биопленки определяется стадией ее формирования. Обычно считается, что формирование биопленки происходит в течение четырех основных стадий: 1) прикрепление бактерий к поверхности, 2) образование микроколоний, 3) созревание биопленки и 4) рассредоточение бактерий, которые затем могут колонизировать новые области [8]. Этот процесс образования биопленок изображен на рис. 1.
Бензидамина гидрохлорид – препарат, относящийся к классу нестероидных противовоспалительных средств, но обладающий широким спектром антимикробной активности [9]. Поэтому этот препарат крайне востребован в лечении инфекционных заболеваний ротоглотки, вызываемых значительным числом видов грамположительных и грамотрицательных бактерий.
Материал и методы
В исследовании использовали коллекционные (n=24) и клинические (n=17) штаммы микроорганизмов, полученные из международных и государственной коллекций и выделенные от пациентов лечебных учреждений Российской Федерации, идентифицированные и охарактеризованные в отделе молекулярной микробиологии ФБУН ГНЦ ПМБ (табл. 1, 2).
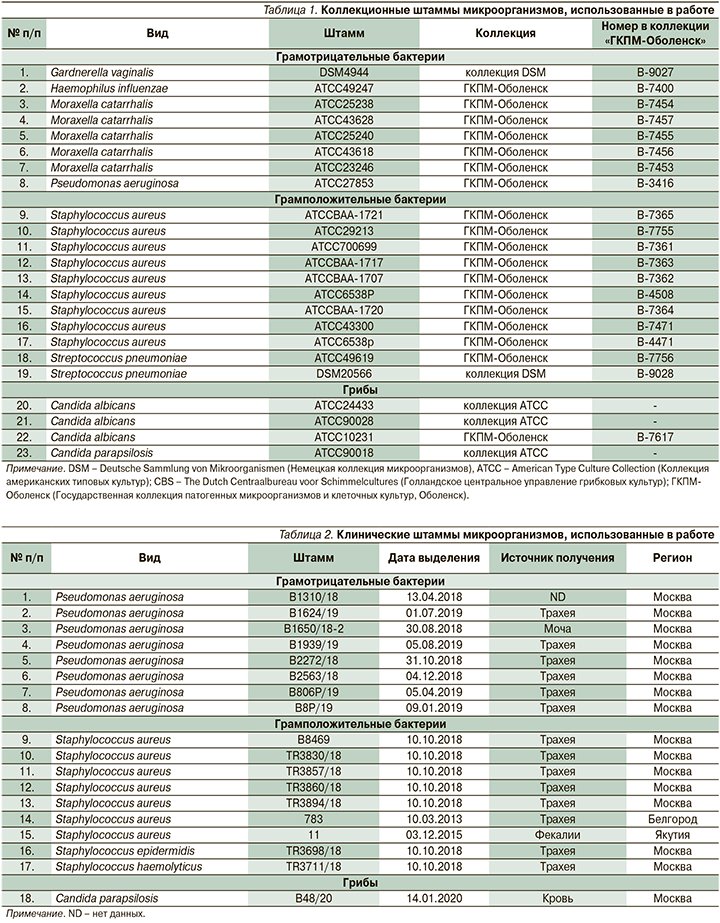
Штаммы P. aeruginosa, Candida spp., M. catarrhalis и Staphylococcus spp. выращивали на плотной питательной среде Mueller Hinton Agar (HiMedia Laboratories, Индия) и жидкой питательной среде Mueller Hinton Broth (HiMedia Laboratories, Индия). Для культивирования Candida spp. в питательную среду Mueller Hinton Agar добавляли глюкозу до 0,1%. Штаммы культивировали при температуре 37°C в аэробных условиях. Штаммы H. influenzae, S. pneumoniae и G. vaginalis культивировали на плотной питательной среде Шоколадный агар (ФБУН ГНЦПМБ, Оболенск, Россия) при температуре 37°C в анаэробных условиях. Микроорганизмы хранили при температуре -72°C в 20%-ном водно-глицериновом растворе.
Кристаллический препарат бензидамина гидрохлорид (Angelini Acraf S.p.A., Италия) растворяли в стерильной дистиллированной воде (стоковый раствор) до концентрации 25600 мг/л, хранили в течение 14 дней при температуре +4°C. Раствор представлял собой прозрачную жидкость, при хранении осадка не образовывалось.
Минимальную подавляющую концентрацию (МПК) бензидамина гидрохлорида для планктонных клеток P. aeruginosa, M. catarrhalis, S. aureus и C. albicans определяли, согласно МУК 4.2.1890-04 [10], методом серийных разведений в бульоне с использованием концентраций препарата, равных 0,2 мг/л, 0,3, 0,6, 1,3, 2,5, 5, 10, 20, 40, 80, 160, 320, 640, 1280 и 2560 мг/л. МПК бензидамина гидрохлорида для планктонных клеток H. influenzae, S. pneumoniae и G. vaginalis определяли на плотной питательной среде, согласно МУК 4.2.1890-04, методом серийных разведений в агаре с использованием концентраций препарата, равных 40, 80, 160, 320, 640, 1280 и 2560 мг/л. За МПК принимали минимальную концентрацию препарата, при которой отсутствовал видимый рост тестируемой культуры микроорганизма.
Способность штаммов микроорганизмов к образованию биопленок определяли в 96-луночных планшетах, согласно методу O’Toole, 2011 [11]. Измеряли оптическую плотность на спектрофотометре Multiskan FC (Thermo Scientific, США) при длине волны 595 нм. Степень биопленко-образования определяли по критериям, предложенным L.B. Rodrigues et al. (2010): отсутствие биопленки при ODs≤ODnc, где ODs – оптическая плотность тестируемого образца, ODnc – оптическая плотность контрольного образца; слабое биопленкообразование при ODnc<ODs≤2×ODnc; средняя степень биопленкообразования при 2×ODnc<ODs≤4×ODnc; сильно выраженное биопленкообразование при 4×ODnc<ODs [12].
Антибиопленочную активность бензидамина гидрохлорида тестировали в 96-луночных планшетах. Тест-культуры засевали в лунки планшета до конечной концентрации 104 КОЕ/мл в объеме 0,2 мл жидкой питательной среды Mueller Hinton Broth (HiMedia Laboratories, Индия). Для определения активности препарата против растущей биопленки бензидамин гидрохлорид вносили в концентрациях 5 мг/л, 10, 20, 40, 80, 160, 320, 640, 1280, 2560 и 5120 мг/л сразу после инокуляции культуры, а для зрелой биопленки – через 48 часов после инокуляции. Результаты оценивали через 24 часа после внесения бензидамина гидрохлорида. Для этого удаляли культуральную среду, дважды промывали лунки физраствором и окрашивали биопленки 0,1%-ным водным раствором кристалвиолета.
МПК бензидамина гидрохлорида для биопленок микроорганизмов на плотной питательной среде проводили методом апликаторов, согласно Е.В. Детушевой и соавт. (2015) [13].
Результаты
Анализ МПК бензидамина гидрохлорида показал, что планктонные культуры подавляющего большинства использованных коллекционных штаммов (n=23) чувствительны к этому препарату с МПК от <0,2 до 1280 мг/л (табл. 3).
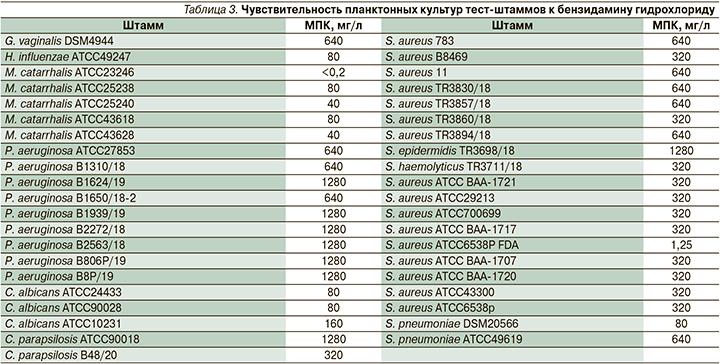
Госпитальные и коллекционные штаммы чувствительны к бензидамину, а поскольку концентрация действующего вещества в лекарственном средстве Тантум Верде, спрей, равна 1500 мг/л, эти данные могут быть экстраполированы на готовый лекарственный препарат (МПК в тестах до 1280 мг/л).
Степень биопленкообразования определена для 27 штаммов, в т.ч. M. catarrhalis (n=5), P. aeruginosa (n=8), S. aureus (n=8) и Candida spp. (n=5) (табл. 4).
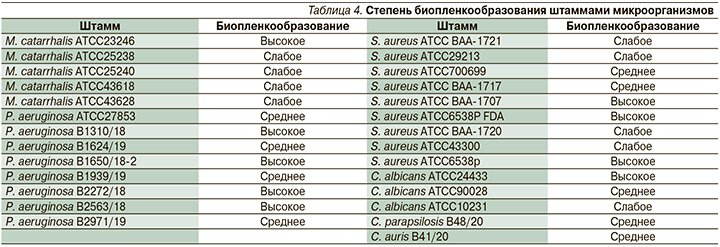
Способность к образованию биопленок использованными штаммами микроорганизмов варьировалась от слабой до высокой как среди коллекционных штаммов, так и среди штаммов, выделенных из госпитальной среды. Интересно, что доли штаммов с разной степенью биопленкообразования в данной коллекции были равны по 9 штаммов в категориях слабого, среднего и высокого биопленкообразования. Представители разных таксонов характеризовались также разнообразием по способности к биопленкообразованию, что выявлялось как разная степень окраски лунок планшета в тесте на биопленкообразование (рис. 2).

В ходе исследования отмечено, что при обработке формирующейся и зрелой биопленки всех использованных штаммов микроорганизмов бензидамином гидрохлоридом в концентрации 16–1280 мг/л происходило уменьшение плотности биопленок.
МПК бензидамина гидрохлорида для зрелых биопленок штаммов микроорганизмов определены методом аппликаторов на основании способности биопленок выживать и продолжать свой рост на поверхности плотной питательной среды, содержащей серийные разведения препарата (рис. 3).
В ходе исследования показано, что зрелые биопленки штаммов M. catarrhalis и C. albicans отличались большей чувствительностью к бензидамину гидрохлориду, чем зрелые биопленки S. aureus. Штаммы всех видов зрелые биопленки отнесены к категории чувствительных к данному препарату, поскольку значения МПК были ниже концентрации бензидамина гидро-хлорида в лекарственном средстве Тантум Верде, спрей, равной 1500 мг/л (табл. 5).

Обсуждение
Полученные данные свидетельствуют: способность бактерий и грибов образовывать биопленки снижает антимикробную активность препаратов. Тем не менее, результаты тестов показывают, что бензидамин гидрохлорид в терапевтических концентрациях до 1500 мкг/мл оказывает выраженное антимикробное действие в отношении как планктонных клеток, так и биопленок клинически значимых микроорганизмов.
Выводы
Бензидамина гидрохлорид проявляет антимикробное действие против планктонных клеток широкого спектра штаммов бактерий и грибов в известных терапевтических и клинически значимых концентрациях.
Бензидамина гидрохлорид в концентрациях ниже таковых в препарате Тантум® Верде, спрей, 0,15 и 0,3% предотвращает формирование биопленок на тест-штаммах P. aeruginosa, M. catarrhalis, H. influenzae, G. vaginalis, Staphylococcus spp., S. pneumoniae, Candida spp.
Источник финансирования. Проект при поддержке отраслевой программы Роспотребнадзора.



