Введение
Пандемия новой коронавирусной инфекции COVID-19, охватившая все континенты, сопровождается высокой заболеваемостью и смертностью независимо от применяемых эпидемиологических и терапевтических стратегий. Наиболее тяжелые клинические манифестации COVID-19 – острый респираторный дистресс-синдром (ОРДС) и системный воспалительный ответ (цитокиновый «шторм») – находятся в фокусе изучения всего медицинского сообщества. По мере обобщения мирового клинического опыта становится очевидной высокая частота встречаемости острой миокардиальной дисфункции у пациентов с COVID-19. Так, по данным F. Zhou et al., у пациентов, включенных в исследование по изучению причин и факторов риска смертельных исходов, более чем в половине случаев в группе летальных исходов отмечались клинические и инструментальные признаки поражения сердца, в группе выживших пациентов эта цифра составила 17% [1]. По сводным мировым данным, которые постоянно обновляются, клинические манифестации тех или иных поражений миокарда регистрируются у 7,2% всех наблюдаемых в стационарах пациентов, из них в 23% случаев развивается симптомная сердечная недостаточность [2].
Причиной острого повреждения сердца (acute cardiac injury) при COVID-19 в ранний период инфекции может служить непосредственная инвазия вируса в кардиомиоциты через АПФ2-рецепторный аппарат. В ответ на цитокиновый «шторм» формируется острая эндотелиальная микроваскулярная (в т.ч. коронарная) дисфункция, в рамках цитокин-опосредованного ДВС-синдрома возможно развитие коронаротромбоза. Нарастающий системный воспалительный ответ может приводить к формированию аутоиммунного поражения сердца [3]. Кроме того, на фоне вирусной инфекции, несомненно, происходит резкое обострение ранее сформированных заболеваний сердца (сердечно-сосудистая коморбидность).
В результате COVID-ассоциированные поражения миокарда могут протекать как инфаркты миокарда (ИМ) I и II типов, миокардиты и ИМ без обструктивного поражения коронарных артерий (ИМБОКА). Поражение миокарда, чем бы оно ни было обусловлено, существенно ухудшает течение основного заболевания и прогностически неблагоприятно. Ситуация усугубляется тем, что в условиях пандемии современные высокотехнологичные диагностические модальности, позволяющие четко дифференцировать типы ИМ, миокардиты и ИМБОКА по объективным причинам, малоприменимы. Коронароангиография (КАГ), магнитно-резонансная томография (МРТ) сердца с парамагнитным контрастированием, эндомиокардиальная биопсия (ЭМБ) осуществимы в единичных случаях и не могут рассматриваться как постоянно действующие диагностические инструменты в огромной популяции пациентов с COVID-19 [3, 4].
Среди многообразных клинических вариантов ИМБОКА особое место занимает стресс-индуцированная кардиомиопатия, или синдром Такоцубо (СТ). СТ представляет собой острую, как правило обратимую, миокардиальную дисфункцию, сопровождающуюся стремительным развитием клинико-инструментальной картины острого коронарного синдрома (ОКС) или острой сердечной недостаточности. Первое фундаментальное описание СТ было сделано H. Sato et al. Они же предложили эпонимическое название «изображение контура левого желудочка (ЛЖ) при СТ», полученное в ходе вентрикулографии, напоминает форму сосуда с узким горлышком и широким дном, который используют японские рыболовы для ловли осьминогов (такоцубо) [5]. Диагностические критерии СТ включают преходящую шарообразную дилатацию верхушки ЛЖ с гиперкинезом базальных сегментов (классический эхокардиографический – Эхо-КГ-паттерн), инфарктоподобные изменения электрокардиограммы (ЭКГ), повышение уровня маркеров повреждения миокарда, клинику ОКС или острой сердечной недостаточности и интактное коронарное русло по данным КАГ. В качестве триггера, запускающего каскад патологических реакций СТ, выступает физический (медицинский) или эмоциональный стресс [6–8]. Центральным звеном патогенеза СТ является избыточная секреция или экзогенное введение катехоламинов (КА). Избыток КА может вызывать стойкую генерализованную вазоконстрикцию, частным проявлением которой является тотальный спазм коронарного русла с развитием острой миокардиальной дисфункции. Современные представления о патогенезе СТ основаны на концепции катехоламинового «шторма» и его негативного влияния на сердечно-сосудистую систему конкретного пациента. Несмотря на то что в большинстве случаев СТ полностью обратим, госпитальная летальность от него колеблется от 1–2 до 2–5%. Основные причины летальных исходов – кардиогенный шок, фатальные желудочковые аритмии и разрыв свободной стенки ЛЖ [9]. Логично предположить, что СТ как частный случай острого повреждения сердца может встречаться в популяции пациентов, страдающих COVID-19. К настоящему времени существуют единичные описания данного феномена у пациентов с новой коронавирусной инфекцией [10–13].
Представляется случай из практики нефрологической клиники: клиническое наблюдение развития СТ у пациентки, находящейся на иммуносупрессивной терапии (ИСТ), в ранние сроки после аллотрансплантация трупной почки (АТТП).
Клиническое наблюдение
Пациентка С. 34 лет доставлена бригадой СМП в отделение патологии трансплантированной почки ГБУЗ «ГКБ № 52» ДЗМ с жалобами на одышку, слабость, непродуктивный кашель и повышение температуры до 38,5°С. В анамнезе: длительное время страдает терминальной почечной недостаточностью (ТПН) в исходе хронического гломерулонефрита, несколько лет находилась на программном гемодиализе (ПГД). В ноябре 2019 г. (за 4 месяца до поступления) – АТТП. Функция почечного трансплантата, отсроченная после выписки, – удовлетворительная (креатинин в пределах 120 мк моль/л). Получала ИСТ такролимусом, метилпреднизолом и микофенолатом. За 10 дней до поступления появились сухой кашель, умеренный субфебрилитет (до 37,5°С), слабость. Обратилась за медицинской помощью только спустя 10 дней от начала симптоматики, после чего была экстренно госпитализирована.
Состояние при поступлении тяжелое: одышка в покое до 24 в минуту, в легких масса рассеянных мелкопузырчатых хрипов, синусовая тахикардия – 100 в минуту. В отделении отмечалось прогрессирующее снижение SpO2 c 97 до 88%, несмотря на высокопоточную оксигенотерапию, антибактериальную и антикоагулянтную терапию. Проведена коррекция ИСТ.
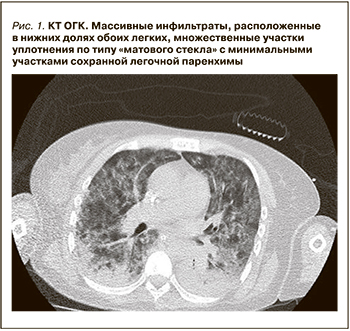 В анализах: умеренный лейкоцитоз (11×109 /л), С-реактивный белок – 116 мг/мл, креатинин – 140 мкмоль/л. По данным компьютерной томографии органов грудной клетки, картина массивного двустороннего поражения легких, типичная для тяжелого COVID-19 (рис. 1).
В анализах: умеренный лейкоцитоз (11×109 /л), С-реактивный белок – 116 мг/мл, креатинин – 140 мкмоль/л. По данным компьютерной томографии органов грудной клетки, картина массивного двустороннего поражения легких, типичная для тяжелого COVID-19 (рис. 1).
В связи с прогрессированием ОРДС и полиорганной недостаточности пациентка переведена в отделение реанимации и интенсивной терапии (ОРИТ) для больных нефрологического профиля. В ОРИТ пациентка была подключена к аппарату искусственной вентиляции легких, начата массивная патогенетическая и заместительная терапия, продолжена антибактериальная и антикоагулянтная терапия. С учетом нарастания полиорганной недостаточности и системного воспалительного ответа в комплекс лечебных мероприятий была включена продленная венозная гемодиафильтрация, вазопрессорная поддержка и введен тоцилизумаб. На этапных ЭКГ регистрировалась стойкая синусовая тахикардия без признаков повреждения миокарда (рис. 2А). По данным Эхо-КГ, проведенной при переводе в ОРИТ: систолическая функция левого желудочка (ЛЖ) удовлетворительная (фракция выброса – ФВ ЛЖ 65%), зон нарушения локальной сократимости не выявлено. Незначительная гипертрофия миокарда ЛЖ, незначительное расширение полости левого предсердия. Систолическая функция правого желудочка (ПЖ) незначительно снижена (TAPSE 1,6 см), правые отделы не расширены, признаков перегрузки ПЖ не выявлено. Клапанный аппарат без особенностей, митральная регургитация (МР) 1-й ст., трикуспидальная регургитация (ТР) 1-й ст. Признаки умеренной легочной гипертензии (ЛГ): систолическое давление в легочной артерии (СДЛА) – 40 мм рт.ст. Перикард умеренно уплотнен, жидкости в полости перикарда нет.
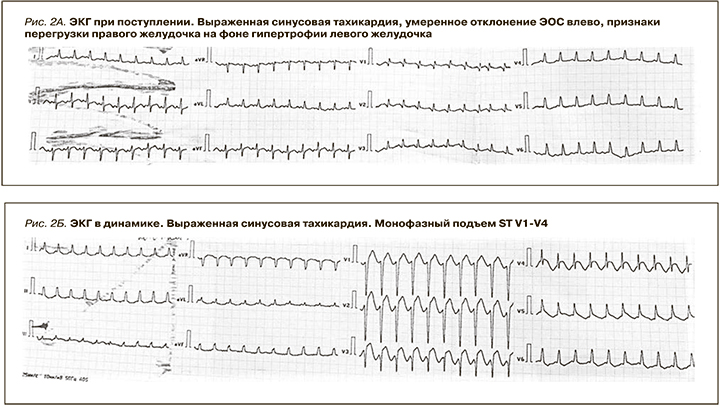
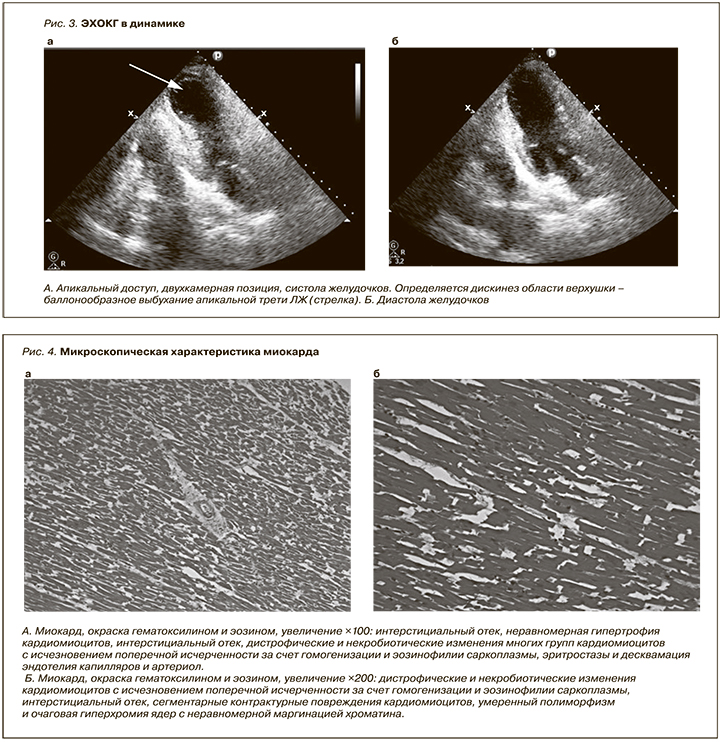
Несмотря на проведенную комплексную интенсивную терапию, состояние пациентки прогрессивно ухудшалось: нарастала гемодинамическая нестабильность, потребовавшая увеличения прессорной поддержки. Для исключения COVID-19-ассоциированного повреждения миокарда повторно проведены ЭКГ- и Эхо-КГ-исследования. По данным ЭКГ, картина острого трансмурального повреждения передней стенки ЛЖ (рис. 2Б). При сравнении данных Эхо-КГ – снижение систолической функции миокарда ЛЖ (ФВ ЛЖ – 45%) с нарушением локальной сократимости: дискинез апикальных и гипокинез средних сегментов всех стенок ЛЖ (циркулярно) (рис. 3 А, Б), гиперкинез базальных сегментов ЛЖ (циркулярно), данных за обструкцию выходного тракта ЛЖ не получено, МР 2-й ст. ТР – 2-й ст. Признаки умеренной ЛГ: СДЛА –45 мм рт.ст. Тропонин I – 100 нг/л (норма до 23 нг/л).
Принимая во внимание крайнюю тяжесть состояния пациентки, от проведения КАГ было решено воздержаться. В качестве рабочей диагностической концепции, объясняющей нарастание гемодинамической нестабильности, принята гипотеза стресс-индуцированной кардиомиопатии (СТ), осложнившей течение COVID-19. К терапии было добавлено линейное введение эсмолола, усилена антикоагулянтная терапия, однако, несмотря на весь комплекс реанимационных мероприятий, пациентка скончалась при нарастающих явлениях полиорганной недостаточности.
 По результатам аутопсии, диагноз новой коронавирусной инфекции, осложненной полиорганной недостаточностью и сепсисом у пациентки с ТПН и АТТП, был полностью подтвержден.
По результатам аутопсии, диагноз новой коронавирусной инфекции, осложненной полиорганной недостаточностью и сепсисом у пациентки с ТПН и АТТП, был полностью подтвержден.
Для уточнения генеза острого повреждения миокарда проведено углубленное исследование, включившее прицельное изучение коронарного русла и оценку микроскопических характеристик миокарда. Выявлены следующие результаты: коронарные сосуды полностью проходимы, спадаются на разрезе, интима ровная и гладкая. Гистологических данных за воспалительное и коронарогенное поражение кардиомиоцитов не получено (рис. 4 А,Б, рис. 5).
Таким образом, методом исключения атеросклеротического, воспалительного и тромботического генеза повреждения миокарда диагноз СТ был подтвержден.
Обсуждение
Частота встречаемости СТ в популяции пациентов, находящихся на заместительной почечной терапии, невелика. Описано несколько случаев развития СТ в ходе диализной сессии, в т.ч. и в нашей нефрологической клинике [14, 15]. По мере распространения пандемии COVID-19 растет число публикаций, касающихся описания разных клинических вариантов острого повреждения сердца [1–4]. К моменту написания данной статьи в периодической печати и на интернет-ресурсах представлены единичные случаи СТ на фоне новой коронавирусной инфекции. A.S. Minhas et al. обсуждают высокую вероятность развития СТ при тяжелом течении COVID-19. Те же авторы утверждают, что по состоянию на конец апреля 2020 г. ни одного случая СТ не было опубликовано [10].
Тем не менее внимания заслуживают сообщения, касающиеся развития типичной стресс-индуцированной кардиомиопатии как следствие эмоциональной реакции на пандемию в отсутствие у пациентов коронавирусной инфекции как таковой [16, 17]. В конце апреля и в начале мая опубликовано два случая СТ у пациентов с тяжелым течением COVID-19. Авторам удалось провести КАГ и ЭМБ для исключения других причин острого повреждения миокарда [12, 13].
В представленном случае клинико-инструментальные данные были достаточно типичными: прогрессирующая нестабильность гемодинамики, инфарктоподобные изменения ЭКГ, характерная Эхо-КГ-картина апикального баллонирования с циркулярным гиперкинезом базальных сегментов ЛЖ. Однако объективная невозможность проведения КАГ и ЭМБ оставляла определенные сомнения в точности сформулированного диагноза. В связи с этим результаты аутопсии и гистологического исследования миокарда позволили окончательно исключить другие причины острого повреждения сердца. Отсутствие воспалительной инфильтрации позволило с уверенностью отвергнуть диагноз миокардита. Отсутствие же признаков ишемического повреждения при сохраненной архитектонике сердечной мышцы исключило другие кардиомиопатии, в т.ч. ишемическую, в качестве возможных причин повреждения сердца.
С практической точки зрения важным представляется еще один аспект описанного наблюдения: каковы возможные триггеры развития СТ у молодой пациентки без сопутствовавшей кардиальной патологии, но с тяжелым течением коронавирусной инфекции на фоне ИСТ? Представляется весьма вероятным, что последнее обстоятельство внесло весомый вклад в неблагоприятное фульминантное течение COVID-19. Сочетание цитокинового и катехоламинового «штормов» повлекло за собой стремительное развитие микроваскулярной коронарной эндотелиальной дисфункции, которая реализовалась в развернутый СТ. В качестве дополнительных триггеров внимания заслуживают вазопрессорная поддержка (экзогенное поступление КА) и проведение заместительной почечной терапии.
Заключение
Согласно данным современных мировых публикаций, острое повреждение миокарда служит предиктором неблагоприятных исходов течения новой коронавирусной инфекции. Синдром Такоцубо – один из вариантов острого повреждения миокарда у пациентов с осложненным течением COVID-19. Коморбидность пациентов, находящихся на заместительной почечной терапии и иммуносупрессии, создает дополнительные риски развития ковид-ассоциированных кардиальных осложнений.



