Введение
Как известно, у больных ишемической болезнью сердца (ИБС) одним из часто выявляемых коморбидных заболеваний является хроническая обструктивная болезнь легких (ХОБЛ), частота которой при различных формах ИБС, в т.ч. у больных, подвергшихся коронарному шунтированию или чрескожным коронарным вмешательствам, составляет от 16 до 50% [1–4]. Коморбидность ХОБЛ и ИБС является важной медикосоциальной проблемой, характеризующейся достаточно широкой распространенностью этих заболеваний в общей популяции, высокой сердечной и общей смертностью и большими фармакоэкономическими затратами на лечение и реабилитацию этих больных [2, 5, 6].
Изучение кардиопульмональных взаимоотношений на основе общности патогенетических механизмов и факторов риска развития сердечной и легочной патологии, их взаимоотягощающее влияние на прогноз актуальны для выработки рациональной терапии с целью минимизации кардиореспираторных осложнений и смертности [2, 3, 7]. Результаты проведенных клинических исследований показали, что наличие сопутствующей ХОБЛ повышает риск развития ИБС в 2–3 раза, кардио-васкулярных осложнений – на 20% и сердечную смертность – на 28% [3, 4, 8].
В связи с этим представляются важными изучение факторов, способствующих обострению сочетанной ХОБЛ и ИБС, и оценка критериев тяжести ХОБЛ, влияющих на исходы острого коронарного синдрома (ОКС) [6, 9, 10]. Актуальность данной проблемы также обусловлена особенностями клинического течения ОКС (атипичные формы инфаркта миокарда, частое развитие острой сердечной недостаточности и нарушений сердечного ритма), нехарактерными электрокардиографическими изменениями и отсутствием в анамнезе ИБС у больных ХОБЛ [7, 8, 11]. Эти обстоятельства затягивают сроки проведения диагностических и неотложных терапевтических, включая интервенционные, мероприятий у больных, госпитализированных по поводу ОКС [10, 12, 13].
Поэтому большое значение имеет исследование маркеров повреждения миокарда, в частности тропонинов, как высокоинформативный лабораторный тест ранней диагностики острого инфаркта миокарда (ИМ) [14, 15]. В современных рекомендациях по диагностике и лечению ОКС независимо от наличия стойкого подъема сегмента ST определение тропонинов в крови предлагается как рутинный метод [12, 14].
Необходимо отметить, что в современных рекомендациях Глобальной инициативы по ХОБЛ (GOLD, 2017) принята доктрина, основанная на интегральной оценке тяжести ХОБЛ при определении силы ее воздействия на конкретного пациента, которая включает оценку симптомов, спирометрической классификации и риска развития обострений [1, 2]. У больных ОКС и/или острым ИМ, страдающих сопутствующей ХОБЛ, в основном изучались особенности клинического течения коронарной недостаточности и частота развития острых сердечно-сосудистых осложнений в зависимости от нарушений спирометрических показателей [7, 11]. Однако комплексная оценка детерминант тяжести ХОБЛ, потенциально способных влиять на исходы ОКС, т.е. на развитие острого ИМ, проводилась недостаточно.
Цель исследования: оценить влияния тяжести клинического течения ХОБЛ и нарушений вентиляционной функции на исходы ОКС, а также определение их корреляции с уровнем тропонина Т (ТнТ) в крови.
Методы
В открытое сравнительное одномоментное по дизайну исследование включили 54 больных (29 мужчин и 25 женщин) в возрасте от 49 до 72 лет (средний возраст – 65,2±7,3 года), госпитализированных по поводу ОКС в специализированное кардиологическое отделение Пензенской городской клинической больницы № 6 им. Г.А. Захарьина. Все больные страдали установленной ХОБЛ в анамнезе.
Из них у 21 (38,9%) больного выявлен подъем сегмента ST и у 33 (61,1%) – отсутствие стойкого подъема сегмента ST (χ2=6,51; p=0,011). С учетом повторных исследований электрокардиограммы (ЭКГ) и ТнТ в крови больных по исходам ОКС разделили на 2 группы: 1-я группа – 30 (55,6%) больных острым ИМ, и 2-я – 24 (44,4%) с нестабильной прогрессирующей стенокардией. При этом у 18 (60,0%) больных развился «Q-позитивный» ИМ и у 12 (40,0%) – «Q-негативный» ИМ.
Протокол исследования одобрен Локальным этическим комитетом. Все больные подписали информированное согласие на участие в исследовании. Критерием включения стало наличие ОКС с подъемом сегмента ST или без него у больных, имевших ИБС и ХОБЛ в анамнезе. Критерии исключения: бронхиальная астма; интерстициальные заболевания легких; идиопатическая легочная гипертензия; торакотомия с резекцией легкого в анамнезе; опухоли легких; легочная тромбоэмболическая болезнь; острая декомпенсация хронической сердечной недостаточности (ХСН); хроническая почечная недостаточность.
Сравнение клинико-анамнестических данных показало, что в 1-й группе длительность кашля и курения достоверно меньше, чем во 2-й: в среднем на 39,5 (p=0,003) и 26,6% (p=0,015) соответственно (табл. 1). Гендерного различия между группами не выявлено (p>0,05). Число больных, продолжающих курить, составило 33,3–37,5%, что в 1,5–2 раза меньше числа больных, бросивших курить (p<0,001). Кроме того, больные 2-й группы имели более длительный стаж курения, чем в 1-й (p=0,032).
Также показано, что выявляемость факторов риска и коморбидных состояний (ожирения, ИМ в анамнезе, артериальной гипертензии, сахарного диабета 2 типа, ХСН и различных форм фибрилляции предсердий) в группах отмечается недостоверно (p>0,05). Согласно рекомендациям GOLD (2017), из 54 больных у 4 (7,4%) выявлена I стадия ХОБЛ, у 27 (50,0%) – II, у 21 (38,9%) – III и у 2 (3,7%) больных – IV стадия. В 1-й группе преобладали больные ХОБЛ I стадии, во 2-й – III–IV стадий заболевания.
Для определения степени ограничения скорости воздушного потока проводили спирометрию на аппарате Spirolab-II (фирмы «MIR», Италия) с использованием бронходилатационного теста с сальбутамолом в дозе 400 мкг [3].
Вычисляли должные величины следующих показателей: форсированная жизненная емкость легких (ФЖЕЛ); объем форсированного выдоха за 1-ю секунду (ОФВ1); индекс Тиффно – процентное соотношение ОФВ1 к ФЖЕЛ. ХОБЛ диагностировали в соответствии с критериями GOLD, согласно которым постбронходилатационное значение индекса Тиффно должно быть менее 0,70, при этом степень тяжести (стадия) заболевания определяется, исходя из значения ОФВ1 [1, 2]. Для диагностики дыхательной недостаточности определяли степень насыщения гемоглобина кислородом – сатурацию кислорода (SpO2).
Влияние тяжести клинических симптомов ХОБЛ на состояние здоровья больного, в т.ч. на исходы ОКС, исследовали с помощью CAT-теста (COPD Assessment Test), являющегося пациент-ориентированным вопросником [1, 2]. При этом сумма баллов 10 и более свидетельствует о высокой степени бронхообструкции и значительном ухудшении состояния здоровья. Для интегральной оценки влияния ХОБЛ на конкретного больного, которая включает оценку симптомов, спирометрической классификации и риска развития обострений, используют группы риска А, В, С и D [1, 2]. В нашем исследовании из 54 больных у 31 (57,4%) верифицировали риск В («низкий риск», «больше симптомов»), у 16 (29,6%) – риск С («высокий риск», «меньше симптомов») и у 7 (13,0%) – риск D («высокий риск», «больше симптомов»).
Содержание ТнТ в крови определяли с помощью тест-системы ElecsysRTroponinT Stat на автоматическом анализаторе «Elecsys 2010» (Roche Diagnostics GmbH, Германия). Диагностическим критерием острого ИМ считается уровень ТнТ, в 3 раза превышающий верхний референтный уровень, т.е. 0,3 нг/мл и выше [14].
В отсутствие положительного тропонин-теста через 3–8 часов от начала болевого приступа содержание ТнТ повторно определяли в течение 3 суток. При необходимости для верификации диагноза больным проводили различные методы лучевой диагностики: рентгенографию органов грудной клетки, компьютерную томографию и коронароангиографию.
Статистический анализ проводили с помощью программы Statistica 8.0 for Windows. Нормальность распределения переменных оценивали с помощью критерия Шапиро–Уилка. Для определения центральной тенденции и разброса непрерывных переменных при распределении, близком к нормальному, вычисляли среднюю арифметическую (M) и стандартное отклонение (SD). Достоверность различия средних величин в двух группах определяли с помощью параметрических или непараметрических методов в зависимости от нормальности распределения переменных, при сравнении более чем двух групп использовали критерий Крускала–Уоллиса. Для сравнения долей применяли точный критерий Фишера и χ2-критерий Пирсона. С целью изучения корреляции использовали метод ранговой корреляции Спирмена. Различия считали статистически значимыми при р<0,05.
Результаты
Необходимо отметить, что из 54 больных у 33 (61,1%), согласно критериям GOLD, при госпитализации диагностировалось обострение ХОБЛ, в т.ч. в 1-й группе у 24 (80,0%), во 2-й – у 9 (41,7%) больных (χ2=6,93; p=0,009). Кроме того, обострение ХОБЛ при госпитализации выявлено у 20 (74,1%) больных со II стадией и у 13 (61,9%) – с III (p>0,05).
Как правило, коморбидная патология характеризуется взаимно отягощающим влиянием на течение и прогноз каждого из этих заболеваний. Так, в 1-й группе обострение течения ИБС в период, непосредственно предшествовавший госпитализации, отмечено у 25 (83,3%) больных, в т.ч. у 21 (87,5%) – при обострении ХОБЛ. Это означает, что во 2-й группе сочетанное обострение ИБС в виде нестабильной прогрессирующей стенокардии и ХОБЛ наблюдалось в 2 раза реже, чем у больных 1-й группы: 41,7 против 87,5% (χ2=5,70; p=0,017).
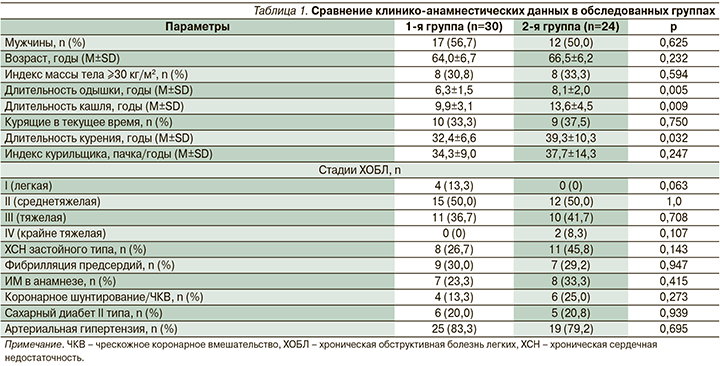
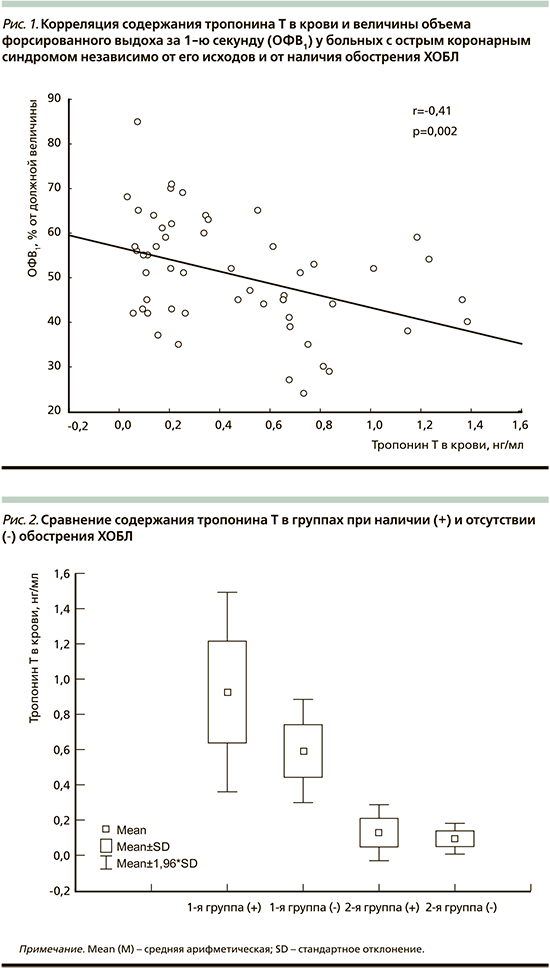
Изучение взаимосвязей степени ограничения скорости воздушного потока – величины ОФВ1, и содержания ТнТ в крови больных ОКС выявило наличие обратной корреляции (рис. 1: r=-0,41; p=0,002). Также выявлено, что независимо от исходов ОКС при наличии обострения ХОБЛ содержание ТнТ в крови достоверно выше, чем в его отсутствие: 0,730±0,381 и 0,441±0,319 нг/мл (p=0,012). В 1-й группе содержание ТнТ в крови у больных с обострением ХОБЛ оказалось достоверно выше (рис. 2), чем в его отсутствие (0,927±0,289 и 0,592±0,149 нг/мл соответственно; p=0,005), хотя во 2-й группе различие было недостоверным (0,128±0,081 и 0,093±0,044 нг/мл; p>0,05). Кроме того, у больных с обострением ХОБЛ содержание ТнТ в крови в 1-й группе было достоверно выше, чем во 2-й (p<0,001).
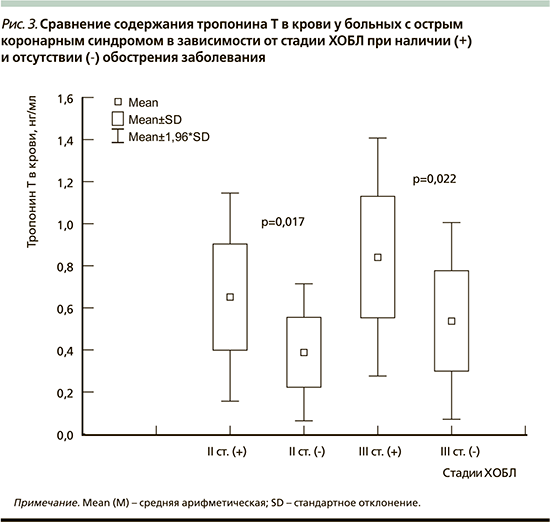
Также выявлено различие содержания ТнТ в крови больных, госпитализированных по поводу ОКС, в зависимости от тяжести (стадии) сопутствовавшей ХОБЛ. Так, независимо от исходов ОКС при III стадии ХОБЛ содержание ТнТ (0,805±0,298 нг/мл) было достоверно выше, чем при I и II стадиях: 0,273±0,128 (p=0,002) и 0,538±0,273 нг/мл (p=0,005) соответственно. Выявлено, что при II и III стадиях ХОБЛ обострение заболевания ассоциируется с высоким содержанием ТнТ в крови по сравнению с отсутствием обострения (рис. 3).
При оценке влияния тяжести клинических симптомов ХОБЛ на исходы ОКС выявлено, что у больных с обострением ХОБЛ суммарная величина CAT-теста по сравнению с его отсутствием была выше как в 1-й группе (33,8±5,1 и 25,5±6,7 соответственно; p=0,002), так и во 2-й (27,9±3,0 и 19,7±3,7 соответственно; p<0,001). Кроме того, в 1-й группе по сравнению со 2-й суммарная величина CAT-теста при обострении ХОБЛ была выше в среднем на 21,1% (p=0,003), а в его отсутствие − на 43,3% (p=0,02). Также выявлена прямая корреляция (r=0,42; p=0,003) показателей CAT-теста и содержания ТнТ в крови.
Выявлено, что показатели ФЖЕЛ, ОФВ1 и индекса Тиффно при наличии обострения ХОБЛ достоверно ниже, чем в его отсутствие (табл. 2): в 1-й группе в среднем на 13,0% (p=0,011); 24,8% (p=0,003) и 14,3% (p=0,006) соответственно, во 2-й – на 7,3% (p=0,031); 16,1% (p=0,015) и 9,0% (p=0,038) соответственно. Сатурация кислорода только у больных 1-й группы при обострении ХОБЛ была ниже (p=0,026), чем в его отсутствие. Также при обострении ХОБЛ показатели ОФВ1 и индекса Тиффно в 1-й группе оказались достоверно ниже, чем у аналогичных больных 2-й группы: в среднем на 17,7 (p=0,028) и 12,6% (p=0,01) соответственно.
Следует отметить, что развитие острого ИМ часто ассоциировалось с высокой степенью риска обострения и неблагоприятных событий ХОБЛ. Так, острый ИМ в группах риска С (χ2=5,56; p=0,018) и D (χ2=5,06; p=0,025) диагностировался почти в 2 раза чаще, чем в группе риска В. При этом «Q-позитивный» ИМ в группе риска В выявлялся в 19,4% случаев, в группе риска С – в 50,0% и в группе риска D – в 57,1% случаев. Кроме того, при наличии обострения ХОБЛ различие между 1-й и 2-й группами по степеням риска оказалось недостоверным (p>0,05). Риск D выявлялся только при наличии обострения ХОБЛ: в 1-й группе – в 20,8% случаев, во 2-й – в 22,2%. В отсутствие обострения ХОБЛ 2-я группа была представлена только больными с низким риском (риск В).
С учетом степени риска обострений и неблагоприятных событий ХОБЛ выявлено различие частоты кардиоваскулярных осложнений (табл. 3).
В частности, фибрилляция предсердий и ХСН по сравнению с группой риска В наиболее часто встречалась в группах риска С и D. Кроме того, содержание ТнТ в крови больных с высоким риском обострения ХОБЛ (риск C и D) достоверно (p<0,001) превышало таковое у больных с низким риском (риск В). Показано, что при высокой степени риска (риск С и D) показатели ФЖЕЛ, ОФВ1 и индекс Тиффно достоверно ниже, чем у больных с риском В. Также у лиц с риском D показатели спирометрии и сатурации кислорода оказались достоверно (p<0,05) ниже по сравнению с группой риска С.
Таким образом, стратификация групп риска неблагоприятных событий ХОБЛ, ассоциирующаяся с наличием частых обострений, играет ключевую роль при интегральной оценке влияния ХОБЛ на прогноз сопутствующих заболеваний. Наличие обострения сопутствующей ХОБЛ при госпитализации больных ОКС определяет высокую вероятность развития острого ИМ, в т.ч. «Q-позитивного», что повышает риск развития кардиоваскулярных осложнений и смертности.
Обсуждение
Результаты проведенного исследования подтвердили, что важнейшим фактором прогрессирующего снижения скорости воздушного потока и наступления тяжелой и крайне тяжелой стадий ХОБЛ, способствующих нестабильности течения ИБС и развитию ОКС, являются обострения ХОБЛ. Также показано, что наличие обострения ХОБЛ в момент госпитализации больных острым ИМ (1-я группа) выявляется достоверно чаще, чем в группе больных нестабильной прогрессирующей стенокардией (2-я группа): 80,0 против 41,7% (p=0,009). По данным M. Agarwal et al. [6], обострение ХОБЛ связано более чем с двукратным увеличением риска развития ИМ в первые 5 дней после обострения.
Установлено, что сочетание ХОБЛ и ишемических изменений на ЭКГ ассоциируется с высоким риском смерти по сравнению с нормальной функцией легких и без ишемических изменений на ЭКГ [8, 12]. При комплексной оценке детерминант тяжести ХОБЛ и их влияния на исходы ОКС нами выявлено наличие обратной корреляции содержания ТнТ в крови и спирометрических показателей в группе больных как острым ИМ, так и нестабильной стенокардией. Кроме того, в группе больных острым ИМ содержание ТнТ при наличии обострения ХОБЛ достоверно выше, чем в его отсутствие.
Также необходимо отметить взаимное отягощающее влияние ИБС на течение сопутствующей ХОБЛ. Показано, что прогрессирование стенокардии в период, предшествующий госпитализации больных, в свою очередь провоцирует ухудшение спирометрических показателей и тем самым обусловливает обострение ХОБЛ. Так, в группе больных острым ИМ сочетание обострения ИБС в виде нестабильной прогрессирующей стенокардии и ХОБЛ наблюдается в 2 раза чаще, чем у больных без развития ИМ: 87,5 против 41,7% (p=0,017).
Необходимо отметить, что мнения специалистов о прогностической ценности выраженности нарушений спирометрических показателей у больных ХОБЛ расходятся. Так, одни авторы считают, что у больных острым ИМ в сочетании с ХОБЛ выраженность нарушений спирометрических показателей коррелирует с неблагоприятным прогнозом [9, 11], другие отмечают, что при одинаковых по выраженноcти нарушениях спирометрических показателей прогноз ХОБЛ и сопутствующих заболеваний существенно различается [16, 17]. В связи с этим важно изучение корреляции ограничения скорости воздушного потока и содержания ТнТ в крови. Нами показано, что у больных с обострением ХОБЛ показатели ФЖЕЛ, ОФВ1 и индекс Тиффно уступают таковым в отсутствие обострения ХОБЛ как у больных острым ИМ, так и без него. Также выявлена обратная корреляция показателя ОФВ1 и содержания ТнТ в крови у больных как острым ИМ, так и нестабильной стенокардией [18–20].
Выявлено, что интегральная оценка тяжести сопутствующей ХОБЛ на основе верификации фенотипа заболевания, характеризующегося частыми обострениями и высоким риском неблагоприятных событий ХОБЛ, позволяет с высокой вероятностью предсказывать развитие ИМ и его осложнений [8, 10, 19]. Так, «Q-позитивный» ИМ в группах высокого риска (степени C и D) неблагоприятных событий при ХОБЛ диагностировался в 2–3 раза чаще, чем в группе низкого риска (степень В). Показано, что обострение ХОБЛ, особенно при II–III стадиях заболевания, является важным фактором прогрессирования/нестабильности ИБС и развития острого ИМ.
Заключение
Таким образом, выявлена корреляция критериев тяжести сопутствующей ХОБЛ и содержания ТнТ в крови больных, госпитализированных по поводу ОКС, в т.ч. в отсутствие признаков обострения ХОБЛ. Кроме того, у больных с развитием острого ИМ в сочетании с обострением ХОБЛ уровни ТнТ оказываются наивысшими по сравнению с отсутствием ИМ и/или обострения ХОБЛ. Наличие корреляции критериев тяжести ХОБЛ и уровня ТнТ, особеннос учетом атипичной клинической картины ОКС, в большинстве случаев позволяет своевременно проводить терапевтические и интервенционные вмешательства. Выявленная связь между степенью риска неблагоприятных событий ХОБЛ и биомаркером повреждения миокарда позволяет принимать превентивные меры, направленные на предупреждение развития острого ИМ в период обострения сопутствующей ХОБЛ. В свою очередь повышение уровня ТнТ у больных со стабильным течением ИБС может свидетельствовать о тяжести и обострении сопутствующей ХОБЛ, доказательство которого требует проведения дальнейших клинических исследований.
Вклад авторов. Б.Г. Искендеров – концепция и дизайн исследования. Н.В. Беренштейн, Т.В. Лохина – сбор и обработка материала. Т.В. Лохина – статистическая обработка данных. И.Н. Можжухина – написание текста. Б.Г. Искендеров – редактирование.



