Введение
Ревматоидный артрит (РА) – хроническое воспалительное аутоиммунное заболевание, которое не только приводит к необратимым повреждениям и деформациям суставов, но и сопровождается повышенным риском смертности от сердечно-сосудистых заболеваний [1]. Одной из основных причин этого могут быть метаболические и сосудистые эффекты системного воспаления, что приводит к раннему ускоренному развитию атеросклеротического процесса и его осложнений – инфаркта миокарда и инсульта. Несмотря на значительное расширение терапевтического арсенала при лечении РА за счет генно-инженерных биологических препаратов, по-прежнему широко используются пероральные глюкокортикоиды (ГК), которые даже при использовании в низких дозах могут неблагоприятно влиять на сердечно-сосудистую систему [2]. Еще одной причиной, приводящей к повышению риска смерти при РА, может служить саркопения (СП), которую в настоящее время рассматривают не только как гериатрический синдром, но и как осложнение или коморбидное состояние при РА.
В этом случае СП вторична, развиваясь на фоне хронического воспалительного процесса, ограничения физической активности и применения ГК. СП ассоциируется не только с локомоторными нарушениями, повышением риска падений и переломов [3], но и с метаболическими нарушениями, инсулинорезистентностью и артериальной гипертензией [4, 5], что также повышает риск смертности от сердечно-сосудистых заболеваний. Так, была показана связь между СП и эндотелиальной дисфункцией, ставшей показателем повышенного кардиоваскулярного риска [6]. Изучение состава тела с помощью инструментальных методов, таких как биоимпедансный анализ или двухэнергетическая рентгеновская абсорбциометрия (dual-energy X-ray absorptiometry – DXA), позволяет выявлять патологические фенотипы, связанные с внутренним ожирением и СП, у лиц с нормальной массой тела в случаях, когда оценка индекса массы тела (ИМТ) не дает основания заподозрить наличие ожирения.
Цель нашего исследования: изучение частоты патологических фенотипов состава тела (ожирение, СП и саркопеническое ожирение) у женщин с РА.
Методы
Дизайн и объект исследования
В одномоментное исследование включена 91 женщина с РА из числа пациентов, находившихся на стационарном или амбулаторном лечении в ФГБНУ НИИР им. В.А. Насоновой в 2019 г. Диагноз РА был установлен согласно критериям ACR/EULAR 2010 [7]. Критерии включения: возраст (40–75 лет), I–II функциональные классы заболевания и отсутствие асептических некрозов костей. Критерии невключения: отказ пациента от участия в исследовании; тяжелая сопутствующая патология; наличие злокачественных опухолей, психических заболеваний и когнитивных нарушений. Набор материала осуществлялся в рамках научной темы № НИОКТР АААА-А19-119021190150-6 «Разработка методов комплексной терапии заболеваний костно-мышечной системы». Проведение исследования было одобрено Этическим комитетом ФГБНУ НИИР им. В.А. Насоновой, все пациентки подписали информированное согласие.
Методы исследования
Женщины были опрошены с использованием оригинальной унифицированной анкеты, в которую включены социально-демографические данные, сведения о гинекологическом статусе, сопутствующих заболеваниях и проводимой терапии, вредных привычках, потреблении кальция с пищей, лечении основного заболевания. Выраженность функциональных нарушений оценена по индексу нарушения жизнедеятельности (Disability Index) 2-страничного варианта Анкеты оценки здоровья (Health Assessment Questionnaire, HAQ) [8].
Воспалительная активность РА оценивалась по индексу DAS-28 (Disease Activity Score) c включением в формулу расчета величины скорости оседания эритроцитов (СОЭ): высокая активность – при DAS-28 >5,1, умеренная – при 3,1 ≤DAS-28 ≤5,1; низкая – при 2,6 <DAS-28 <3,1, ремиссия при DAS-28 <2,6 [7].
ИМТ рассчитывался как отношение массы тела к квадрату роста (кг/м2).
В соответствии с критериями Всемирной организации здравоохранения (ВОЗ) ИМТ ранжировался как недостаточный (<18,5 кг/м2), нормальный (18,5–24,9 кг/м2), избыточный (25–29,9 кг/м2) и соответствующий ожирению (≥30 кг/м2) [9].
Состав тела оценивался c использованием DXA (Discovery A, Hologic, USA). Определялись жировая (ЖМ) и мышечная масса (ММ) всего тела и отдельных анатомических областей. Под аппендикулярной понимали суммарную ЖМ или ММ верхних и нижних конечностей (АЖМ, АММ). Индекс распределения ЖМ (ИРЖМ) рассчитывался по отношению ЖМ туловища к АЖМ. Значение ИРЖМ >1 указывало на преобладание ЖМ туловища над АЖМ. Аппендикулярный мышечный индекс (АМИ, кг/м2) определялся как отношение АММ к квадрату роста человека. При значении АМИ меньше 6 кг/м2 констатировалось снижение ММ, расцениваемое как СП в соответствии с критериями Европейской рабочей группы по изучению саркопении у пожилых людей (Group for the European Working Group on Sarcopenia in Older People, EWGSOP2, 2018) [10]. Критерием ожирения по данным DXA служил показатель общего содержания ЖМ >35% [11]. Также при DXA оценивалась минеральная плотность кости (МПК) в поясничном отделе позвоночника (L1–L4), шейке (ШБ) и в проксимальном отделе бедра (ПОБ).
По результатам оценки состава тела для выявления возможных ассоциаций с факторами, связанными с заболеванием, пациентки были разделены на 2 группы – с СП и без СП (СП+ и СП-), и 4 подгруппы: 1 – без СП и ожирения; 2 – ожирение без СП; 3 – СП без ожирения и 4 – саркопеническое ожирение. Для оценки эффекта влияния ГК на состав тела было выделено две группы: первая включила 55 женщин, принимавших пероральные ГК более 3 месяцев на момент исследования, и тех, кто раньше длительно принимал ГК, но прекратил их прием к моменту осмотра (ГК+); вторая группа состояла из 36 пациенток, никогда не лечившихся пероральными ГК (ГК-). Кумулятивная доза ГК рассчитывалась индивидуально для каждой пациентки по анамнезу и данным медицинской документации.
Статистический анализ
Все количественные данные были проанализированы на соответствие распределению значений изучаемого признака закону нормального распределения с использованием критерия Колмогорова–Смирнова в модификации Лиллиефорса (Lilliefors). В зависимости от полученного результата данные представлены как среднее арифметическое (М)±стандартное отклонение (СО) или медиана и интерквартильный размах (Ме [25; 75 перцентиль]). Сравнение количественных показателей проводилось с использованием U-критерия Манна–Уитни (Mann–Whitney U-test) для двух независимых групп и методов Ньюмена–Кейлса (Newman–Keuls) и Краскела–Уоллиса (Kruskal-Wallis) для нескольких групп. Для сравнения качественных показателей применялся метод χ-квадрата. Корреляционный анализ проводился по методу Спирмена (Spearman). Статистически значимыми считались различия при р<0,05. Использовался пакет программ STATISTICA for Windows версия 10.0 (StatSoft Inc., USA).
Результаты
Характеристика группы, отражающая демографические данные, активность и терапию РА, представлена в табл. 1. Хотя средний возраст пациенток составил около 63 лет, однако 28 (30,8%) женщин были моложе 60 лет и относились к средневозрастной категории лиц. Лишь у 12% пациенток показатель DAS-28 находился на уровне ремиссии или низкой активности заболевания. Большинство (53%) женщин имели DAS-28, свидетельствовавший об умеренной воспалительной активности, у 35% пациенток DAS-28 был больше 5,1 балла, что указывало на высокую активность болезни.
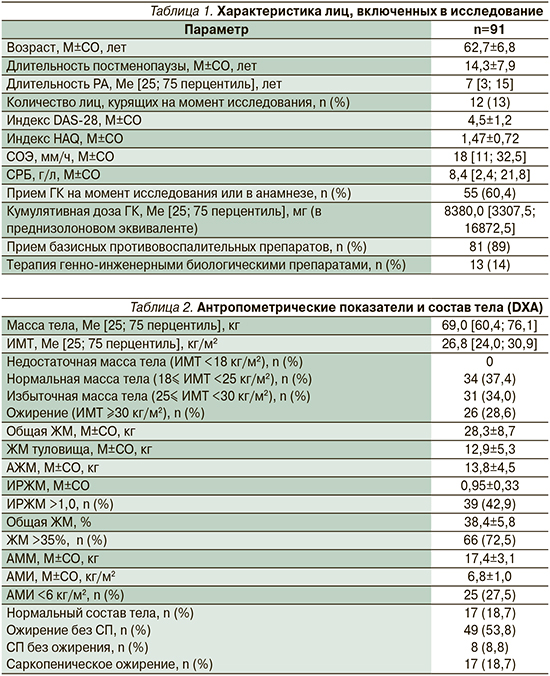
Мы обнаружили, что у 72,5% обследованных имелось высокое общее содержание ЖМ, соответствовавшее критериям ожирения по DXA, при том что ожирение по ИМТ выявлено только у 28,6% женщин (табл. 2).
Пациентки СП+ имели значимо большую длительность заболевания в отсутствие различий по возрасту. Для них характерными были более низкие показатели ИМТ, при этом доля лиц с нормальным ИМТ была выше, доля лиц с ИМТ ≥30 кг/м2 – ниже, чем у женщин с нормальной АММ (табл. 3).
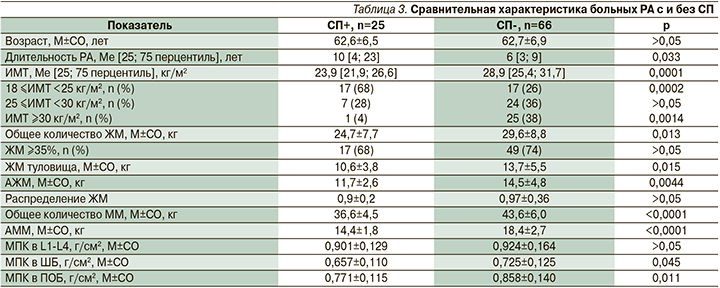
Анализ четырех подгрупп (табл. 4) показал, что наибольшая длительность РА была у женщин с саркопеническим ожирением, они значимо отличались по этому показателю от всех остальных пациенток (р=0,012; р=0,025 и р=0,008 для 1-й, 2-й и 3-й подгрупп соответственно). Также были выявлены различия по индексу DAS-28 между пациентками с саркопеническим ожирением и с нормальным составом тела (р=0,04).
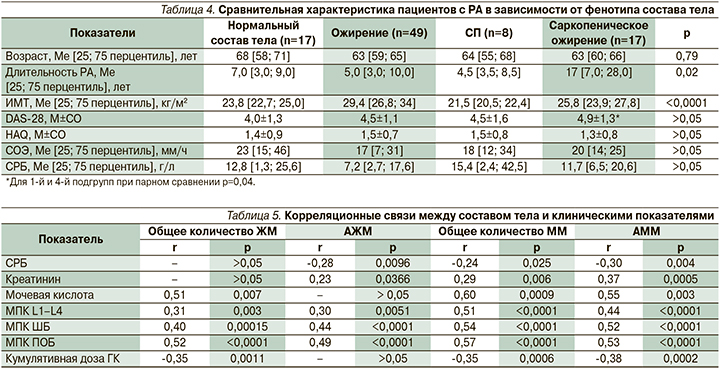
Далее мы провели корреляционный анализ для выявления возможных ассоциаций между компонентами состава тела больных РА и различными клиническими показателями (представлены только корреляции с величиной р<0,05; табл. 5).
Нами обнаружена обратная корреляция между величиной С-реактивного белка (СРБ), АЖМ, общей ММ и АММ. С другими показателями активности заболевания (DAS-28, СОЭ) корреляционных связей не выявлено. Уровень креатинина прямо коррелировал с АЖМ, общей ММ и АММ. Концентрация мочевой кислоты и величина МПК во всех областях измерения позитивно коррелировали как с ММ, так и с ЖМ.
Затем нами была оценена связь между приемом ГК и фенотипами состава тела (табл. 6).
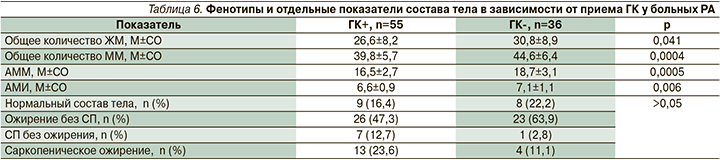
У пациенток, принимавших ГК, общее количество ЖМ и ММ, а также АММ и АМИ были значимо меньше по сравнению с женщинами, никогда не применявшими пероральные ГК. При этом ожирение по DXA встречалось с одинаковой частотой в обеих группах, а СП в группе ГК+ наблюдалось значимо чаще, чем в группе ГК- (р=0,02). Общее количество ЖМ, ММ и АММ негативно коррелировали с кумулятивной дозой ГК (табл. 5).
Обсуждение
В ходе нашего исследования обнаружено, что для женщин с РА 1–2 функциональных классов, имевших СП, характерна бόльшая длительность заболевания по сравнению с лицами с нормальной ММ в отсутствие разницы в возрасте. Для них характерно несоответствие частоты ожирения, определяемого по ИМТ и по DXA. Саркопенические фенотипы превалировали в группе пациенток, принимавших пероральные ГК. Установлены обратные корреляции между ЖМ, ММ и уровнем СРБ, кумулятивной дозой ГК, позитивные – с содержанием креатинина, мочевой кислоты в сыворотке крови, МПК позвоночника и бедра.
Отмечается большой разброс результатов в работах, посвященных проблемам СП, ожирения и состава тела у больных РА. Так, по нашим данным, женщины с СП значимо отличались по длительности заболевания от лиц с нормальной АММ. В то же время в одном из первых исследований, в котором изучался состав тела у женщин с ранним РА с длительностью заболевания до года, уже было выявлено снижение АММ, повышение общей ЖМ и ЖМ туловища [12].
Несоответствие частоты выявления ожирения при физикальном и инструментальном обследованиях, обнаруженное нами, показано и другими исследователями. Так, в исследовании бразильских авторов, включавшем 82 пациентки с РА, ожирение по стандартным пороговым значениям ИМТ ≥30 кг/м2 выявлено у 31,7% женщин. При этом по критериям DXA ожирение имело место у 59,8% обследованных. Стандартное пороговое значение ИМТ ≥30 кг/м2 для диагностики ожирения у больных РА продемонстрировало низкую чувствительность (37%) и умеренную специфичность (76%). При этом в случае выбора в качестве «точки отсечения» ИМТ ≥25 кг/м2 ожирение диагностировалось с чувствительностью 80% и специфичностью 60% при использовании DXA в качестве «золотого» стандарта [13].
В другом исследовании были изучены значения ИМТ и данные DXA у 101 пациентки с РА, при этом в качестве критериев ожирения были выбраны показатели DXA общей ЖМ >35%. Было установлено, что для диагностики ожирения по критерию DXA >35% общей ЖМ значения ИМТ ≥24 кг/м2 обладали чувствительностью 90% и специфичностью 75%. Авторами сделан вывод, согласно которому стандартное пороговое значение для ожирения (ИМТ ≥30) не является валидным предиктором повышенной ЖМ у пациентов с РА [14].
В исследовании A.C. Elkan et al. сос-тав тела пациентов изучался с использованием DXA, у 26% женщин (средний возраст – 61 год) выявлена СП. При этом данные, полученные с помощью краткого нутриционного опросника (Mini Nutritional Assessment – MNA), и показатели ИМТ не позволяли предположить это состояние [15].
Нами не выявлено разницы между пациентками с СП и без нее по показателям активности заболевания, но установлена значимая негативная корреляционная связь между АЖМ, АММ и уровнем СРБ. В других работах были получены разнонаправленные результаты.
В исследовании вьетнамских авторов, включившем 105 женщин с ранним РА, обнаружены положительная корреляция между общей ЖМ, ИРЖМ и DAS-28, обратная связь между АММ и HAQ, ассоциации между патологическими фенотипами и индексами HAQ и DAS-28, а терапия ГК не влияла на показатели состава тела [16].
В работе румынских авторов у женщин с высокой активностью заболевания, принимавших ГК, определялось большее количество общей ЖМ и ЖМ туловища. Лечение ГК, длительность и тяжесть заболевания положительно коррелировали с общей ЖМ [17].
M.D. George et al. выявили, что у женщин с РА ожирение по DXA ассоциировалось с уровнем СРБ в большей степени, чем с СОЭ. Однако эта ассоциация была связана с ожирением, а не с активностью заболевания [18]. Многие авторы не находили связи между длительностью заболевания, индексом DAS-28, использованием ГК и СП [19–21].
Наиболее тяжелый фенотип – саркопеническое ожирение – в нашей группе составил 18,7%, в другом исследовании российских авторов саркопеническое и остеосаркопеническое ожирение встречалось лишь у 8,2% пациентов с РА [22], в более ранней работе, представленной M.J. Santos et al., частота саркопенического ожирения составила всего 5,6%, при этом данные о связи между кумулятивной дозой ГК и количеством ЖМ совпали с нашими [23].
Вопросы влияния ГК на состав тела, несмотря на длительную историю их применения при РА, продолжают оставаться в зоне внимания ученых в силу продолжающегося широкого их использования. N.P. Konijn et al. изучили состав тела после 6-месячного лечения преднизолоном в сочетании с метотрексатом и сульфасалазином ГК-наивных пациентов (стартовая доза составяла 30 или 60 мг/сут со снижением в течение 8 или 6 недель до 7,5 мг/сут). Отмечено увеличение мас-сы тела и общего количества ЖМ, но не выявлено перераспределения ЖМ в сторону увеличения ее на туловище, что противоречило предположению о быстром неблагоприятном влиянии ГК на состав тела при РА [24].
Заключение
Наше исследование показало высокую частоту патологических фенотипов состава тела больных РА. Только 19% обследованных не имели отклонений в составе тела, в то время как 54% пациенток имели ожирение, а еще 19% – саркопеническое ожирение. Проведение DXA для оценки состава тела целесообразно для выявления СП и более точной диагностики ожирения с целью проведения превентивных мер как по предупреждению локомоторных нарушений, так и по возможному снижению сердечно-сосудистого риска у больных РА.



