Заболевания гениталий, вызванные вирусом папилломы человека (ВПЧ), привлекают пристальное внимание врачей, так как обладают высокой контагиозностью и способностью некоторых разновидностей вируса инициировать злокачественные процессы [1, 2]. В настоящее время полной элиминации вируса из организма достичь невозможно в связи с отсутствием специфических противовирусных препаратов и вакцин, действующих на ВПЧ [3]. Поэтому основной задачей терапии является лечение клинических и субклинических форм папилломавирусной инфекции (ПВИ) и, по возможности, устранение условий, приводящих к манифестации инфекции [2, 3]. Основной целью терапии ВПЧ-индуцированных заболеваний женских половых органов является удаления индуцированных вирусом неопластических образований на коже и слизистых оболочках (кондиломы, цервикальная интраэпителиальная неоплазия), а также достижение ремиссии или компенсации заболевания. Лечение данной патологии включает целый комплекс терапевтических воздействий (в большинстве случаев заключающихся в деструктивных методах), при этом их эффективность варьирует от 30 до 90%, но частота рецидивов даже при самых современных способах лечения составляет 15–20% [2–4].
Изучению роли локального иммунитета в организме посвящено много научных работ последних лет. Синтез дефензинов и лактоферрина, обладающих бактерицидным и цитотоксическим эффектами, выработка протеолитических ферментов (протеазы, липазы, гликозидазы, фосфатазы) и лизоцима, процессы в лимфопоэтических тканях, образование антител и секреторных иммуноглобулинов, регуляция процессов миграции фагоцитов, экзоцитоза и фагоцитоза и некоторые другие функции обусловливают важную роль в защитно-приспособительных реакциях вульвовагинальной зоны, где происходят распознавание и презентация антигенов В- и Т-клеток лимфоидной ткани и запускается механизм формирования иммунного ответа [3–6]. С позиции клинической иммунологии реализация папилломавирусной инфекции в виде аногенитальных (вульвовагинальных) кондилом является проявлением вторичной иммунной недостаточности, характеризующейся дисбалансом как гуморального, так и клеточного звеньев иммунитета [5–8]. Причем именно иммунный дисбаланс является одной из причин рецидивирования данного заболевания [4–6].

Среди большого разнообразия иммуномодуляторов можно выделить препарат галавит (ООО «Сэлвим», Россия), воздействующий непосредственно на клеточное, опосредованно на гуморальное звенья иммунитета и обладающий противовоспалительным, антиоксидантным и регенераторным действием [10–14]. Действующим компонентом лекарства является аминодигидрофталазиндион натрия (5-амино-1,2,3,4-тетрагидрофталазин-1,4-диона натриевая соль). Как лекарственное средство (разрешен к применению с 1997 г.) аминофталгидрозид был выбран в результате скрининга химических веществ, изменяющих функциональную активность макрофагов. Обнаружение выраженного модулирующего влияния на функцию указанных клеток послужило началом широкомасштабных испытаний, что привело к созданию нового лекарственного средства галавит и разработке оригинальных методов лечения ряда заболеваний [10–12]. Особое значение применение иммуномодулятора галавит имеет при хронических и рецидивирующих воспалительных заболеваниях различной локализации, сопровождающихся вторичной иммунной недостаточностью [11–13]. Основным действием препарата галавит является способность избирательно воздействовать на функционально-метаболическую активность фагоцитарных клеток, прежде всего моноцитов/макрофагов, нейтрофилов, NK-клеток (естественных киллеров), повышая или понижая их функционально-метаболическую активность в зависимости от исходных значений. Галавит регулирует пролиферацию Т- и В-лимфоцитов, стимулирует синтез эндогенных интерферона-α и -γ, повышает уровень иммуноглобулинов классов G, М, А и их аффинитет [11–13]. В дополнение галавит имеет антиоксидантный механизм действия, который реализуется несколькими путями: прямое антиоксидантное действие – инактивация реакционных соединений, регуляция активности антиоксидантных ферментов, уменьшение выработки макрофагами активных форм кислорода и перекисных радикалов [12–14]. Кроме того, галавит способствует ускорению процессов регенерации тканей. Все эти механизмы его действия позволяют осуществлять коррекцию иммунной защиты организма, повышать эффективность элиминации возбудителя инфекции из организма, снижать тяжесть и длительность заболевания, а также частоту рецидивирования.
 В связи с вышеперечисленным целью настоящего исследования стала оценка клинической и иммунологической эффективности терапии папилломавирусной инфекции гениталий у женщин с применением препарата галавит.
В связи с вышеперечисленным целью настоящего исследования стала оценка клинической и иммунологической эффективности терапии папилломавирусной инфекции гениталий у женщин с применением препарата галавит.
Материал и методы исследования
Для изучения влияния препарата галавит в составе комплексной терапии остроконечных кондилом вульвовагинальной зоны было инициировано проспективное наблюдательное исследование в условиях реальной клинической практики. Исследование проводилось в амбулаторных условиях в течение 1 года наблюдения (сроки проведения: январь 2016 г. – март 2017 г.). Основным критерием включения было наличие у обратившихся за медицинской помощью женщин остроконечных кондилом вульвовагинальной зоны. Обследовано 120 женщин в возрасте от 19 до 40 лет. Из них 30 вошли в контрольную группу условно здоровых женщин (иммунологический контроль) и 90 женщин с наличием остроконечных кондилом вульвовагинальной зоны. Все больные случайным способом были распределены в 2 группы: I (основная) группа – 45 пациенток, получивших предлагаемую комплексную терапию и II группа (сравнения) – 45 человек, которой проводилось современное традиционное лечение методами, идентичными пациенткам основной группы, но без использования препарата галавит. Пациенткам основной (I) группы проводили терапию препаратом галавит (ректальные суппозитории, содержащие 100 мг аминодигидрофталазиндиона натрия) по 1 свече 1 раз в сутки в течение 10 дней (курсовая доза 1000 мг). На следующий день после первого суппозитория галавита производили удаление кондилом одним из методов (химическая деструкция (солкодерм), радиоволновая эксцизия).
ПВИ диагностировалась на основании клиники (наличие кондилом аногенитальной области при общем осмотре и кольпоскопии), цитологического исследования (койлоцитарная атипия клеток при окраске по Папаниколау – РАР-тест) и Digene Hybrid Capture System II с помощью тест-системы HPV Digene-test (Abbot-Digene, USA) с набором реагентов для выявления и генотипирования основных вирусов папилломы человека (13 типов ВПЧ с высокой и 5 типов с низкой степенью онкогенного риска). Это позволило произвести анализ распространенности данных типов вирусов среди исследованных групп больных.
Исследование параметров системного и местного иммунитета в условиях терапии проводили до лечения, на 14-е сутки от начала терапии (4-й день после окончания терапии препаратом галавит) и через 1 месяц после окончания лечения. Исследование популяционного и субпопуляционного состава лимфоцитов периферической крови проводилось методом прямой иммунофлуоресценции, концентрацию цитокинов в цервиковагинальной слизи (IL-1β, IL-4, IL-10, TNFα, IFNg) определяли твердофазным иммуноферментным методом.
 Критерием клинической эффективности считали отсутствие остроконечных кондилом в аногенитальной зоне после деструкции в течение всего срока наблюдения – через 1, 6 и 12 месяцев; критерием цитологической и микробиологической эффективности являлась Pap- и Digene-негативация.
Критерием клинической эффективности считали отсутствие остроконечных кондилом в аногенитальной зоне после деструкции в течение всего срока наблюдения – через 1, 6 и 12 месяцев; критерием цитологической и микробиологической эффективности являлась Pap- и Digene-негативация.
Результаты исследования были обработаны методом вариационной статистики с определением критерия Фишера (F) для оценки непараметрических показателей групп малых выборок и критерием Стьюдента (t) для независимых групп. Анализ проводился с использованием программы Statistica 6.0.
Результаты и обсуждение
Выявлено, что основными возбудителями ПВИ аногенитальной зоны у женщин, являются вирусы папилломы человека (ВПЧ) низкого онкогенного риска (78,9±4,2%) (рис. 1). Из них основными типами ВПЧ, ответственными за появление остроконечных кондилом аногенитальной области, являются типы 6 (32,2±1,4%) и 11 (22,2±2,2%) (P<0,005). Достаточно часто обнаруживались и другие низкоонкогенные типы ВПЧ – 42 (8,9±3,4%), 43 (7,8±2,2%) и 45 (7,55±1,8%). Определенное эпидемиологическое значение имеют также некоторые типы высокоонкогенных вирусов, в частности 16 (7,8±1,2%) и 18 (14,4±2,2%).
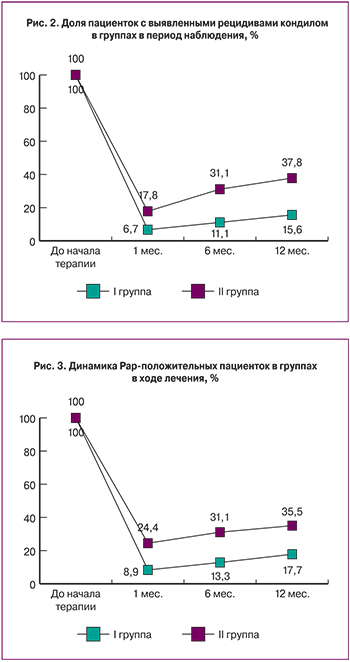
При сравнительном анализе динамики клинической картины у женщин с вульвовагинальными кондиломами выявлено, что через 1 месяц после проведения деструктивной терапии у пациентов II группы полное исчезновение остроконечных кондилом зарегистрировано у 82,2±2,4% пациенток. У 17,8±1,3% пациенток вновь появились остроконечные кондиломы на местах деструкции и соседних участках. На основании клинического и кольпоскопического исследования отмечены признаки специфического (кондиломатозного) и неспецифического воспаления. В I группе через 1 месяц наблюдения отмечена более выраженная положительная динамика: полное исчезновение остроконечных кондилом аногенитальной области выявлено у 93,3±2,5% больных и у трех пациенток (6,7%) при проведении расширенной кольпоскопии выявлена субклиническая форма ПВИ (мелкие плоские эндофитные кондиломы и цервицит с наличием клеток с признаками койлоцитарной атипии) (рис. 2).
Через 6 месяцев во II группе отмечено увеличение доли пациенток с клиническими рецидивами ПВИ: остроконечные кондиломы выявлены у 31,1±2,1% больных (P<0,05). В основной группе на данном сроке мониторинга доля пациенток с клиническими рецидивами ПВИ составила 11,1±1,3%. Еще через полгода (12 месяцев наблюдения) во II группе рецидивы ПВИ выявлены у 37,8±2,7% пациенток. В I группе при наблюдении в течение 12 месяцев также не отмечалось существенных изменений по сравнению с полугодовым периодом мониторинга. Общее количество пациенток с рецидивом ПВИ составило 15,6±1,4% (р<0,05).
Микробиологическая диагностика на выявление ВПЧ в обеих группах была проведена через 6 и 12 месяцев после окончания терапии. В данном исследовании мы не ожидали появления каких-либо положительных результатов, так как считается, что в настоящее время полной элиминации возбудителя достичь практически невозможно [9]. Тем более интересно было увидеть, что на фоне предложенной терапии с применением иммуномодулирующего и противовоспалительного препарата галавит (I группа) через 6 месяцев у 53,3±3,4% больных обнаружена Digene-негативация ДНК ВПЧ. Через 12 месяцев отсутствие ВПЧ выявлено у 57,8±2,7% исследуемых I группы. В группе сравнения (II группа) через 6 месяцев от начала терапии Digene-негативация выявлена у 11,1±1,3% женщин, а через 12 месяцев – у 15,5±1,3% (P<0,05). По-видимому, Digene-негативация вируса папилломы человека произошла за счет малых, не регистрируемых данным методом, концентрации ДНК ВПЧ в исследуемом материале.
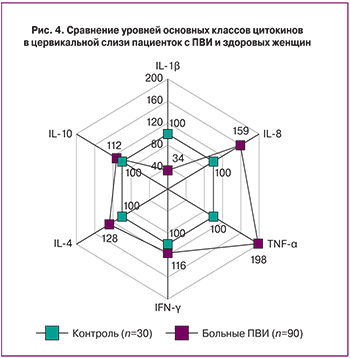
В ходе цитологического мониторинга через 1 месяц от начала терапии во II группе (сравнения) выявлено 24,4±2,1% пациенток с положительными Pap-мазками. Через 6 месяцев доля пациенток достигла 31,1±2,6%, а к 12 месяцам – 35,5±2,4% (р<0,05). В I группе (контрольной) динамика результатов цитологического Pap-теста была следующая: 1 месяц от начала терапии – 8,9±1,1% Pap-положительных пациенток, 6 месяцев – 13,3±2,3%, 12 месяцев – 17,7±2,2% (р<0,05) (рис. 3).
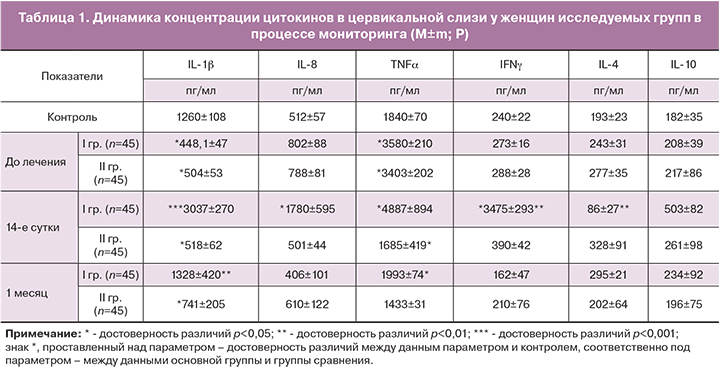
Проведенные иммунологические исследования показали, что при манифестации ПВИ в виде остроконечных кондилом вульвовагинальной зоны отмечалось снижение относительной и абсолютной концентрации Т-хелперов и Т-супрессоров в сыворотке крови, при тенденции к повышению процентного содержания NK-клеток и В-лимфоцитов. В цервиковагинальной слизи выявлялись достоверное (р<0,005) снижение концентрации IL-1β и недостоверное (р>0,05) повышение концентраций цитокинов TNFα, IL-4 и IL-10, при также минимальном увеличении IFNg (рис. 4).
Сразу после окончания курса проводимой терапии в I группе концентрация IFNg в сыворотке крови увеличилась более чем в 4,5 раза в сравнении с параметрами здоровых женщин и с исходными данными, а в цервикальной слизи – почти в 12 раз (табл. 1). Также в эти сроки отмечено достоверное (р<0,001) повышение в цервикальной слизи концентрации IL-1β (почти в 19 раз).
По остальным параметрам хоть и было выявлено повышение концентрации цитокинов IL-4, IL-8, IL-10 и TNFa, но оно не было статистически достоверным (р>0,05). В периферической крови на всех сроках мониторинга существенных изменений (кроме повышения концентрации IFN-g) отмечено не было.
Таким образом, показано, что при применении препарата галавит в форме ректальных суппозиториев при лечении ПВИ отмечаются иммуномодулирующие эффекты, способствующие активации макрофагов и NK-клеток, оказывающих цитотоксический эффект на инфицированные вирусом клетки. Через 1 месяц после окончания лечения в I группе концентрация IFN-g в сыворотке крови и цервикальной слизи практически не отличалась от значений здоровых женщин. У пациенток II группы на всех сроках наблюдения достоверных изменений в параметрах местного и системного иммунитета за исключением небольшого повышения в цервикальной слизи концентрации провоспалительных цитокинов выявлено не было.
Заключение
Таким образом, предлагаемый комплексный метод лечения с использованием сочетанного применения деструктивной терапии на фоне ректального введения иммунотропного препарата с противовоспалительной активностью – галавит в сравнении с изолированным применением только деструкции остроконечных кондилом является эффективным и позволяет уменьшить частоту рецидива кондилом в 2,6 раза в течение 12 мес наблюдения.



