В условиях демографического кризиса, снижения репродуктивного здоровья населения актуальным представляется сохранение детородной функции женщин. Несмотря на успехи и достижения современной науки, генерализованные гнойно-септические осложнения послеродового периода на протяжении последних 10–15 лет остаются в числе наиболее частых причин материнской смертности в России и в мире [1–3].
Среди всех послеродовых инфекционных осложнений наиболее частым является послеродовый эндометрит (ПЭ); он же становится первым этапом развития генерализованных форм инфекции [3, 4]. Развитие воспалительного процесса в замкнутом пространстве послеродовой матки имеет свои нюансы в силу особенностей гемодинамики, присутствия крови и лохий; эндотоксины, выделяемые стремительно размножающимися микроорганизмами, быстро накапливаются и оказываются в циркулирующей лимфе и крови с последующим воздействием на состояние иммунологического ответа, способствуя генерализации процесса. В настоящее время разработаны и успешно применяются методы общей экстракорпоральной детоксикации при гнойно-септических заболеваниях, но при этом возможности удаления токсинов из очага воспаления ограничены [3, 5].
Другим важным вопросом современности является преодоление антибиотикорезистентности, которая приобретает глобальный характер [6, 7]. Различные виды микроорганизмов вырабатывают множественные механизмы устойчивости к различным группам антибактериальных препаратов, обмениваются данной информацией между собой. В связи с этим арсенал терапевтических средств стремительно сокращается; при том, что за последние 30 лет не было открыто ни одного нового класса антибиотиков [8].
Альтернативой или дополнением антибиотикотерапии может стать внутриматочная аппликация лекарственных средств, обладающих высокой сорбционной способностью и антибактериальным действием. Использование медицинских углеродных сорбентов позволяет воздействовать не только на сами микроорганизмы, уменьшая их количество в очаге воспаления за счет механической сорбции независимо от антибиотикорезистентности [9, 10], но и сорбировать различные виды токсинов, выделяемые возбудителями.
Цель исследования: оценить возможности детоксикационного действия аппликационной формы сорбента, модифицированного поливинилпирролидоном (ВНИИТУ-1(ПВП)), при лечении ПЭ.
Материалы и методы
База исследования: БУЗОО «Областная клиническая больница» г. Омска, отделение гинекологии. Сроки проведения исследования: период с 2016 г. по 2021 г. Объем исследования: 124 родильницы с ПЭ после кесарева сечения.
Родильницы, включенные в исследование, были разделены на 2 группы.
В основной группе (n=63) проводилось комбинированное лечение: одновременно с антибиотикотерапией в полость матки вводили аппликационную форму сорбента ВНИИТУ-1(ПВП). Время экспозиции сорбента составило 24 ч; по истечении данного времени сорбент извлекали из полости матки и вводили новый. Сорбционная терапия проводилась в течение 5 дней.
Родильницы группы сравнения (n=61) получали антибактериальную терапию. При поступлении антибактериальная терапия проводилась эмпирически назначением антибиотиков широкого спектра действия. На 2-е сутки, после получения результатов посевов, проводимая терапия корректировалась согласно чувствительности к высеваемой патогенной микробиоте.
Формованный сорбент ВНИИТУ-1(ПВП) имеет регистрационное удостоверение №РЗН 2015/2969 (14.08.2015 г.) и разрешен к применению на территории Российской Федерации (патент РФ № 2646496). Отсутствие токсичности подтверждается заключением № 2099.013П (14 августа 2013 г.). Это наноструктурированный углерод мезопористой структуры с антисептическими свойствами. Сорбент представляет собой полый цилиндр размерами 40×5 мм, имеет закругленные края и один внутренний канал круглого сечения (рис. 1А). ВНИИТУ-1(ПВП) упакован в сетчатую капроновую оболочку с размером пор более 1 мм. Данная оболочка не препятствует проникновению через нее сорбента. Прикрепленная к сорбенту нить необходима для его последующего удаления (рис. 1Б). Сорбент производит Федеральное государственное бюджетное учреждение науки «Федеральный исследовательский центр «Институт катализа им. Г.К. Борескова Сибирского отделения Российской академии наук».

Инструментальные и лабораторные методы обследования следующие.
1. Ультразвуковое исследование органов малого таза проводилось в 1-е сутки поступления и на 5-е сутки лечения. Аппаратура: SonoScape SSI-8000 Pro (Китай). Оценивались: переднезадний размер, длина, ширина тела и толщина полости матки. Для расчета объема матки использовали формулу: V=1/6π×L×H×B, где L – длина тела матки, H – переднезадний размер матки, B – ширина тела матки.
2. Гистероскопия проводилась с использованием гистероскопа OLIMPUS A4760 (Япония) всем поступившим в 1-е сутки.
3. Микробиологическое исследование: в 1-е сутки, до начала эмпирической антибактериальной терапии, выполнялся забор содержимого полости матки, избегая контакта с вагинальной и цервикальной флорой. Уровень обсемененности 102–9×103 КОЕ/мл оценивался как низкий; 104–9×104 КОЕ/мл – как средний; высокой степени соответствовал рост микроорганизмов в количестве 105–9×105 КОЕ/мл. Чувствительность определяли стандартным диско-диффузионным методом.
4. Иммунологическое исследование проводилось при поступлении и на 5-е сутки терапии, оценивая в аспирате эндометрия концентрацию противовоспалительного цитокина интерлейкина 10 (ИЛ-10), фактора некроза опухоли альфа (ФНОα), интерлейкина 1β (ИЛ-1β) (АО «Вектор-бест», Новосибирск).
5. Атомно-силовая микроскопия (АСМ) стержня сорбента (n=3) после его извлечения из полости матки проводилась для подтверждения его сорбционной способности (ФБУН ГНЦ ВБ «Вектор», Новосибирск).
6. Электронная микроскопия (ЭМ) использовалась для исследования смывов с сорбента (n=2) после его извлечения из полости матки (ФБУН ГНЦ ВБ «Вектор», Новосибирск).
7. Инфракрасная (ИК) спектроскопия (спектрометр IRPrestige-21 фирмы Shimadzu) проводилась с разрешением 4 см-1, в диапазоне 350–7800 см-1, с числом накопления спектров 50. Образец готовился методом седиментации мелких частиц, напыленных очень тонким слоем на пластинку BaF2 в стеклянном цилиндре. Первоначально, в течение 2–3 минут, осуществлялась седиментация крупных частиц путем вдувания небольших порций углеродного материала через отверстие в верхней части цилиндра. Осаждение мелких частиц занимало около 1 ч. Чтобы получить слой нужной толщины, вся процедура повторялась 7 раз. Обработку спектров (коррекция базовой линии и сглаживания) осуществляли в программном пакете ORIGIN.
Эффективность лечения ПЭ оценивалась по количеству выполненных гистерэктомий в наблюдаемых группах.
Статистический анализ
Статистическая обработка полученных данных осуществлялась с помощью STATISTICA 10.0. Нормальность распределения признаков определялась с помощью W-критерия Шапиро–Уилка. Преобладало распределение, отличное от нормального, соответственно, расчеты проводились с использованием методов непараметрической статистики: сравнительная оценка показателей двух независимых групп с помощью критерия Манна–Уитни, для небольших групп использовался точный критерий Фишера (относительные показатели). Оценка значимости различий между результатами лечения проведена с помощью критерия χ2. Количественные признаки представлены в виде медианы и интерквартильного интервала Ме (Q1; Q3). Исходы проведенной терапии выражались бинарными значениями, оценку величины клинического эффекта рассчитывали с помощью разности рисков с 95% доверительным интервалом (ДИ).
Работа выполнена в соответствии с требованиями биомедицинской этики, утвержденными Хельсинкской декларацией Всемирной медицинской ассоциации в 1964 году (с изменениями и дополнениями на 2008 г.). Выписка из протокола заседания этического комитета Федерального государственного бюджетного образовательного учреждения высшего образования «Омский государственный медицинский университет» Министерства здравоохранения Российской Федерации № 81 от 26.09.2016.
Результаты
У наблюдаемых пациенток наиболее часто встречалась хроническая железодефицитная анемия – 91/124 (73,4%). Во время беременности 7/124 (5,7%) пациенток перенесли острую респираторную инфекцию, которая у 2/124 (1,6%) женщин осложнилась пневмонией. Острый вагинит диагностировался у 42/124 (34%) беременных. Среди хронических воспалительных заболеваний лидировал хронический бронхит (15/124 (12,1%) наблюдаемых); на втором месте по частоте встречаемости выявлялись хронические воспалительные заболевания мочевыделительной системы (8/124 (6,5%)); у 3/124 (2,4%) беременных регистрировался хронический тонзиллит.
В исследование включались пациентки с ПЭ после кесарева сечения. Анализ показаний для оперативного родоразрешения показал, что наиболее часто хирургическое вмешательство проводилось по неотложным показаниям: на первом месте – аномалии родовой деятельности (32/124 (25,8%)); на втором месте – клинический узкий таз (28/124 (22,6%)); третье место – прогрессирующая гипоксия плода в родах (21/124 (16,9%)). Преэклампсия тяжелой степени послужила показанием для кесарева сечения у 11/124 (8,9%) беременных. Остальные 32/124 (25,8%) женщины были родоразрешены оперативным путем в связи с наличием рубца на матке после перенесенной ранее операции кесарева сечения.
Чаще всего эндометрит диагностировали на 10-е сутки после родоразрешения – 53/124 (42,7%). На 6–10-е сутки дебют заболевания отмечался у 39/124 (31,5%) родильниц. В 1–5-е сутки послеродового периода в стационар поступили 32/124 (25,8%) женщины. Основной жалобой (94/124 (75,8%)) при поступлении было повышение температуры тела; при этом субфебрилитет наблюдался у 26/124 (21,0%) родильниц, фебрильные значения регистрировались у 68/124 (54,8%).
Тянущие боли внизу живота отмечали 105/124 (84,7%) родильниц. У трети пациенток (40/124 (32,3%)) причиной обращения были жалобы на гнойные выделения из половых путей. Только 8/124 (6,5%) пациенток поступали в стационар с жалобами на обильные кровянистые выделения (табл. 1).
Результаты лабораторных исследований при поступлении (общий анализ крови, уровень цитокинов в метроаспирате) не различались в обследуемых группах (табл. 1).
Результаты культурального исследования показали, что в посевах из полости матки при ПЭ преобладал Enterococcus faecalis – 33/124 (26,6%); стафилококки (Staphylococcus spp.) занимали второе ранговое место – 26/124 (21,0%); на третьем месте по частоте встречаемости был Enterococcus faecium – 18/124 (14,5%); Escherichia coli высевалась у 12/124 (9,7%) родильниц. Corynebacterium spp. определялись у 6/124 (4,8%) родильниц, Acinetobacter baumannii – у 4/124 (3,2%). Остальные возбудители (Peptostreptococcus spp., Propionibacterium spp., Proteus vulgaris, Klebsiella pneumoniae, Streptococcus spp.) высевались менее чем у 1% наблюдаемых. Симбиоз нескольких возбудителей имел место в 50/124 (40,3%) посевах. Наиболее часто высевались следующие ассоциации микроорганизмов: Enterococcus faecalis у 7/33 (21,2%) пациенток сочетался со Staphylococcus spp., у 5/33 (15,2%) – с Escherichia coli, у 4/33 (12,1%) – с Enterococcus faecium.
Результаты исследования показали, что Enterococcus faecalis в 18/33 (54,5%) случаях проявлял резистентность к антибактериальным препаратам; при этом в 4/33 (12,1%) случаях был устойчив более чем к трем антибиотикам одновременно. Enterococcus faecium имел резистентность в 10/18 (55,6%) случаях; в 4/18 (22,2%) посевах определялась устойчивость более чем к трем антибиотикам. Группа стафилококков (Staphylococcus spp.) была устойчива к антибиотикам в 15/26 (57,7%) случаях, при этом в 9/26 (34,6%) случаях – к трем и более антибактериальным препаратам различных фармакологических групп. E. coli проявляла резистентность в 9/12 (75,0%) посевах, в 3/12 (25,0%) была устойчива к трем антимикробным препаратам. У Acinetobacter baumannii резистентность к антибиотикам выявлялась в 2/4 (50%) случаях, в 3/4 (75%) это была устойчивость к четырем препаратам.
При поступлении всем родильницам проводилась диагностическая гистероскопия. Анализ результатов показал, что наиболее часто (43/124 (34,7%)) выявлялись сгустки крови в области плацентарной площадки, а также отек шва (32/124 (25,8%)). У 25/124 (20,2%) женщин визуализировался некроз децидуальной ткани; у 8/124 (6,6%) – лигатуры свободно свисали в полость матки, дефекты шва в виде воронкообразного втяжения диагностировались в 5/124 (4,0%) случаях.
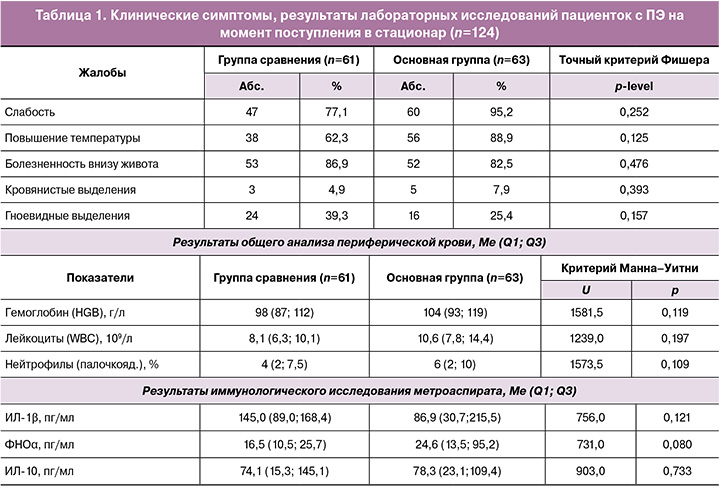
С целью оценки сорбционной способности ВНИИТУ-1(ПВП) была проведена АСМ стержня сорбента после его 24-часовой экспозиции в полости матки (n=3). АСМ подвергались части сорбента, который был предварительно разрушен. Исследование образца №1 показало, что вся поверхность сорбента была покрыта биоматериалом в виде органической пленки, состоящей из микроорганизмов округлой формы. Присутствие кокковой микрофлоры представлено на снимках (рис. 2). Предварительно сделанный посев с данного сорбента выявил массивный рост Enterococcus faecalis. На поверхности сорбента №2 были обнаружены микроорганизмы, в основном палочковидной формы. Результат посева с образца сорбента №2 определил наличие массивного роста Escherichia coli.
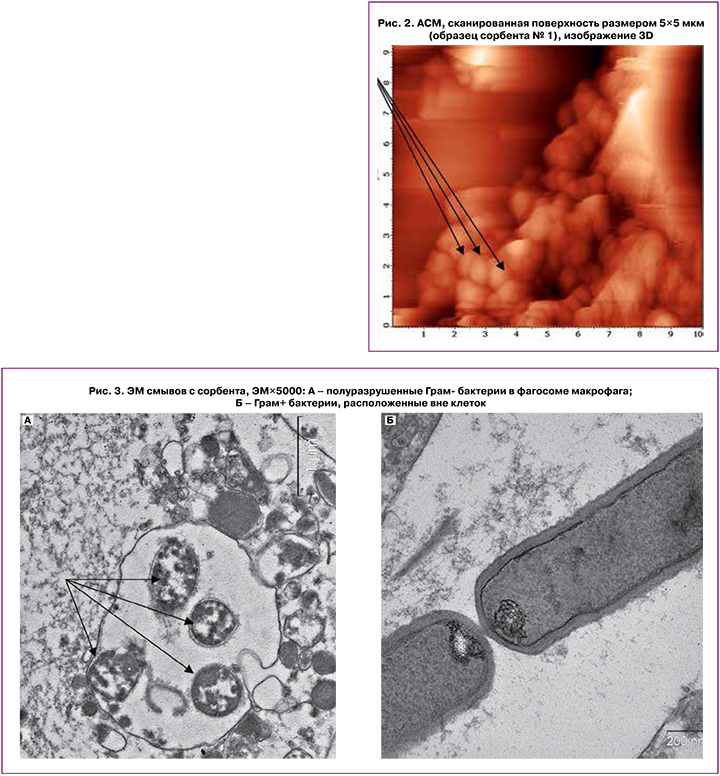
С целью уточнения состава клеточного детрита, присутствующего на поверхности сорбента, была проведена ЭМ смывов, сделанных с ВНИИТУ-1(ПВП) после его извлечения из полости матки (n=2). На стеклах в основном присутствовали клетки эпителия и нейтрофилы разной степени зрелости. Значительно реже встречались гранулоциты (эозинофилы и базофилы). Лимфоцитов обнаружено не было. В фагосомах нейтрофилов содержались целые или полуразрушенные бактерии (рис. 3А). Также в препаратах обнаруживалось значительное количество микроорганизмов поодиночке или группами, в основном это были Грам+ палочки, без признаков деструкции, также встречались картины деления (рис. 3Б).
Для определения детоксикационной способности формованного сорбента ВНИИТУ-1(ПВП) проведена ИК-спектроскопия углеродного материала после его извлечения из полости матки через 24 ч экспозиции (рис. 4). При исследовании образцов в спектральной области 1500–1600 см-1 на уровне 1536 см-1 проявлялась интенсивная широкая полоса поглощения, что соответствовало валентным колебаниям связей С=С в конденсированных ароматических соединениях. Появление полосы поглощения в спектральной области 1000–1200 см-1 свидетельствовало о наличии валентных колебаний связей С=О в спиртовых и фенольных субстратах. Полоса поглощения, соответствующая колебаниям связей С=О в эфирах фенолов и в лактонах, определялась в спектре 1200–1300 см-1. Наличие полосы поглощения в спектре 1350–1480 см-1 было характерно для связей С=Н в структурах -СН2- и -СН3-. Валентные колебания связей С=О в амидах (белки и полипептиды) регистрировались в спектре 1610–1700 см-1; данные структуры сопряжены с ароматическим кольцом в карбоновых кислотах, кетонах, сложных эфирах. Полученные результаты свидетельствуют о высокой способности ВНИИТУ-1(ПВП) сорбировать белковые структуры высокой, средней и низкомолекулярной массы.

Оценка эффективности проведенного лечения в исследуемых группах проводилась на основе изучения лабораторных показателей крови, показателей цитокинов в аспиратах полости матки, определения обсемененности полости матки, инволюции послеродовой матки по данным ультразвукового исследования (табл. 2).
Контрольные результаты показателей периферической крови родильниц с ПЭ на 5-е сутки проводимой терапии показали одинаково положительную динамику в обеих группах. Выявлены значимые различия в концентрациях провоспалительных цитокинов в метроаспирате. Так, в группе сравнения концентрации ФНОα и ИЛ-1β были в 3,2 и 4 раза выше, чем в основной группе. Результаты ультразвукового исследования, проведенного на 5-е сутки, регистрировали положительные инволютивные процессы размеров матки в группах. Однако в основной группе, на фоне комбинированного лечения, общий объем матки и толщина полости сокращались быстрее (табл. 2).
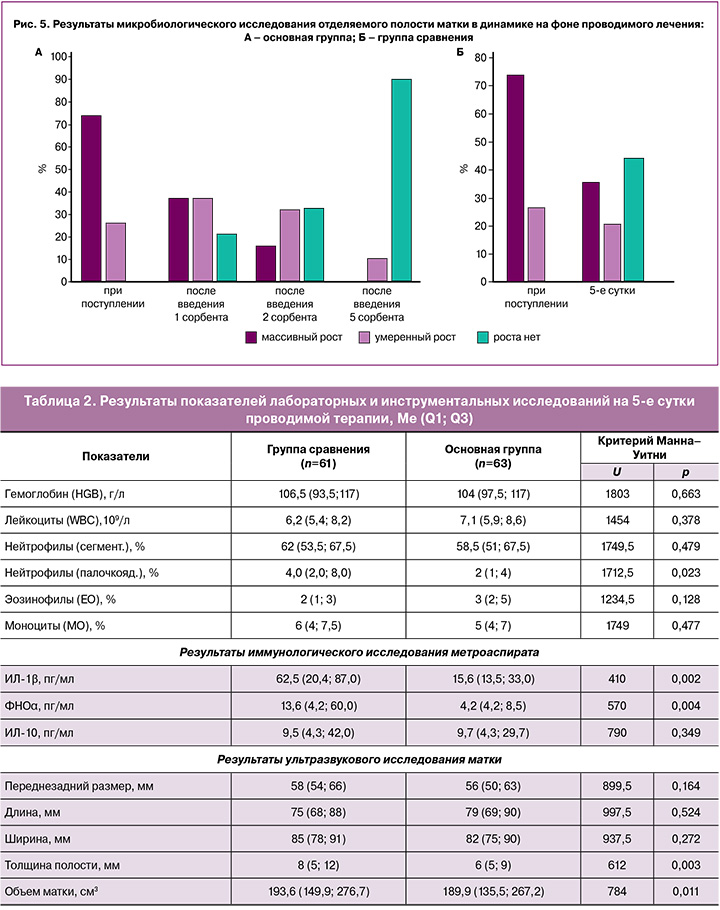
При анализе результатов посевов отделяемого полости матки на 5-е сутки проводимой терапии было выявлено, что в основной группе, где проводилось комплексное лечение, в 56/63 (88,9%) случаях посевы показывали отсутствие роста микрофлоры, в 7/63 (11,1%) – регистрировался умеренный рост микроорганизмов. В группе сравнения у 22/61 (36,1%) родильниц определялась высокая обсемененность посевов, у 13/61 (21,3%) – средняя (рис. 5).
Подводя итоги проведенного лечения, установили, что в группе сравнения у 14/61 (22,9%) родильниц была выполнена гистерэктомия в связи с неэффективностью терапии и прогрессированием воспалительного процесса; в то время как в основной группе гистерэктомия потребовалась только одной пациентке (χ2=10,494; р<0,05).
Учитывая исход проведенной терапии, оценку величины клинического эффекта рассчитывали с помощью разности рисков. Относительный риск равен 0,069 (95% ДИ 0,009–0,51), т.е. риск гистерэктомии в основной группе в 14,5 раза меньше, чем в группе сравнения.
Обсуждение
Гнойно-воспалительные заболевания послеродового периода в настоящее время все еще остаются актуальной и не до конца решенной проблемой в акушерстве. Это связано с растущей антибиотикорезистентностью возбудителей, снижением соматического здоровья беременных и родильниц, риском генерализации инфекционного процесса с возможной потерей матки, что впоследствии делает невозможным деторождение, приводит к нарушениям анатомо-функциональных взаимоотношений органов малого таза, нейровегетативным и гормональным расстройствам с соответствующим ухудшением качества жизни пациенток. Таким образом, сохранение матки — одно из непременных условий оказания медицинской помощи женщинам репродуктивного возраста [11–13].
По данным литературы, среди возбудителей ПЭ доминирующая роль принадлежит грамположительной анаэробной (энтерококки, стрептококки группы В, стафилококки) и аэробной (виды пептококков и пептострептококков) кокковой флоре, аэробным грамотрицательным палочкам (E. coli, Klebsiella pneumoniaе) [14, 15]. Полученные нами данные согласуются с данными литературы и свидетельствуют о преобладании у пациенток с ПЭ кокковой флоры (Enterococcus faecalis (26,6%), Staphylococcus spp. (21,0%), Enterococcus faecium (14,5%)) с присутствием грамотрицательной E. coli (9,7%). Ассоциации нескольких микроорганизмов, высеваемых из полости матки, встречались в 40,3% посевов. При этом антибиотикорезистентность выявленной флоры достигала 53,6–68,3% случаев.
Проведенные АСМ и ЭМ стержней сорбента, извлеченных через 24 ч из полости матки пациенток с ПЭ, подтвердили высокие сорбционные способности ВНИИТУ-1(ПВП). При этом сорбции подвергаются все микроорганизмы, независимо от их антибиотикорезистентности, а также клеточный детрит.
Поверхность формованного сорбента пропитана раствором мономера ПВП с последующей его полимеризацией (на поверхности стержня содержится не менее 5% ПВП). ПВП в своем составе содержит лактамное кольцо, в связи с чем оказывает антибактериальное воздействие на патогенную микрофлору, подобно (ВНИИТУ-1(ПВП))-лактамным антибиотикам. Однако, в отличие от β-лактамных антибактериальных препаратов, ПВП в своем составе содержит γ-лактамное кольцо, что делает невозможным ферментативные атаки возбудителей, способных вырабатывать β-лактамазы.
Более того, исследования с использованием физико-химических методов показали, что при контакте с биологической средой ПВП мигрирует (десорбируется) с поверхности сорбента в виде полимерных цепей во внешнюю среду и может самостоятельно взаимодействовать с бактериальными клетками [16, 17].
В процессе жизнедеятельности патогенные микроорганизмы выделяют во внешнюю среду биологически активные вещества – экзотоксины; в момент гибели, при разрушении клеточной стенки, высвобождаются эндотоксины, механизм действия которых сводится к нарушению жизненно важных процессов в клетках (блокада синтеза белка, повышение проницаемости мембраны, транспортировка веществ), что приводит к усугублению течения воспалительного процесса [18]. Бактериальные токсины по своей химической структуре – это белки. Проведенная ИК-спектрометрия показала высокую сорбционную способность формованного сорбента ВНИИТУ-1(ПВП) относительно белковых структур.
Проведенное нами исследование показало высокую эффективность комбинированного лечения с использованием ВНИИТУ-1(ПВП) при лечении пациенток с ПЭ в сравнении с традиционной тактикой за счет способности сорбента элиминировать возбудителей, независимо от их антибиотикорезистентности, дополнительно воздействовать на микрофлору бактерицидными свойствами ПВП и возможности поглощать бактериальные токсины. Так, в основной группе на 5-е сутки лечения содержание палочкоядерных нейтрофилов периферической крови было в 2 раза ниже, чем в группе сравнения (p<0,05). Концентрации провоспалительных цитокинов ФНОα и ИЛ-1β в отделяемом полости матки были также в 3,2 и в 4 раза ниже в основной группе (p<0,05). Результаты ультразвукового исследования свидетельствовали о том, что в течение первых пяти дней лечения инволютивные процессы матки происходили быстрее среди пациенток, получавших комбинированное лечение (р=0,011). Наличие выраженной разницы в степени обсемененности полости матки у наблюдаемых на 5-е стуки лечения также свидетельствует о большей эффективности комбинированного метода лечения ПЭ с использованием формованного сорбента ВНИИТУ-1(ПВП).
Сохраняющаяся персистенция патогенной микрофлоры в полости матки у пациенток группы сравнения (массивный рост у 36,1% родильниц и умеренный рост – у 21,3%) поддерживала воспалительный процесс, что выражалось в высокой концентрации в метроаспирате провоспалительных цитокинов (ИЛ-1β, ФНОα) и соответствующем нейтрофильном лейкоцитозе периферической крови на 5-е сутки традиционной антибактериальной терапии, создавая высокий риск генерализации инфекционного процесса, для профилактики которого потребовалось проведение гистерэктомии у 14/61 (22,9%) женщин.
Расчет разницы рисков показал, что комбинированный подход к лечению родильниц с ПЭ позволил снизить риск органоуносящих операций в 14,5 раза.
Заключение
Комбинированный метод лечения ПЭ с использованием внутриматочного введения формованного сорбента ВНИИТУ-1(ПВП) позволяет улучшить результаты лечения данной патологии и снизить риск гистерэктомий в 14,5 раза. ВНИИТУ-1(ПВП) способствует полноценной элиминации патогенных микроорганизмов за счет их сорбции на поверхности сорбента, одновременно сорбируя продукты их жизнедеятельности и распада (экзо- и эндотоксины), тем самым снижая нагрузку на организм и факторы иммунной защиты, предотвращая выход токсинов на периферию, уменьшая риск генерализации процесса.



