В настоящее время в условиях экологического неблагополучия одним из факторов, приводящих к утяжелению течения аллергического ринита (АР), служит нарушение назального микробиоценоза с активацией условно-патогенной флоры [1, 2]. Проведенные исследования по изучению микробиоценоза слизистой оболочки полости носа указывают на доминирование стафилококковой инфекции у больных АР [3, 4]. Данные U. Gluck (2003) показали, что условно-патогенные микробы высевались у 90% больных АР, у здоровых – лишь в 36% случаев [5]. Данные бактериологического и микологического исследований слизистой оболочки полости носа у детей с АР нередко выявляют колонизацию не только Staphylococcus aureus, но и грибами рода Candida albicans [6–9]. Наличие грибковой флоры у пациентов с АР способствует развитию вторичной иммунной недостаточности и усугубляет течение АР. Аллергическое воспаление на уровне полости носа и наличие грибковой флоры у пациентов с АР способствуют формированию нарушений мукозального иммунитета. В педиатрической практике в последние годы активно используются неинвазивные методы диагностики, а весьма перспективным представляется исследование цитоморфологических и воспалительных сдвигов на местном уровне при оценке показателей назального секрета у детей с АР [10, 11]. Исследований, посвященных особенностям мукозального иммунитета при аллергическом воспалении и развитии грибковой колонизации на уровне верхних отделов дыхательных путей, в доступной литературе нами не обнаружено.
Исходя из вышеизложенного, представляет интерес изучение и состояние мукозального иммунитета при АР, в т.ч. ассоциированного с грибами рода Candida, что позволит расширить знания по данной проблеме и максимально персонифицировать проводимую терапию.
Материал и методы
Под наблюдением находились 87 детей в возрасте от 3 до 18 лет, из них 60 детей с АР, имевших бытовую и эпидермальную сенсибилизацию. Основную группу составили 30 детей с АР, ассоциированным с грибами рода Candida, в возрасте от 3 до 18 лет. У всех детей в мазках-отпечатках со слизистой оболочки полости носа обнаружены грибы рода Candida. В группу сравнения вошли 30 детей с круглогодичным АР (КАР) без колонизации слизистой оболочки полости носа грибковой микрофлорой. Контрольную группу составили 27 детей без АР и редко болеющие острыми респираторными заболеваниями.
Для проведения исследования получено разрешение локального этического комитета КГМУ, протокол № 1 от 23.01.2014, и информационное согласие всех пациентов на участие в исследовании.
Назальный секрет собирали на смоченный физиологическим раствором ватный тупфер из средней носовой раковины в течение 30 секунд, затем переносили в 0,25 мл физиологического растворa, центрифугировали при 1500 об/мин в течение 10 минут для осаждения целых клеточных элементов, отбирали надосадочную жидкость, замораживали ее при температуре -22 ◦С.
В назальном секрете определяли процентное соотношение клеточных элементов с оценкой показателей, характеризующих фагоцитарную активность нейтрофилов (ФАН-1 и ФАН-2). ФАН-1 вычисляли по проценту фагоцитирующих аутофлору нейтрофилов, ФАН-2 – по проценту деструктурированных нейтрофилов в цитоплазме, в которых сохранялись целые микроорганизмы, что служит показателем незавершенности фагоцитоза. Кроме этого определяли уровень локальной продукции секреторного иммуноглобулина Е (sIgЕ) и sIgA и показатели цитокинового профиля интерлейкина-4 (ИЛ-4), ИЛ-10, интерферона-γ (ИФН-γ).
Исследование уровней общего sIgЕ и ИЛ-4, -10, ИФН-γ в назальном секрете провели иммуноферментным планшетным методом.
Результаты исследования
Изучение цитологического профиля мазков-отпечатков со слизистой оболочки полости носа пациентов с КАР без колонизации слизистой оболочки полости носа грибами рода Candidа по сравнению с контрольной группой выявило достоверное повышение содержания эозинофилов в назальном секрете в период как обострения (табл. 1), так и ремиссии (р<0,05).
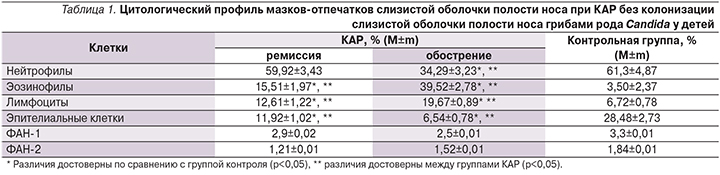
Число эозинофилов в период ремиссии уменьшилось в 2,5 раза по сравнению с периодом обострения, но сохранялось на повышенном уровне (в 4,4 раза выше, чем в контрольной группе). Это свидетельствует о хроническом аллергическом воспалении слизистой оболочки полости носа у больных КАР, которое сохраняется в период ремиссии, в развитии которого активное участие принимают эозинофилы. Также у детей с КАР имело место достоверное повышение числа лимфоцитов, наиболее выраженное в период обострения (19,67%), тогда как в период ремиссии отмечается их снижение (12,61%), что в 2 раза превышает значения контрольной группы. Перераспределение клеточных популяций проявилось, с одной стороны, увеличением числа эозинофилов и лимфоцитов, с другой – уменьшением числа эпителиальных клеток до 6,54% в период обострения и до 11,92% в период ремиссии. На фоне эозинофилии в риноцитограмме имело место достоверное снижение содержания нейтрофилов, которое было относительным и отмечалось только в период обострения заболевания на фоне высокой эозинофилии и умеренного повышения содержания лимфоцитов. Показатели, характеризующие функциональную активность нейтрофилов (ФАН-1 и ФАН-2), в группе сравнения не отличались от таковых группы контроля (p>0,05).
Изучение цитологического профиля мазков-отпечатков со слизистой оболочки полости носа у детей с АР, ассоциированным с грибами рода Candida, по сравнению с контрольной группой выявило (табл. 2) другое перераспределение клеточного состава, чем при КАР, без колонизации полости носа грибами рода Candidа.
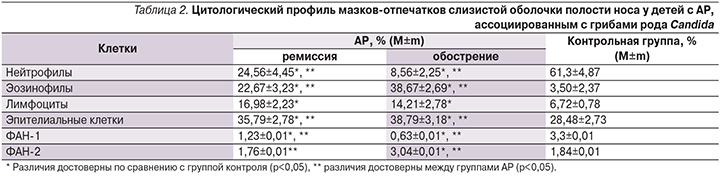
Так, в основной группе детей отмечается достоверное повышение эозинофилов и лимфоцитов в период как обострения, так и ремиссии, а также увеличение содержания эпителиальных клеток до 38,79% в период обострения и до 35,79% в стадии ремиссии (р<0,05). На фоне эозинофилии в риноцитограмме отмечается нейтропения со снижением уровня нейтрофилов до 8,56% в стадии обострения и до 24,5% в период ремиссии. У детей основной группы по сравнению с контрольной в период обострения имеет место достоверное снижение ФАН-1, что говорит о снижении процента фагоцитирующих аутофлору нейтрофилов, и ФАН-2, что свидетельствует об увеличении процента деструктурированных нейтрофилов в цитоплазме, в которых сохранялись целые микроорганизмы, что является показателем незавершенности фагоцитоза. Однако в стадии ремиссии повышается показатель ФАН-1, но остается достоверно ниже, чем в контрольной группе, и нормализуется ФАН-2, что коррелирует с отрицательными результатами мазка-отпечатка на грибы рода Candidа.
Изучение цитологического профиля мазков-отпечатков со слизистой оболочки полости носа у детей с АР, ассоциированным с грибами рода Candida, по сравнению с АР без грибковой колонизации выявило существенные различия клеточного состава в период обострения и в стадии ремиссии (табл. 3).
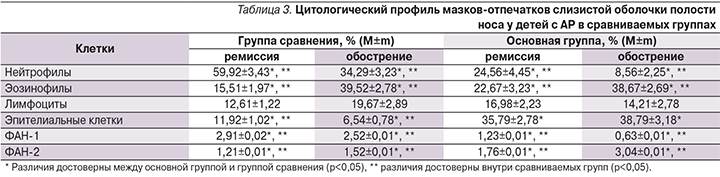
Так, в основной группе детей в период обострения отмечена выраженная эозинофилия, однако достоверных различий по уровню эозинофилов между сравниваемыми группами не выявлено. Тогда как в период ремиссии число эозинофилов в назальном секрете в основной группе достоверно превышало значения группы сравнения (р<0,05).
По числу лимфоцитов выявлен лимфоцитоз, однако в сравниваемых группах достоверных различий не выявлено. Для детей, больных АР, ассоциированным с грибами рода Candidа, характерны изменения других клеточных популяций, что проявилось выраженным снижением содержания нейтрофилов по сравнению с группой сравнения (p<0,05) в период обострения и в стадии ремиссии. Наиболее низким отмечено содержание нейтрофилов в период обострения (8,56%). В основной группе пациентов имело место достоверное повышение содержания эпителиальных клеток по сравнению с группой сравнения в стадии обострения и в период ремиссии (p<0,05).
Итак, у детей с АР, ассоциированным с грибами рода Сandida, в стадии обострения на фоне высокой эозинофилии в риноцитограмме регистрировалось резкое уменьшение содержания нейтрофилов (p<0,05) и увеличение числа эпителиальных клеток (p<0,05).
В стадии ремиссии в основной группе отмечено менее выраженное снижение числа эозинофилов (в 1,7 раза), чем в группе сравнения (в 2,5 раза), а уровень эозинофилов у детей с АР, ассоциированным с грибами рода Сandida, был достоверно выше, чем при АР, протекающим без грибковой колонизации. У больных основной группы в стадию ремиссии отмечено повышение числа нейтрофилов в 2,6 раза – с 8,54 до 24,56% (р<0,05). Однако в группе сравнения число нейтрофилов в данный период было в 2,4 раза выше, чем в основной группе. Выявленные изменения цитологического профиля и угнетение локального выхода нейтрофилов у детей с АР, ассоциированным с грибами рода Сandida, сопровождалось функциональными нарушениями, проявляющимися в угнетении показателей, характеризующих функциональные возможности фагоцитов назального секрета. Так, в период ремиссии установлено снижение значения ФАН-1 в 2,3 раза и повышение ФАН-2 в 1,4 раза по сравнению с группой сравнения.
В период обострения в основной группе на фоне выраженной нейтропении в риноцитограмме имело место снижение показателя ФАН-1 в 4 раза и повышение показателя ФАН-2 в 2 раза по сравнению с группой сравнения.
Таким образом, при АР, ассоциированном с грибами рода Сandida, имеются изменения риноцитологического профиля, что проявляется высоким уровнем эозинофилов, выраженной нейтропенией, увеличением числа эпителиальных клеток. Угнетение локального выхода нейтрофилов сопровождалось функциональными нарушениями фагоцитов назального секрета и проявлялось в снижении числа фагоцитирующих аутофлору нейтрофилов и повышении процента деструктурированных нейтрофилов с сохраненными непереваренными микроорганизмами.
У детей с АР, ассоциированным с грибами рода Candidа, исследованы некоторые показатели гуморального мукозального иммунитета, в частности sIgЕ и sIgA. Так, в группе детей с АР, не имеющих колонизации слизистой оболочки грибами рода Candida, в период обострения локальный синтез sIgЕ составил 38,17 МЕ/мл, что превышало показатели контрольной группы в 1,9 раза (табл. 4).
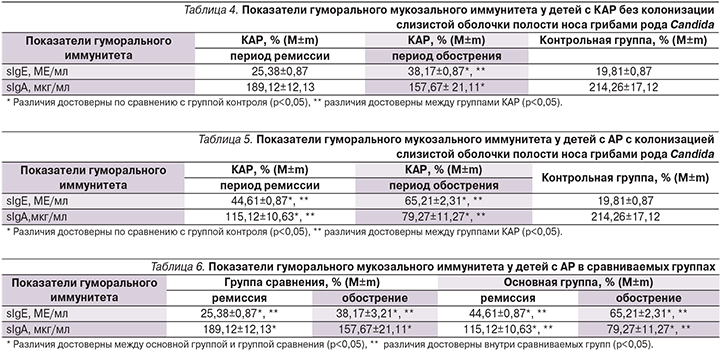
В период ремиссии заболевания уровень sIgЕ у больных АР достоверно снизился (р<0,05), но по его содержанию достоверных различий с контрольной группой не отмечено.
Изучение содержания sIgA в назальном секрете у больных АР с колонизацией слизистой оболочки полости носа грибами рода Сandida в период обострения (табл. 5) выявило его достоверное снижение по сравнению с контрольной группой (р<0,05), тогда как в период ремиссии уровень sIgA достоверно не отличался от контрольной группы (p>0,05). В период ремиссии АР по сравнению с периодом обострения имеет место тенденция к повышению количества sIgA в назальном секрете.
В группе детей с АР, ассоциированным с грибами рода Сandida, в период обострения уровень sIgЕ превышал показатели контрольной группы в 3,3 раза. В период ремиссии заболевания уровень sIgЕ снизился в 1,5 раза (р<0,05). Причем его содержание в период ремиссии было достоверно выше, чем в контрольной группе (р<0,05). Это может свидетельствовать о хроническом аллергическом воспалении, которое сохраняется в период ремиссии КАР.
Уровень sIgA в назальном секрете у больных АР, ассоциированным с грибами рода Сandida, в период обострения (табл. 6) был в 2,7 раза ниже, чем в контрольной группе (р<0,05).
В период ремиссии уровень sIgA достоверно повысился, но его значения были ниже, чем в контрольной группе (p>0,05).
Сравнение показателей гуморального иммунитета в назальном секрете у детей с АР, ассоциированным с грибами рода Candidа, по сравнению с детьми с КАР без грибковой колонизации слизистой оболочки полости носа выявило существенные различия уровней sIgЕ и sIgA. Так, количество sIgЕ в назальном секрете у детей с АР, ассоциированным с грибами рода Candida, в 1,7 раза выше, чем в группе детей с КАР, не имеющих грибковой колонизации в период обострения (р<0,05), и в 1,8 раза в период ремиссии (рис. 1).
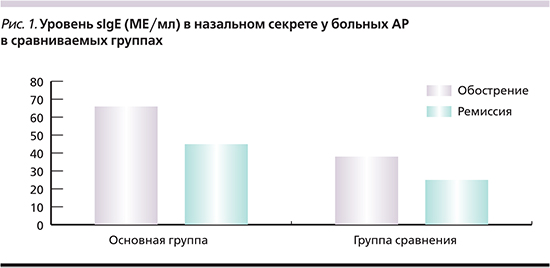
Это, вероятно, связано с тем, что грибы рода Caпdida, колонизирующие слизистую оболочку полости носа, выступают как специфический триггер, увеличивая выработку sIgE, и тем самым поддерживают хроническое воспаление в слизистой оболочке полости носа, с одной стороны, аллергического, с другой – инфекционного генеза.
Количество sIgA у детей с АР, ассоциированным с грибами рода Caпdida, в период обострения в 2 раза ниже, чем в группе сравнения (р<0,05), и в 1,6 раза в период ремиссии (р<0,05). В основной группе детей в период ремиссии отмечается повышение количества sIgA в 1,4, в группе сравнения – только в 1,2 раза. Известно, что sIgA обладает способностью связывать токсины и вместе с лизоцимом проявляет антимикробную активность. При снижении уровня sIgA создаются условия для активации условно-патогенной флоры, в частности грибов рода Сandida.
Таким образом, показатели гуморального мукозального иммунитета у больных КАР, ассоциированным с грибами рода Сandida, отличались более высоким уровнем sIgЕ в назальном секрете и более низкими значениями sIgA в период как обострения, так и ремиссии.
Нами проведен мониторинг локального цитокинового спектра (ИЛ-4, ИФН-γ и ИЛ-10) у детей с АР, ассоциированным с грибами рода Сandida. (табл. 7). Для этого прежде всего изучали динамику уровня ИЛ-4, занимающего центральную роль в развитии аллергического воспаления. При этом дисрегуляция его секреции служит ключевым моментом в развитии локального атопического воспаления, а анализ его активности имеет большое значение для понимания, реализации и диагностики атопических заболеваний.
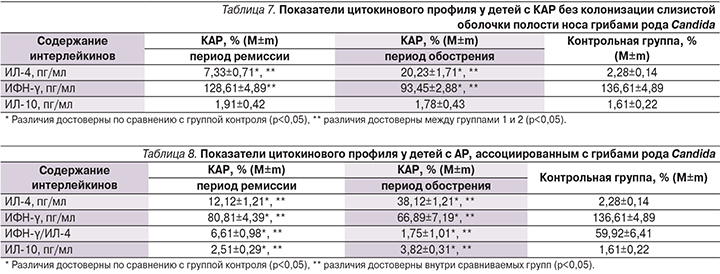
У детей с АР без колонизации слизистой оболочки полости носа грибами рода Сandida выявлено достоверное повышение содержания ИЛ-4 как в стадию ремиссии (до 7,33 пг/мл), так и в период обострении (до 20,23 пг/мл) по сравнению с контрольной группой (p<0,05). Важнейшим цитокином клеточного иммунного ответа, оппозиционным цитокину Тh2-профиля, является ИФН-γ. При изучении содержания ИФН-γ у пациентов с АР в период ремиссии достоверных различий с контрольной группой не обнаружено, тогда как при обострении АР выявлено достоверное снижение содержания ИФН-γ (p<0,05).
По уровню ИЛ-10 достоверных различий между группами сравнения и контрольной не выявлено. У детей с АР с колонизацией слизистой оболочки полости носа грибами рода Сandida по сравнению с контрольной группой выявлено (табл. 8) повышение уровня ИЛ-4 в период обострения в 16,7 раза (р<0,05) и в 5,3 – в период ремиссии (р<0,05). Количество ИФН-γ у пациентов основной группы было достоверно ниже, чем в контрольной, в период как обострения, так и ремиссии (р<0,05). У пациентов основной группы отмечено достоверное повышение ИЛ-10 по сравнению с контрольной группой, наиболее выраженное в период обострения (р<0,05).
Изучение показателей цитокинового профиля в назальном секрете у детей с АР, ассоциированным с грибами рода Candidа, по сравнению с КАР без грибковой колонизации выявило (табл. 9) достоверное повышение содержания ИЛ-4 (p<0,05).
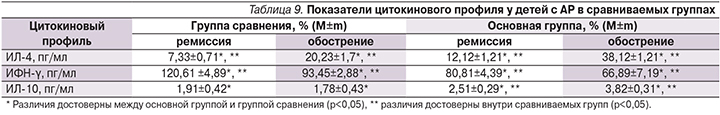
Максимальный уровень ИЛ-4 был выявлен при обострении АР в основной группе, который был выше (рис. 2), чем в период ремиссии (p<0,05), и превышал значения группы сравнения в период обострения (p<0,05).
Уровень ИФН-γ у пациентов с АР основной группы в период обострения был достоверно ниже, чем в группе сравнения (p<0,05). Содержание ИФН-γ в основной группе в период ремиссии достоверно снижалось (p<0,05), но его значения были ниже, чем в группе сравнения, что характеризовало наличие дисрегуляции Тh1/Тh2-баланса даже вне обострения заболевания.
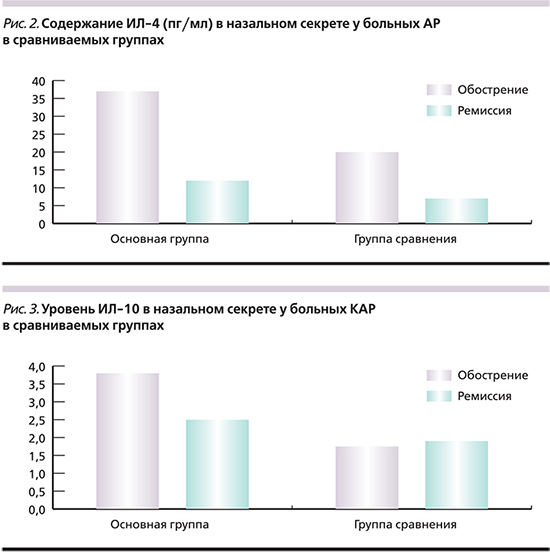
Изучение содержания ИЛ-10 в назальном секрете при АР (рис. 3), ассоциированном с грибами рода Candida, выявило достоверное увеличение по сравнению с группой сравнения в период как обострения (p<0,05), так и ремиссии (p<0,05). ИЛ-10 является важнейшим цитокином с супрессорным влиянием. Ингибирует клеточный иммунный ответ, подавляет продукцию цитокинов (ИЛ-2, ИЛ-3, ИФН-γ) Т-хелперами 1-го типа, ингибирует эффекторную функцию Th1-клеток и индуцирует антигенспецифическую толерантность через ингибирование провоспалительных цитокинов. Избыток ИЛ-10 может приводить к снижению противоинфекционной защиты и развитию хронических инфекций.
Таким образом, изучение особенностей мукозального иммунитета при АР, ассоциированном с грибами рода Candida, выявило высокий уровень показателей атопического типа реагирования: эозинофилию назального секрета, повышение уровней sIgE, ИЛ-4. Повышенная продукция ИЛ-10 способствует депрессированию выработки ИФН-γ и усилению дисбаланса цитокинового профиля, что способствует снижению выработки sIgA, угнетению миграции лейкоцитов в полость носа и их функциональной активности. Это, вероятно, связано с тем, что грибы рода Caпdida, колонизирущие слизистую оболочку, вызывают инвазивный процесс и оказывают на нее повреждающее действие, усиливая выработку медиаторов воспаления, с одной стороны, с другой – выступают как специфический триггер, тем самым, поддерживая хроническое воспаление как аллергического, так и инфекционного генеза.



