Одним из ключевых этапов улучшения результатов лечения диссеминированного колоректального рака было внедрение в клиническую практику бевацизумаба (Авастин). Включение этого препарата в современные режимы химиотерапии привело к доказанному и статистически значимому (в ряде исследований) увеличению частоты достижения объективного эффекта, медиан выживаемости без прогрессирования и общей выживаемости, причем последняя впервые превысила 2 года в большой популяции [1]. В то же время необходимо отметить, что минимум 40 % больных не имеют преимуществ от включения в лечебный режим бевацизумаба. Неуспех лечения может являться результатом как первичной устойчивости опухоли к проводимому лечению, так и приобретенной резистентности. Последняя может быть следствием включения альтернативных компенсаторных путей активации ангиогенеза, ремоделирования и “созревания” уцелевших после антиангиогенной терапии сосудов, рефрактерных к лечению, и т. д. Помимо этого резистентность может быть обусловлена селекцией устойчивых к гипоксии или мутировавших опухолевых клеток.
Высокая стоимость лечения бевацизумабом существенно ограничивает его широкое использование, актуализируя проблему отбора потенциально чувствительных к нему больных. Имеются сообщения о возможном прогностическом значении ряда клинических факторов, в частности развития артериальной гипертензии на фоне лечения. Создается впечатление, что эффект бевацизумаба лучше реализуется при крупных метастазах. В целом, однако, маркеры эффективности бевацизумаба до настоящего времени в точности не установлены.
В качестве потенциальных предикторов эффективности изучается роль циркулирующих эндотелиальных клеток, полиморфизм одиночных нуклеотидов гена семейства VEGF (vascular endothelial growth factor) и ряда других генов, ответственных за ангиогенез. На прошедшей конференции ASCO-2011 был представлен ряд работ, позволивших, на наш взгляд, вплотную подойти к решению этой проблемы.
В частности, прогностическая роль полиморфизма одиночных нуклеотидов генов семейства VEGF была изучена в работе Hansen и соавт. [2] у 249 больных, получавших в 1-й линии химиотерапии схемы FOLFOX, XELOX, FOLFIRI и XELIRI в комбинации с бевацизумабом. Была исследована ДНК, выделенная из образцов сыворотки крови методом полимеразной цепной реакции (ПЦР) в пяти локусах гена VEGFA, одном локусе гена VEGFR-1 и трех локусах гена VEGFR-2. Было установлено, что полиморфизм одиночных нуклеотидов в 319 локусе гена VEGFR-1 был ассоциирован с эффективностью комбинации химиотерапии и бевацизумаба. Объективный эффект наблюдался у 36 % больных при генотипе CC, у 40 % – при генотипе CA и у 56 % – при генотипе АА (p = 0,048). Помимо этого выявлены существенные различия в частоте достижения объективного эффекта в случаях генотипа с аллелью С (СС, СА) и гомозиготного генотипа в аллели А (АА) – 39 и 56 % соответственно (p = 0,015). Полиморфизм одиночных нуклеотидов других генов не коррелировал с частотой объективного эффекта. В данной работе анализ связи генотипа с выживаемостью больных не был представлен. Кроме того, отсутствие контрольной группы – больных, получавших только химиотерапию, затрудняет интерпретацию полученных результатов с точки зрения предиктивной роли эффективности бевацизумаба.
В основу исследования Gerger и соавт. [3] легло предположение, что рецептор интерлейкина-8 CXCR1, ответственный за не зависимый от VEGF ангиогенез, может служить маркером резистентности к бевацизумабу как к компоненту химиотерапии. Были изучены образцы сыворотки крови 130 больных, получавших лечение в режиме FOLFOX или XELOX в комбинации с бевацизумабом. Полиморфизм одиночных нуклеотидов был анализирован в генах VEGF-зависимого и VEGF-независимого путей ангиогенеза методом ПЦР и прямого ДНК-секвенирования. Мультивариантный анализ (с учетом поправки на зоны метастазирования и варианты химиотерапии) установил связь наличия рецессивной аллели CXCR1 rs2234671 (объективный эффект – 32,4 против 65 %; p = 0,004) и фактора активации тромбоцитов rs909253 (объективный эффект – 33,8 против 62 %; p = 0,019) c достоверно более низкой частотой достижения объективного ответа. Кроме того, выявление рецессивной аллели CXCR1 rs2234671 ассоциировалось с тенденцией к снижению медианы времени без прогрессирования: 7,8 против 15,2 месяца (отношение шансов – 1,60; p = 0,05).
Авторы сделали предположение, что выявление рецессивной аллели рецептора интерлейкина-8 CXCR1, играющего ключевую роль в VEGF-независимом пути ангиогенеза и являющегося потенциальным маркером стволовых клеток, может быть показателем резистентности к бевацизумабу и обусловленным стволовыми клетками резистентности к химиотерапии. Полученные результаты перспективны, но нуждаются в подтверждении в более крупных исследованиях с наличием контрольной группы.
Изменения в сыворотке крови уровней экспрессии VEGFC, VEGFD и PIGF в качестве маркеров прогрессирования опухоли на фоне химиотерапии с включением бевацизумаба были оценены Lieu и соавт. [4]. Забор материала проводили до начала, во время лечения и при установлении прогрессирования болезни. Отмечено значимое повышение уровней PIGF и VEGFD при прогрессировании, выявлена негативная корреляция этих маркеров с длительностью периода, прошедшего после последнего введения бевацизумаба.
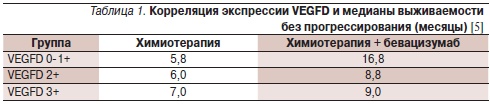
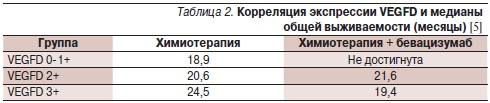
В свою очередь Weickhardt и соавт. [5] на образцах опухоли 268 больных метастатическим колоректальным раком, получавших лечение только капецитабином, капецитабином в комбинации с бевацизумабом или обоими препаратами и митомицином (исследование III фазы MAX), иммуногистохимическим методом изучили экспрессию членов семейства VEGF: VEGFA, VEGFB, VEGFC, VEGFD, VEGFR-1 и VEGFR-2. В основе рабочей гипотезы лежали данные, согласно которым VEGFC и VEGFD могут связываться с VEGFR-2, способствуя ангиогенезу. Гипотетически это должно приводить к снижению эффективности бевацизумаба, блокирующего взаимодействие только VEGFA с соответствующим рецептором. Результаты показали, что экспрессия VEGFD может быть потенциально использована в качестве прогностического маркера эффективности бевацизумаба. По данным одновариантного анализа, при низкой экспрессии VEGFD включение в режим бевацизумаба коррелировало с достоверным повышением выживаемости без прогрессирования заболевания (р = 0,02; табл. 1). При мультивариантном анализе уровень экспрессии VEGFD был единственным значимым фактором, влияющим на выживаемость без прогрессирования. Результаты оставались достоверными после коррекции по основным клиническим и морфологическим факторам и другим маркерам. При низкой экспрессии VEGFD в сравнении с его высокой экспрессией включение в режим бевацизумаба ассоциировалось с достоверным увеличением общей выживаемости (р = 0,01; табл. 2). Результаты оставались значимыми после коррекции по основным клиническим и морфологическим факторам, но не по другим маркерам.
Низкая экспрессия VEGFR-1 коррелировала с значимым и достоверным (р = 0,001) увеличением общей выживаемости больных, получавших бевацизумаб. Взаимосвязи этого маркера с выживаемостью без прогрессирования установлено не было.
Приведенные результаты выглядят весьма многообещающими, хотя авторы делают вывод о необходимости дальнейших исследований в этом направлении. Возможно, небольшое число больных с низкой экспрессией VEGFD не позволило сделать однозначное заключение о ее влиянии на общую выживаемость, в отношении которой роль VEGFR-1 кажется более значимой.
Ряд исследователей изучали корреляцию других молекулярных маркеров и эффективности комбинации химиотерапии с бевацизумабом. В частности, Guchelaar и соавт. [6] сделали вывод, что различные варианты гена AGPAT5 ассоциируются с эффективностью комбинации CAPOX-B. George и соавт. [7] показали значение высокого уровня Ki-67. Однако в этих исследованиях все больные получали бевацизумаб, и отсутствие контрольной группы не позволило адекватно оценить связь предлагаемых маркеров с эффективностью этого препарата.
В целом исследования маркеров, позволяющих с высокой вероятностью предсказывать целесообразность включения бевацизумаба в режимы химиотерапии метастатического колоректального рака, близки к завершению. Уже полученные данные могут способствовать более рациональному подходу к выбору варианта лекарственной терапии.
Информация об авторах:
Гуторов Сергей Львович – доктор медицинских наук, ведущий научный сотрудник РОНЦ им. Н.Н. Блохина РАМН.
Тел. 8 (495) 324-18-59, e-mail: s1gutorov@gmail.com;
Борисова Елена Ивановна – кандидат медицинских наук, старший научный сотрудник РОНЦ им. Н.Н. Блохина РАМН.
Тел. 8 (495) 324-18-59;
Чичиков Евгений Игоревич – врач отделения, РОНЦ им. Н.Н. Блохина РАМН.
Тел. 8 (495) 324-18-59;
Денисенко Аркадий Николаевич – кандидат медицинских наук, главный врач ГУЗ
"Нижегородский областной онкологический диспансер".
Тел. 8 (831) 438-93-65, e-mail: guznood@pochta.ru



