Колоректальный рак (КРР) занимает одну из лидирующих позиций в мире в структуре онкологической заболеваемости и смертности. В свою очередь показатель смертности от рака толстой кишки напрямую связан с частотой отдаленного метастазирования. Несмотря на то что в последние десятилетия в лечении метастатического КРР достигнуты существенные успехи, отдаленные результаты представляются недостаточными. Актуальной и значимой на сегодняшний день остается проблема поиска основных прогностических и предиктивных факторов эффективности лечения. Возможность четко охарактеризовать группы больных, у которых вероятность ответа на предполагаемый вид терапии выше, чем в общей популяции, может значительно улучшить показатели эффективности проводимого лечения, помочь избежать нецелесообразного применения определенных препаратов и улучшить отдаленные результаты лечения больных метастазами КРР.
На сегодняшний день опубликованы результаты многочисленных исследований, в соответствии с которыми у больных метастатическим КРР можно выделить определенные предиктивные и прогностические факторы. Однако многие клинико-морфологические характеристики обладают предполагаемой, но окончательно не доказанной прогностической ценностью [1].
Так, на основании ряда крупных исследований выделены достоверные факторы неблагоприятного прогноза у больных метастатическим КРР.
К ним относятся повышенные уровни щелочной фосфатазы, лейкоцитов, тромбоцитов, лактатдегидрогеназы, раковый эмбриональный антиген (РЭА) выше 50 нг/мл, низкий уровень гемоглобина, альбумина, а также плохое общее состояние больного, возраст старше 70 лет и наличие мутации гена BRAF в опухоли [2–5, 7, 8, 10, 11, 13]. Потенциально неблагоприятными факторами в настоящий момент считаются наличие у больного диссеминации по брюшине, более чем одна локализация метастатического поражения, раннее прогрессирование после адъювантной химиотерапии, мутация гена KRAS в опухоли [4–6, 8, 10, 13].
Помимо сложностей в определении достоверности отдельных факторов прогноза существует также проблема формирования комплексов клинико-морфологических параметров, наличие которых позволяло бы распределять пациентов с метастатическим КРР в определенные прогностические группы. Существующие на сегодняшний день неоднозначные результаты многочисленных исследований не позволяют выделять группы больных с благоприятным, промежуточным и неблагоприятным прогнозами с абсолютной точностью.
Оценка значимости прогностических и предиктивных факторов в подавляющем большинстве исследований проводилась у пациентов перед началом первой линии терапии. На сегодняшний день в связи с расширением в последние годы возможностей терапевтического лечения больных метастатическим КРР актуальным стало выявление факторов эффективности терапии и выживаемости в данной группе пациентов на разных этапах лечения.
В отделении химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России в рамках проспективного исследования 80 больных морфологически верифицированным метастатическим КРР после зарегистрированного прогрессирования на 1-й линии лечения с включением оксалиплатина получали 2-ю линию лекарственной терапии на основе иринотекана. Пациентам назначался один из следующих вариантов противоопухолевой терапии 2-й линии: иринотекан с ралтитрекседом, FOLFIRI, иринотекан с одним из таргетных препаратов (афлиберцепт, панитумумаб, требананиб). Средний срок наблюдения составил 25±1,5 месяца от начала 2-й линии противоопухолевой терапии. Медиана выживаемости без прогрессирования достигала 9,2 месяца, медиана общей выживаемости от начала 2-й линии терапии составила 18,2 месяца.
В данной группе больных был проведен анализ влияния на показатели общей выживаемости следующих факторов: пол, возраст (до 49 лет, 50–59, 60 лет и старше), стадия болезни по классификации TNM, степень дифференцировки опухоли, статус гена KRAS («дикий», мутированный), локализация первичной опухоли (ободочная кишка, прямая кишка), общее состояние больного по шкале ECOG, количество зон метастазирования, наличие метастазов в печени, количество метастазов в печени (<3, 3–5, >5), размер метастазов в печени, наличие метастазов по брюшине, исходный уровень РЭА (<50, 50–200, >200 нг/мл), динамика РЭА (снижение ≥50%, снижение <50%, рост РЭА), уровень лейкоцитов (≤9,0×109/л, >9,0×109/л), уровень тромбоцитов (≤300×109/л, >300×109/л), уровень гемоглобина (≤11 г/дл, >11 г/дл), уровень щелочной фосфатазы (≤300, >300 ЕД/л).
По результатам однофакторного анализа был определен ряд закономерностей, потенциально имеющих прогностическое значение.
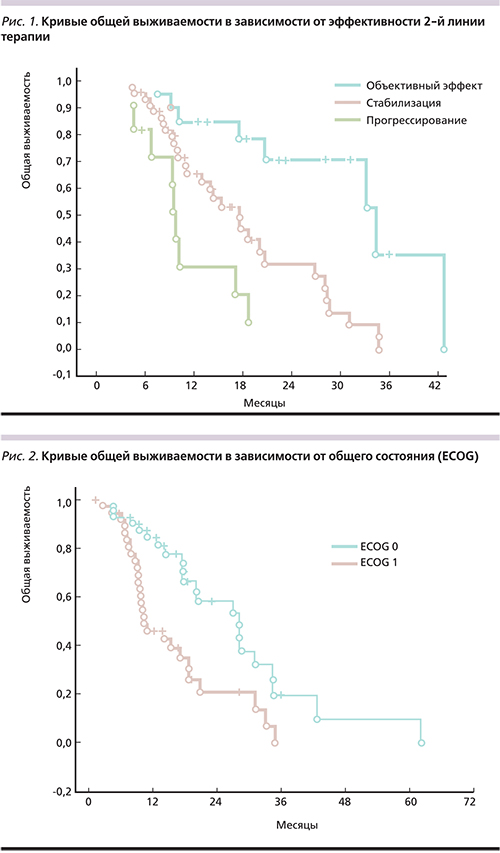
В группе больных, достигших объективного эффекта во 2-й линии противоопухолевой терапии, отмечено достоверное увеличение одно- и двухлетней выживаемости по сравнению с пациентами со стабилизацией (р<0,03) и прогрессированием болезни (р<0,001). Кумулятивная однолетняя выживаемость больных с объективным эффектом, стабилизацией и прогрессированием заболевания составила 85,0, 71,1 и 33,3% соответственно. Кумулятивная двухлетняя выживаемость составила 69,5, 31,0 и 11,1% в соответствующих группах.
Различия в показателях общей выживаемости достоверны между всеми тремя группами (р=0,00222; рис. 1).
У больных, находившихся в хорошем общем состоянии, оцененном по шкале ECOG как 0, отмечено достоверное улучшение общей выживаемости по сравнению с пациентами с ECOG 1 (р=0,00453). Показатели кумулятивной однолетней выживаемости составили 84,4% для группы пациентов, состояние которых было оценено по шкале ECOG как 0, и 46,0% для группы больных с ECOG 1. Показатели кумулятивной двухлетней выживаемости составили у них 59,1 и 21,6% соответственно (рис. 2).

Повышение уровня лейкоцитов более 9,0×109/л перед началом 2-й линии противоопухолевой терапии достоверно ассоциировалось со снижением общей выживаемости (р=0,00405). Показатели однолетней кумулятивной выживаемости больных с исходным уровнем лейкоцитов до 9,0×109/л и выше 9,0×109/л составили 70,0 и 28,5%, показатели двухлетней выживаемости – 43,8 и 14,3%, трехлетней – 13,6 и 0% соответственно (рис. 3).
Среди больных с «диким» типом гена KRAS в опухолях выявлено достоверное увеличение общей выживаемости по сравнению с пациентами с мутированным типом (р=0,0478). Кумулятивная однолетняя выживаемость составила 80,4 и 62,6% соответственно в группах с «диким» и мутированным KRAS, двухлетняя выживаемость – 63,3 и 26,7% соответственно (рис. 4).
У пациентов с 3 и более зонами метастатического поражения выявлено достоверное ухудшение показателей общей выживаемости (р=0,04829). Показатели однолетней выживаемости в группах пациентов с одной, двумя, тремя и более локализациями метастазов составили 80,0; 62,4 и 44,5%, двухлетней выживаемости – 65,5; 34,0; 24,1% соответственно (рис. 5).
При наличии у больных диссеминации по брюшине выявлена тенденция к снижению общей выживаемости по сравнению с пациентами без метастатического поражения лимфоузлов брюшной полости (р=0,121). Статистически значимые различия в группах определяются на моменты одно- и полуторогодового наблюдения. Так, однолетняя выживаемость составила 48,6% в группе больных с метастазами по брюшине и 72,4% в группе пациентов без данного поражения, полуторогодовая – 27,3 и 57,3% соответственно (р<0,05).
У больных с локализацией опухоли в прямой кишке по сравнению с пациентами с первичным поражением ободочной кишки отмечена тенденция к снижению общей выживаемости (р=0,2566). Кумулятивная двухлетняя выживаемость составила 47,5% у пациентов с первичным поражением ободочной кишки и 25,6% у больных с поражением прямой кишки.

При оценке влияния уровня РЭА на общую выживаемость выявлена тенденция к увеличению данного показателя у больных с исходным значением РЭА менее 50 нг/мл (р=0,084). Так, полуторогодовая выживаемость в группах с уровнем РЭА менее 50 нг/мл и РЭА ≥50 нг/мл составила 60,0 и 30,6% соответственно.
Изучение динамики РЭА на фоне 2-й линии лекарственной терапии показало тенденцию к улучшению общей выживаемости при снижении данного показателя и снижению выживаемости при его росте. Так, показатели кумулятивной однолетней выживаемости у пациентов со снижением РЭА на 50% и более, снижением РЭА менее чем на 50% и с ростом РЭА составили 78,8, 58,3 и 47,3% соответственно.
При оценке влияния на выживаемость больных других клинико-морфологических характеристик статистически значимых корреляций не найдено. Возможной причиной недостоверности различий может быть небольшое число больных в группах сравнения.
Для выявления наиболее значимых факторов, влияющих на выживаемость больных метастатическим КРР, проведен многофакторный анализ по 32 признакам. За основу был выбран двухлетний срок, поскольку средняя продолжительность наблюдения за пациентами составила 25 месяцев и использование больших значений было бы некорректно. На первом этапе для всей группы больных была определена значимость изучаемых параметров. С учетом коэффициента информативности отобраны наиболее значимые из них (табл. 1).
Для каждого признака были рассчитаны коэффициенты веса, позволяющие определить индивидуальный прогноз для больного (табл. 2). Точность двухлетнего прогноза жизни по 6 признакам составила 80,0% (95% доверительный интервал – 42,7–94,6). Для оценки точности решающего правила была произвольно выбрана «экзаменационная» группа из 26 (32,5%) больных, подтвердившая высокую точность прогноза.
Для определения индивидуального прогноза жизни больного суммируются коэффициенты веса каждого признака с учетом знака. При положительной сумме коэффициентов вероятность благоприятного прогноза составляет 90,1% (95% доверительный интервал – 43,0–98,5); при отрицательном значении – вероятность неблагоприятного прогноза составляет 70,5% (95 % доверительный интервал – 13,1–98,5).
Проведенный многофакторный анализ позволил определить следующие факторы благоприятного прогноза: объективный эффект и стабилизация во 2-й и 1-й линиях противоопухолевой терапии, менее 3 локализаций метастазов, ECOG 0, РЭА <50 нг/мл, «дикий» тип гена KRAS.
Среди неблагоприятных прогностических факторов: прогрессирование во 2-й и 1-й линиях лекарственной терапии, ≥3 зон метастазирования, ECOG 1, РЭА ≥50 нг/мл, мутированный тип гена KRAS.
Таким образом, при проведении многофакторного анализа установлено, что ожидаемая продолжительность жизни больных будет превышать 2 года при условии хорошей эффективности 2-й и 1-й линий противоопухолевой терапии, наличии менее 3 зон метастазирования, хорошем общем состоянии больного, уровне РЭА ниже 50 нг/мл и «диком» типе гена KRAS в опухоли.
Выделенный ряд клинико-морфо-логических факторов может способствовать индивидуализации прогноза жизни больных и позволить в дальнейшем оптимизировать тактику лекарственного лечения пациентов во 2-й линии терапии метастатического КРР.



