Введение
Хроническая обструктивная болезнь легких (ХОБЛ) – заболевание, характеризующееся персистирующими респираторными симптомами и ограничением скорости воздушного потока, связанным с бронхиальными и/или альвеолярными нарушениями, обычно вызываемыми значительным воздействием повреждающих частиц или газов [1]. Воспалительный ответ дыхательных путей на повреждение лежит в основе патогенеза данной патологии. Во всем мире ХОБЛ ассоциируется с высокой заболеваемостью и смертностью, что обусловлено непрекращающимся загрязнением окружающей среды, табакокурением и повторяющимися респираторными инфекционными заболеваниями; она продолжает представлять значительную проблему здравоохранения [1, 2].
В настоящее время терапия больных ХОБЛ индивидуализирована с учетом гетерогенности заболевания [3]. Общепризнанно проведение бронхолитической терапии, эффективность которой доказана при всех степенях тяжести заболевания, вариантах клинической симптоматики и функциональных показателях. Согласно международному рекомендательному документу «Глобальная стратегия диагностики, лечения и профилактики ХОБЛ», основу лечения больных ХОБЛ составляют бронхолитические препараты (длительно действующие антихолинергические препараты [ДДАХП] и длительно действующие β2-агонисты длительного действия [ДДБА]) [4].
Дискутабельным остается вопрос о назначении ингаляционных глюкокортикостероидов (ИГКС) пациентам с ХОБЛ. По данным литературы, доказана способность ИГКС снижать частоту обострений заболевания [5]. Также применение ИГКС в терапии ХОБЛ приводило к снижению уровня эозинофилов в мокроте, ослаблению тяжести клинических симптомов, повышению величин функции внешнего дыхания, что способствовало улучшению качества жизни больных [6].
Длительное время стартовую терапию больных ХОБЛ начинали с высоких доз ИГКС в комбинации с бронхолитическими препаратами. В последние годы тенденции терапии ХОБЛ претерпели изменения [7, 8] и значение ИГКС в лечении этой патологии значительно снизилось [9]. В национальных клинических рекомендациях по диагностике и лечению ХОБЛ указано, что назначение ИГКС не должно использоваться в качестве терапии первого выбора [10]. Тем не менее многие больные ХОБЛ продолжают получать регулярное лечение препаратами ИГКС в высоких дозах.
Многие годы назначение ИГКС рекомендовали для профилактики обострений у пациентов с ХОБЛ. Исследование FLAME, в котором сравнивалась эффективность двух комбинаций (ДДБА/ИГКС [салметерол/флутиказон 50/500 мкг 2 раза в день] и ДДАХП/ДДБА [гликопирроний/индакатерол 50/110 мкг 1 раз в день]) у пациентов (n=1680) с наличием как минимум одного обострения за предыдущий год, показало преимущество двойной бронхолитической терапии по сравнению с комбинацией ДДБА/ИГКС в предотвращении обострений ХОБЛ у больных с наличием обострений в предыдущий год [11].
При лечении ГКС существует риск развития нежелательных явлений. Регулярная терапия ИГКС связана с повышенным риском возникновения пневмонии [12], гематом, кандидоза полости рта, осиплости голоса [13, 14]. С учетом повышенного риска развития потенциально серьезных побочных эффектов и осложнений при терапии ГКС назначение данной группы препаратов должно быть обосновано, ограничено для пациентов, у которых эффект лечения перевешивает риск [15].
ХОБЛ – гетерогенное заболевание [16], и, вероятно, существует когорта пациентов, которые могут извлечь пользу от применения ИГКС. В последние годы рассматривают фенотипы ХОБЛ на основании типов воспаления дыхательных путей. Считается, что ИГКС будут оказывать положительное противовоспалительное действие только на больных ХОБЛ с эозинофильным типом воспаления дыхательных путей [17–19] и с неинфекционным обострением заболевания. А при нейтрофильном типе воспаления респираторного тракта и с инфекционным обострением ИГКС будут неэффективными и могут способствовать развитию нежелательных явлений [20].
По данным литературы, эозинофильный тип воспаления дыхательных путей (количество эозинофилов в мокроте >3%) встречается у 34–38% больных ХОБЛ в периоды стабильного течения заболевания [21].
В качестве биомаркеров эозино-фильного воспаления респираторного тракта рассматривается уровень эозинофилов в крови и мокроте [15]. Однако не существует единого мнения, при каком количество эозинофилов в крови необходимо назначать ИГКС: данные варьируются от 2 до 5% (абсолютное значение от 200 до 300 клеток/мкл) [22].
При активации эозинофилов из их гранул выделяются белки [23]. Одним из последних является эозинофильный катионный протеин (ЕСР). По данным литературы, ЕСР может рассматриваться как один из маркеров эозинофильного воспаления дыхательных путей [24].
В то же время нейтрофилы являются наиболее распространенными воспалительными клетками, присутствующими в дыхательных путях больных ХОБЛ [25]. Повышенное содержание нейтрофилов в респираторном тракте этих пациентов с ХОБЛ коррелирует с низкими показателями спирометрии [26]. В свою очередь нейтрофилы секретируют нейтрофильную эластазу (НЭ), которая служит протеолитическим ферментом, принадлежащим к группе химотрипсина, относящегося к семейству сериновых протеаз. Повышение функциональной активности НЭ коррелирует с количеством нейтрофилов и низкими величинами индекса Тиффно, что усугубляет клинико-функциональное течение ХОБЛ [27]. НЭ путем деградации внеклеточного матриксного компонента эластина, коллагена и ряда других структур способствует развитию фиброза легочной ткани [28], что является одним из основных патогенетических признаков ХОБЛ.
Предложенные биомаркеры эозинофильного типа воспаления респираторного тракта служат нестабильным показателем, характеризующимся имеющейся суточной вариабельностью. Уровень эозинофилов в крови зависит от многих факторов. Исследование эозинофилов в мокроте не всегда бывает информативным, т.к. она может быть с примесью гноя и крови, а исследование цитологического состава бронхоальвеолярного лаважа доступно не во всех лечебных учреждениях. Поэтому необходимы дополнительные маркеры для выявления эозинофильного типа воспаления дыхательных путей, что позволит обоснованно подходить к выбору терапии ИГКС у больных ХОБЛ.
Таким образом, определение маркеров и критериев эозинофильного типа воспаления респираторного тракта у больных ХОБЛ позволит практикующему врачу сделать наиболее оптимальный выбор проводимой терапии, что будет способствовать предотвращению прогрессирования заболевания и снижению риска развития нежелательных лекарственных эффектов.
Цель исследования
Оптимизация терапии ИГКС у больных ХОБЛ с учетом иммунологических маркеров типа воспаления.
Методы
Обследованы 97 пациентов с диагнозами ХОБЛ и «аллергическая форма бронхиальной астмой» (АБА) на базе государственного бюджетного учреждения здравоохранения «Клиническая больница № 4» г. Пензы (отделение пульмонологии) и Центральной научно-исследовательской лаборатории ПИУВ – филиала ФГБОУ ДПО РМАНПО Минздрава России.
Все обследованные лица были сопоставимыми по полу, возрасту, степени тяжести течения заболеваний. Диагнозы АБА и ХОБЛ установлены в соответствии с Федеральными клиническими рекомендациями и согласительными документами GINA-2014 и GOLD-2014 [29, 30]. Получено информированное согласие больных на исследование, где разъяснены цель исследования и возможные осложнения от диагностических манипуляций. Исследование одобрено Локально-этическим комитетом (протокол № 108).
Критерии включения в исследование: больные с диагнозом ХОБЛ среднетяжелого и тяжелого течений вне обострения, больные АБА средней и тяжелой степеней вне обострения, возраст больных от 40 до 65 лет, информированное согласие пациентов на участие в исследование.
Критерии исключения: неаллергическая форма БА, легкая и крайне тяжелая степени тяжести ХОБЛ и АБА, постоянный прием пероральных ГКС, декомпенсированные соматические заболевания, беременность и период лактации, нежелание участвовать в исследовании.
Больные были разделены на две группы. Первую (50 человек) составили больные ХОБЛ, вторую (47 человек) – больные АБА, последняя использована как группа сравнения классического (аллергического) эозинофильного типа воспаления дыхательных путей. Контрольную группу составили 17 практически здоровых лиц, сопоставимых по полу и возрасту с основными группами.
Исходно больные ХОБЛ получали комбинированную терапию: (ДДАХП/ДДБА/ИГКС) – 84% (n=42), (ДДАХП/ДДБА) – 16% (n=8).
Исследование уровня ЕСР в сыворотке крови определяли методом твердофазного иммуноферментного анализа (ИФА) при помощи тест-системы «Human Eosinophil Cationic Protein Elisa Kit» (Aviscera Bioscience, США). Концентрацию ЕСР выражали в нг/мл.
Исследование уровня НЭ в сыворотке крови определяли с помощью тест-систем для ИФА «Human PMN-Elastase Platinum ELISA» (eBioscience, Австрия). Концентрацию выражали в нг/мл.
Кроме того, определяли количество эозинофилов и нейтрофилов в крови и индуцированной мокроте (ИМ).
Статистическая обработка полученных данных проводилась с помощью пакета прикладных программ «Statistica 6,0» на персональном компьютере. При сравнении групп использовали критерий Манна–Уитни. Показатели представлены в виде медианы (Ме) и квартилей [Р25%; Р75%]. Проведен ROC-анализ. Результаты считались статистически значимыми при р<0,05.
Результаты исследования
В ходе исследования (см. таблицу) отмечено, что у части больных с диагнозом ХОБЛ наблюдалось повышение числа эозинофилов в крови и ИМ наряду с повышенными значениями нейтрофилов или без таковых. Эозинофилия в крови (количество эозинофилов >3%) выявлена у 16% (n=8) больных ХОБЛ. При цитологическом исследовании ИМ повышенный уровень эозинофилов >3% установлен у 10% (n=5) больных.
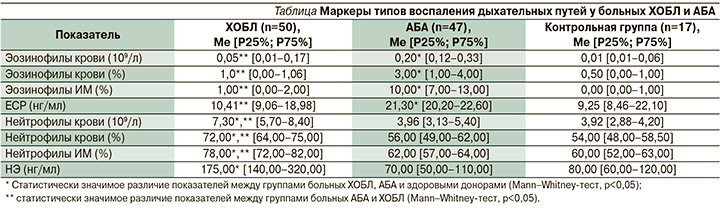
У 12% (n=6) больных ХОБЛ было выявлено повышение уровня ЕСР от 6,88 до 24,20 нг/мл. Уровень ЕСР отражает активность эозинофилов и их участие в воспалении при изучаемой патологии. Будучи продуктом эозинофилов, ЕСР представляет собой важный маркер эозинофильного типа воспаления дыхательных путей и его активности. Однако в среднем значения ЕСР у больных ХОБЛ составили 10,41 нг/мл, что в 2 раза ниже его уровня у пациентов с АБА (р<0,05).
Повышенное количество нейтрофилов как в крови, так и в ИМ выявлено у большинства больных ХОБЛ. Высокие показатели НЭ обнаружены у 82% (n=41) пациентов с этой патологией.
По данным литературы, для определения типов воспаления дыхательных путей акцент делается на количестве эозинофилов в мокроте и крови. В реальной клинической практике уровень эозинофилов лабилен и зависит от различных факторов (активность воспалительного процесса, терапия ГКС, сопутствующие патологии). Также наблюдается несовпадение повышенного уровня эозинофилов в мокроте с их содержанием в крови. Применение дополнительных маркеров, таких как ЕСР и НЭ, позволяет более точно определять тип воспаления.
Мы применили многофакторный анализ взаимосвязи изучаемых параметров, в результате которого выделены значимые показатели, достоверно связанные с типом воспаления: количество нейтрофилов в абсолютных цифрах, содержание эозинофилов в ИМ в процентном исчислении, уровни ЕСР и НЭ в крови. На основании этого разработана модель, дающая возможность дифференцировать воспаление дыхательных путей на нейтрофильный и эозинофильный типы [31].
Проведен RОC-анализ, который позволил определить пороговые значения значимых показателей с заданным уровнем чувствительности и специфичности теста для точного определения результата.
С помощью ROC-анализа определили пороговые значения: ЕСР ≥19,92 нг/мл, эозинофилов в ИМ ≥3,5%, НЭ ≥135 нг/мл и абсолютного уровня нейтрофилов в крови ≥5,38×109/л.
Обсуждение
Таким образом, уровни ECP ≥19,92 нг/мл (чувствительность – 90,00%, специфичность – 89,70%) и эозинофилов ИМ ≥3,5% (чувствительность – 82,90%, специфичность – 82,90%) можно рассматривать в качестве дополнительных критериев эозинофильного воспаления дыхательных путей.
В то же время уровень НЭ ≥135 нг/мл (чувствительность – 85,30%, специфичность – 77,10%) и абсолютное значение содержания нейтрофилов в крови ≥5,38×109/л (чувствительность – 72,20%, специфичность – 73,90%) служат критерием нейтрофильного воспаления дыхательных путей.
Выделено два эндотипа ХОБЛ по характеру воспаления дыхательных путей: эндотип ХОБЛ с эозинофильным типом воспаления – у 22% больных, эндотип ХОБЛ с нейтрофильным типом воспаления – у 78,00%. На основании выделенных эндотипов ХОБЛ проведена коррекция базисной терапии больным ХОБЛ с учетом иммунологических критериев типа воспаления.
На первом этапе исследования большая часть больных ХОБЛ получали ИГКС в сочетании с бронхолитической терапией. После пересмотра терапии с учетом типов воспаления количество больных ХОБЛ, в отношении которых применялись ИГКС, значительно уменьшилась: с 84 до 22%; увеличилось число пациентов на двойной бронхолитической терапии: с 16 до 78% (χ2=38,58; р=0,01). Уточнение показаний к назначению ИГКС будет способствовать снижению риска возникновения побочных эффектов стероидов.
Заключение
Таким образом, рациональное и обоснованное назначение ИГКС больным ХОБЛ вызвано выявлением маркеров эозинофильного типа воспаления дыхательных путей. Знание типа воспаления дает возможность практикующим врачам своевременно включать ИГКС в терапию, что позволит дифференцированно подходить к терапии и повысить ее эффективность.



