Частота поражения почек при ожирении достоверно не известна. Часть случаев остается нераспознанной, т.к. биопсию почки, как правило, этим пациентам не выполняют.
Ожирение приводит к повреждению почек через множество механизмов [1–2]. Кроме того, крайне редко у пациента с ожирением нет других заболеваний и состояний, в т.ч. ассоциированных с развитием метаболических нарушений и осложнений ожирения [3]. При ожирении выше частота мочекаменной болезни и онкологических заболеваний, в т.ч. почек, прогрессирует хроническая болезнь почек (ХБП) и выше риск развития острого повреждения почек (ОПП) [2, 4–5].
Ранее в случае жирового перерождения почек при микроскопическом исследовании осадка мочи выявляли кристаллы холестерина в виде бесцветных четырехгранных пластинок разного размера, прозрачных с обрезанным углом, ступенеобразными уступами. Кристаллы могли располагаться изолированно или наслаиваться друг на друга [6]. Липидурию подтверждали при микроскопии: выделение с мочой анизотропных, двоякопреломляющих жировых структур, которые в темном поле поляризованного света выглядят часто в виде темного креста со светящимися сегментами – «мальтийские кресты», которые связывали с жировой дегенерацией и последующей десквамацией клеток канальцевого эпителия. Она весьма характерна для нефротического синдрома (НС) независимо от его генеза [7–9].
В настоящее время обусловленную ожирением гломерулопатию диагностируют при выявлении таких функциональных и морфологических нарушений, как повышение скорости клубочковой фильтрации, альбуминурия/протеинурия, как правило без формирования НС, гломерулосклероз, тубулоинтерстициальный фиброз, гломеруломегалия, клубочковая гипертрофия, утолщение базальной мембраны клубочков [1–2, 4–5].
Биохимические маркеры используют наряду с инструментальными методами диагностики для выявления ранних изменений. В последнее время изучена масса биомаркеров. Признанный «золотой» стандарт – креатинин. Перспективными биомаркерами повреждения почек (диагностика ОПП, ХБП; риск развития ОПП и прогрессирования ХБП) считают NGAL и цистатин С. В рамках развития кардиоренального синдрома общепризнанны натрийуретические пептиды. Перспективен маркер миокардиального стресса – растворимый ST2 [10–12].
Цель исследования: изучить влияние ожирения на клинико-лабораторный статус пациентов с хронической сердечной недостаточностью (ХСН) в зависимости от полиморбидности и варианта поражения почек.
Материал и методы
В исследование были включены 176 больных, госпитализированных в Городской центр лечения ХСН с 01.02 2019 по 01.10.2020 в возрасте 69,48±13,24 года (95/53,98% мужчин в возрасте 65,89±14,6 года, 81/46,02% женщин в возрасте 73,69±9,99 года). Женщины были старше мужчин (р=0,0001).
Пациентов распределили в две группы в зависимости от наличия или отсутствия ожирения.
Учитывали причины госпитализации, частоту развития, тяжесть ОПП и анемии, а также частоту летального исхода в стационаре.
Исследование выполнено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы научных и медицинских исследований с участием человека» от 1964 г. с дополнениями 2000 г. Все пациенты, включенные в исследование (локальный регистр), подписали одобренную Локальным этическим комитетом Нижегородской региональной медицинской ассоциации форму добровольного информированного согласия на участие в исследовании.
Диагноз ожирения, ОПП, ХБП, анемии и ХСН устанавливали в соответствии с клиническими рекомендациями [10–15]. При эхокардиографии у пациентов определяли фракцию выброса (ФВ) по методу Симпсона. ХСН с сохраненной ФВ левого желудочка (СНсФВ) диагностировали при ФВ≥50%, промежуточной (СНпФВ) – 40–49% и низкой (СНнФВ) – <40%. ХСНсФВ устанавливали при повышении уровня N-концевого мозгового натрийуретического пропептида – NT-proBNP (более 125 пг/мл) и/или при наличии диастолической дисфункции и/или структурных изменений сердца (гипертрофия миокарда левого желудочка или увеличение левого предсердия).
СНсФВ диагностирована у 126 (71,59%) пациентов, СНпФВ – у 27 (15,34%) и СНнФВ – у 23 (13,07%).
Анализировали число заболеваний: 1–2 болезни диагностировали у 27 (15,34%) пациентов, 3–5 – у 40 (22,73%), более 5 – у 109 (61,93%).
Диагноз ОПП устанавливали в соответствии с клиническими рекомендациями [10]. ОПП диагностировали по исходному креатинину (Кр1 по сравнению с «базальным») и по динамике уровня креатинина (Кр2, его оценивали в сравнении с Кр1). Субклиническое ОПП диагностировали при нормальном уровне креатинина в крови и повышенном уровне NGAL и/или цистатина С в крови.
Анемию диагностировали при уровне гемоглобина менее 130 г/л у мужчин и менее 120 г/л у женщин. Анемию легкой степени тяжести верифицировали при уровне гемоглобина <129/119 – 90 г/л; средней степени – 89–70; тяжелой степени – <70 г/л.
Всем больным выполняли клинический анализ крови и мочи, биохимический анализ крови (глюкоза, общий белок, трансаминазы, билирубин, липидограмма, креатинин, электролиты, коагулограмма), записывали электрокардиограмму, выполняли рентгенографию органов грудной клетки и эхокардиографию. Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле СКD-EPI и по цистатину С. На 1–3-и сутки госпитализации забирали венозную кровь, методом иммуноферментного анализа определяли содержание уровней NT-proBNP (пг/мл) («Вектор-Бест», Новосибирск), липокалина 2/NGAL (нг/мл) («Нycult Вiotech», Нидерланды), цистатина C (мкг/мл) («ВекторБест», Новосибирск), ST2 (нг/мл) («Critical Diagnostics» Presage® ST2 Assay Kit, США).
Электронная база данных исследования была создана с помощью Microsoft Office Excel. 2019 с учетом требований, предъявляемых к современным реляционным базам данных. Статистическую обработку осуществляли с помощью специализированного пакета прикладных программ Statistica 10.0., MedCalc 12.6.1.0. В качестве теста на нормальность распределения признаков использовали критерий Колмогорова–Смирнова и тест Шапиро–Уилка. Количественные переменные описывали медианой (Ме) c указанием интерквартильного интервала [Q25-й процентиль, Q75-й процентиль] в случае несоответствия распределения величины нормальному; средним (M) и стандартным отклонениям (SD) – в случае нормального распределения величины. В качестве уровня достоверности нулевой гипотезы при сравнении независимых групп данных принята мультигрупповая величина рmg<0,017. При сравнении количественных показателей в трех группах и ненормальном распределении использовали критерий Крускалла–Уоллиса. Сравнение дискретных величин (качественных показателей) проводили с использованием χ2-критерия с поправкой на непрерывность по Йетсу. Если число случаев в одной из сравниваемых групп было менее 5, использовали двусторонний критерий Фишера (F-критерий). Оценку силы связи между признаками проводили с помощью рангового коэффициента корреляции Спирмена (R), тау-b Кендалла (τ). Для выявления факторов, связанных с развитием неблагоприятных событий, выполнен логистический регрессионный анализ. Результаты представлены в виде абсолютных значений (%). Различия считали статистически значимыми при p<0,05.
Результаты
В исследуемой выборке ожирение (по индексу массы тела – ИМТ, кг/м2) диагностировано у 78 пациентов.
В зависимости от наличия или отсутствия ожирения выделено 2 группы: 1-я (основная) – 78 (44,32%) пациентов с ожирением I–III cтепеней, 2-я (группа сравнения) – 98 (55,68%) пациентов с нормальной или избыточной массой тела.
В основной группе I степень ожирения имели 39 (50%) пациентов, II – 24 (30,77%) и III степень – 15 (19,23%) пациентов.
Различия между группами по возрасту (р=0,132), полу (р=0,055) и частоте ишемической болезни сердца (ИБС; р=0,066), инфаркта миокарда в анамнезе (р=0,144), артериальной гипертензии (р=0,229), острого нарушения мозгового кровообращения (р=0,225), фибрилляции и трепетания предсердий – ФП/ТП (р=0,119), заболеваний почек: хронический пиелонефрит (n=9 и n=9) и гломерулонефрит (n=0 и n=1), кисты почек и/или мочекаменная болезнь (n=19 и n=14; р=0,099) и ХБП С3–5 (n=34 и n=46; р=0,658), онкологических заболеваний (р=0,838), анемии 1–3-й степеней (р=0,762) и индексу коморбидности Чарлсона (р=0,153) были недостоверными. Выявлены различия по частоте сахарного диабета (типов 1 и 2), заболеваний суставов (остеоартрит, подагра) и тяжести ХСН (табл. 1).
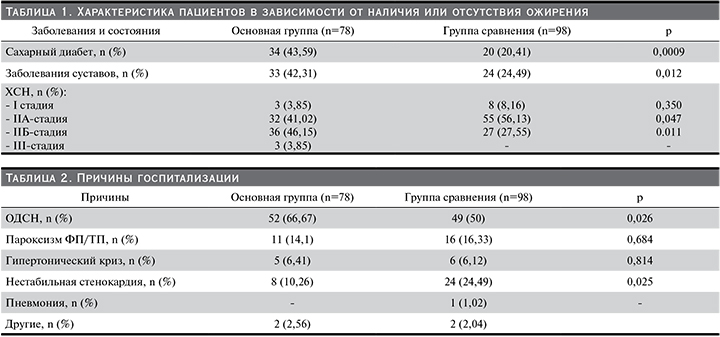
Различия между группами по причинам госпитализаций были достоверными лишь по частоте острой декомпенсации сердечной недостаточности – ОДСН (чаще в основной группе) и нестабильной стенокардии (чаще в группе сравнения) (табл. 2).
Не выявлено различий между группами по параметрам гемодинамики при госпитализации, показателям клинического анализа крови и мочи, липидограмме и по параметрам эхокардиографии. Уровни креатинина (при госпитализации и при выписке), расчетная СКФ, содержание NGAL (р=0,294) и цистатина С (р=0,502), NT-proBNP (р=0,919), ST2 (р=0,953) в зависимости от наличия или отсутствия ожирения не достигли статистической значимости (р>0,05). Проанализированы исследуемые показатели в зависимости от тяжести ожирения (1–3-й степеней). Уровни креатинина (при госпитализации и при выписке), расчетная СКФ, содержание NT-proBNP (рmg=0,133), sST2 (рmg=0,9), NGAL (рmg=0,652) и цистатина С (рmg=0,122), содержание белка (рmg=0,6) и эритроцитов (рmg=0,885) в моче в зависимости от тяжести ожирения не достигли статистической значимости (рmg>0,017).
ОПП было диагностировано у каждого пятого пациента (41/23,29%), у больных с ожирением (основная группа) преимущественно (63,16%) 2–3 стадий. В то же время не выявлено различий между группами по частоте развития ОПП, его форме и тяжести (р>0,05) (табл. 3).
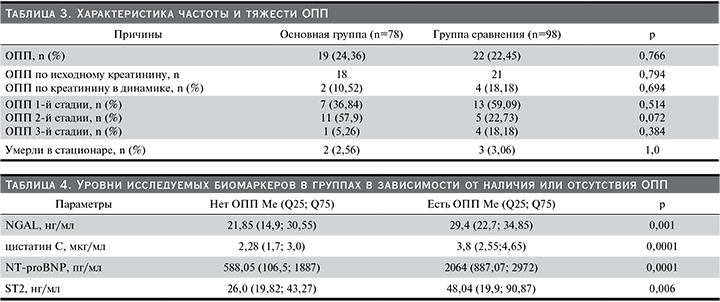
Наличие ожирения ассоциировано с риском развития ОПП (отношение шансов [ОШ]=2,269, 95% доверительный интервал [ДИ]: 0,04–129,799; р=0,691) и тяжестью ОПП (ОШ=1,246, 95% ДИ: 0,459–3,386; р=0,666), частотой госпитализации по причине развития ОДСН (ОШ=1,52, 95% ДИ: 0,666–3,472; р=0,320).
Во время госпитализации умерли 5 (2,84%) пациентов. У всех умерших развилось ОПП 2-й или 3-й стадии на фоне ХБП-С3–5.
У пациентов с ОПП были выше уровни всех исследуемых биомаркеров (табл. 4).
У пациентов с ожирением выявлены гендерные различия по возрасту (женщины были старше: 71,33±10,98 и 64,54±13,25; р=0,016). У мужчин были выше уровни гемоглобина: 137,46±21,35 и 124,47±16,57 (р=0,005), эритроцитов: 4,74±0,86 и 4,32±0,53 (р=0,017), гематокрита: 40,35±7,67 и 35,62±7,6 (р=0,014), билирубина: 18 (10,69; 27,43) и 11 (9,49; 15,27) (р=0,039), расчетной СКФ при выписке: 69 (53,58; 84,82) и 55 (34,76; 70,71) (р=0,012), содержания белка в моче: 0,15 (0,0; 0,69) и 0,0 (0,0; 0,14) (р=0,041).
У 29 (37,18%) пациентов с ХСН и ожирением в клиническом анализе мочи определялся белок в диапазоне от 0,1 до 6,05 г/л: у 17 до 1 г/л, у 10 от 1 до 3 г/л, у 2 более 3 г/л.
Анемия 1–3-й степеней диагностирована у 70 (39,77%) пациентов (n=32 и n=38 соответственно; р=0,762). ХБПС3–5 имели 80 (45,45%) пациентов (n=34 и n=46 соответственно; р=0,658). В исследуемой выборке выявлена корреляция между наличием анемии и тяжестью ХБП (R=0,231; р=0,002), выраженностью анемии и тяжестью ХБП (τ=0,224; р=0,001).
Обсуждение
В исследуемой выборке 44,32% пациентов имели ожирение I–III cтепеней. У каждого 2-го пациента диагностировано ожирение I степени и почти у каждого 3-го – II.
По данным Росстата (2021), продолжается рост заболеваемости по классу болезней эндокринной системы, расстройств питания и нарушения обмена веществ (диагноз установлен впервые в жизни – 1927 тыс. в 2018 г. и 2117 тыс. в 2019 г.) [16].
У каждого 5-го (22,73%) пациента с ХСН диагностировали 3–5 болезней, а более половины (61,93%) имели более 5 болезней.
В Резолюции по итогам II Конгресса, посвященного Всемирному дню борьбы с ожирением, подчеркивается необходимость полидисциплинарного подхода к ведению пациентов с ожирением, важность комплексного лечения ожирения как коморбидной патологии [17].
По данным литературы, ожирение является общепризнанным фактором риска как развития, так и прогрессирования ХБП [11].
ХБП-С3–5 до настоящей госпитализации имели 43,59% пациентов с ожирением.
У 29 (37,18%) пациентов с ожирением определялась протеинурия, преимущественно (93,1%) субнефротического уровня. Протеинурия у них может быть следствием не только обусловленной ожирением гломерулопатии, но и проявлением поражения почек при сахарном диабете либо паранеопластической гломерулопатии, а также в результате длительного анамнеза сердечно-сосудистых заболеваний (ИБС, артериальной гипертензии, ХСН).
ОПП диагностировано у каждого 5-го (23,29%) пациента, у пациентов с ожирением преимущественно (63,16%) 2–3-й стадий. Во время госпитализации умерли 2,84% пациентов. У всех умерших развилось ОПП 2-й или 3-й стадии на фоне ХБП-С3–5. По данным литературы, наличие ожирения повышает риск развития ОПП и увеличивает летальность [4–5]. У пациентов с ОПП были выше уровни всех исследуемых биомаркеров (NGAL, цистатин С, NT-proBNP, ST2). Цистатин С может служить предиктором не только ближайшего, но и отдаленного прогнозов ОПП. Так, М. Bell et al. показали, что у пациентов с высокими уровнями цистатина С в сыворотке крови (третий-четвертый квартили) кумулятивная выживаемость в течение 1000 дней была достоверно ниже, чем у больных с меньшими уровнями этого пептида [18]. Пациенты с ожирением статистически чаще госпитализировались с ОДСН. В исследовании A. Yndestad et al., которые наблюдали 150 больных ХСН и 236 с ХСН после острого инфаркта миокарда, уровни s-NGAL тесно коррелировали с клиническими показателями тяжести ХСН и с нейрогормональными нарушениями [19]. Иногда маркер NGAL называют ренальным тропонином [21].
Ожирение и метаболический синдром служат общепризнанным фактором риска развития и прогрессирования ХБП [11]. По нашим данным, наличие ожирения ассоциировано с риском развития ОПП (ОШ=2,269, 95% ДИ: 0,04–129,799) и тяжестью ОПП (ОШ=1,246; 95% ДИ: 0,459–3,386), частотой госпитализации по причине развития ОДСН (ОШ=1,52, 95% ДИ: 0,666–3,472). ОПП встречается примерно у трети пациентов с ОДСН [20].
По данным литературы, частота анемии обратно пропорциональна тяжести ХБП [11]. Анемия 1–3-й степеней нами диагностирована у 39,77% пациентов. ХБП-С3–5 имели 45,45% пациентов. В исследуемой выборке выявлена корреляция между наличием анемии и тяжестью ХБП (R=0,231; р=0,002), выраженностью анемии и тяжестью ХБП (τ=0,224; р=0,001). Российские и международные эксперты для лечения пациентов с повреждением почек, вызванным ожирением, предлагают использовать модификацию образа жизни (низкокалорийная диета с ограничением соли, добавление клетчатки в рацион; физическая активность), ингибиторы РААС (иАПФ, БРА, спиронолактон), ингибиторы SGLT2 и препараты мелатонина, препараты для лечения ожирения (фентермин/топирамат, агонист рецептора глюкагоноподобного пептида 1 – GLP-1R, бупропион/налтрексон и др.), методы бариатрической хирургии [4–5, 17]. Авторы подчеркивают перспективность применения препаратов мелатонина благодаря их влиянию на циркадные ритмы, углеводный и липидный обмены, сердечно-сосудистую систему и почки. В исследованиях необходимо уточнять оптимальные дозы (фармакологические или физиологические) этого гормона для лечения повреждения почек, обусловленного ожирением [5].
Заключение
Диагностическими критериями гломерулопатии, ассоциированной с ожирением, являются значения ИМТ 30 кг/м2 и более с одновременным исключением других заболеваний почек как клинически, так и патоморфологически. Клинически гломерулопатия, ассоциированная с ожирением, проявляется в виде изолированной альбуминурии/протеинурии с почечной недостаточностью или без нее.
К сожалению, не все практикующие врачи обращают должное внимание на наличие и тяжесть ожирения у пациента. При наличии нескольких заболеваний у пациента в целях профилактики полипрагмазии ему не назначают фармакологическое лечение ожирения. Важно в реальной клинической практике применять знания по современным методам лечения ожирения при подборе тактик терапии пациентов с нефрологическими, кардиоваскулярными заболеваниями и метаболическими процессами, чтобы улучшить прогноз и качество жизни.



