Эффективность комбинированной эндокринной терапии в лечении больных HR+HER2- метастатическим РМЖ
В соответствии с российскими и международными клиническими рекомендациями в настоящее время основой лечения больных HR+HER2-метастатическим раком молочной железы (мРМЖ) без висцерального криза является эндокринная терапия [1–4]. Доказано, что добавление таргетных препаратов, в т.ч. ингибиторов циклинзависимых киназ CDK4/6, к гормонотерапии ингибиторами ароматазы или фулвестранту практически в 1,5–2 раза статистически достоверно увеличивает показатели медианы выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ; табл. 1), сохраняет качество жизни больных HR+HER2-мРМЖ.
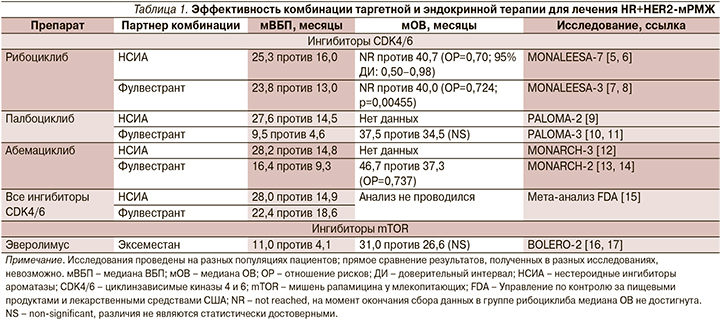
Эффективность системной терапии пациентов c HR+HER2-мРМЖ
Ген PIK3CA кодирует каталитическую субъединицу фермента фосфатидилинозитол-3-киназы (PI3K). В норме PI3K участвует в передаче сигнала от рецепторов ростовых факторов, стимулируя в конечном счете выживание и деление клетки [18, 19].
В клетках опухоли в результате спонтанных мутаций образуется гиперактивная форма PI3K, которая стимулирует пролиферацию в отсутствие внешних стимулов (ростовых факторов и пр.).
Мутация PIK3CA встречается среди 40% пациентов с HR+HER2-мРМЖ и служит фактором неблагоприятного прогноза, т.к. ассоциируется с более агрессивным течением заболевания и худшим ответом на химиотерапию, гормонотерапию и таргетную терапию (ингибиторам CDK4/6 и mTOR) [20–23].
На протяжении 20 лет в клинических испытаниях предпринимались попытки блокировать фермент фосфатидилинозитол-3 киназу (PI3K). Однако всякий раз исследователи сталкивались с проблемой вынужденного прекращения клинических исследований препаратов класса анти-PI3K по причине развития массы побочных эффектов, что связано с важной ролью, которую PI3K играет в поддержании жизнеспособности клеток [24–26]. В результате спонтанных мутаций гена PIK3CA образуется гиперактивная форма фосфатидилинозитол-3 киназы, которая стимулирует пролиферацию злокачественных клеток в отсутствие внешних ростовых факторов.
В исследовании BELLE-2 у пациентов с HR+HER2-мРМЖ с мутацией PIK3CA в опухоли, получавших таргетную терапию бупарлисибом (ингибитор всех изоформ PI3K), медиана ОВ составила 26,0 месяцев против 24,8 месяца в группе плацебо; однако различия не были статистически значимыми (p=0,127). При этом частота нежелательных явлений была существенно выше в группе бупарлисиба. Частота гипергликемии в группе бупарлисиба составила 43% против 8% в группе плацебо, повышения АЛТ – 40% против 7%, повышения АСТ – 38% против 10%, тошноты – 40% против 24% соответственно (анализ общей популяции пациентов с HR+HER2- мРМЖ) [24].
Эффективность таселисиба (ингибитора α-, γ- и δ-изоформ PI3K) была весьма скромной, по мнению исследователей. Медиана ВБП у пациентов с HR+HER2-мРМЖ с мутацией PIK3CA в опухоли, получавших таселисиб с фулвестрантом, составляла 7,4 месяца против 5,4 месяца в группе плацебо с фулвестрантом (ОР=0,70; 95% ДИ: 0,56–0,89; p=0,0037), а нежелательные явления встречались значительно чаще: диарея – 60% против 20%, гипергликемия – 40% против 9%, тошнота – 34% против 24, стоматит – 33% против 9%, сыпь – 25% против 11% соответственно [26].
Разработка селективного ингибитора α-изоформы PI3K впервые позволила достичь баланса эффективности и безопасности терапии пациентов с PIK3CA+HR+HER2-мРМЖ. В исследовании Ib-фазы с включением сведений о 87 пациентах с HR+HER2-мРМЖ показано, что алпелисиб в дозе 300 мг/день в комбинации с фулвестрантом обладает контролируемым профилем токсичности. При этом медиана ВБП составила 9,1 месяца в группе пациентов с мутацией гена PIK3CA против 4,7 у больных без мутации [27].
Позже преимущество алпелисиба у пациентов с мутацией гена PIK3CA было подтверждено в исследовании III фазы, тем самым подтвердив необходимость определения мутации в данном гене при назначении анти-PIK3-таргетной терапии [28].
Диагностика мутации в гене PIK3CA выполняется методами ПЦР или NGS (next generation sequencing, секвенирование нового поколения) с использованием материала как тканевой (определение мутации в ткани первичной опухоли или метастаза), так и жидкостной биопсии (определение циркулирующей опухолевой ДНК в плазме крови). Предпочтение в диагностике мутации в гене PIK3CA отдается тканевой биопсии с помощью ПЦР [28].
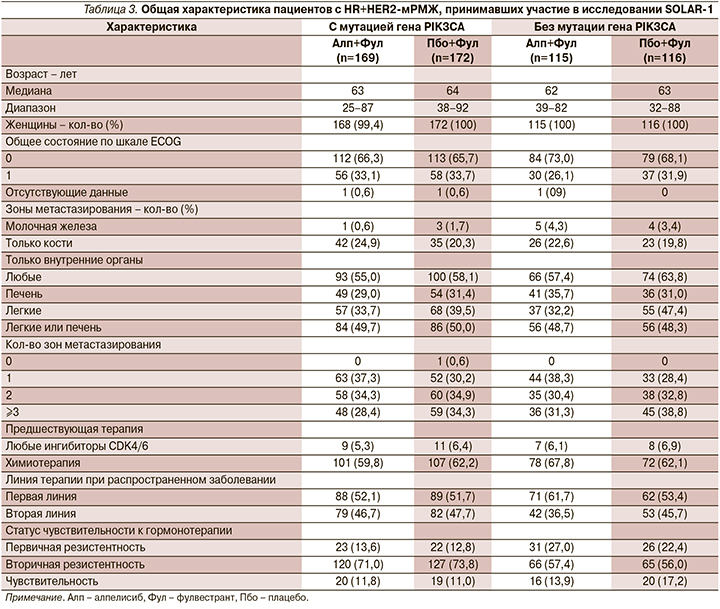
Дизайн исследования SOLAR-1 – рандомизированного плацебо-контролируемого двойного слепого исследования III фазы для оценки эффективности и безопасности алпелисиба в комбинации с фулвестрантом для пациентов с HR+HER2-мРМЖ, ранее получавших эндокринную терапию Исследование SOLAR-1 проводилось в 198 исследовательских центрах 34 стран, включая Российскую Федерацию. Пациенты с HR+HER2-мРМЖ распределялись в две основные когорты в зависимости от наличия мутации гена PIK3CA. Рандомизация больных в обеих когортах осуществлялась в соотношении 1:1.
В исследовательской группе больные получали внутрь алпелисиб ежедневно в дозе 300 мг 1 раз в сутки во время еды (одна таблетка 200 мг и две таблетки по 50 мг) независимо от массы тела в комбинации с фулвестрантом.
В контрольной группе пациентам выдавали плацебо в комбинации со стандартными дозами фулвестранта (500 мг внутримышечно в дни 1 и 15 цикла 1 и далее в день 1 всех последующих 28-дневных циклов).
В каждой группе стратификация проводилась на основании наличия или отсутствия метастазов в легких или печени и предшествующей терапии ингибиторами CDK4/6 (табл. 2, 3). В исследование изначально включали как чувствительных, так и резистентных к эндокринной терапии больных, однако после внесения первой поправки к исследованию набор был ограничен только гормонорезистентными пациентами.

Основные критерии включения и исключения в исследование указаны в табл. 2. Больные получали лечение до прогрессирования заболевания, неприемлемого уровня токсических эффектов, отзыва согласия, утраты контакта для последующего наблюдения или смерти.
C целью коррекции нежелательных явлений разрешалось снижение дозы алпелисиба в соответствии с графиком изменения суточной дозы (с 300 до 250 мг и c 250 до 200 мг). Редукция дозы фулвестранта не допускалась.
Критерии резистентности к эндокринной терапии в исследовании SOLAR-1:
- Первичная резистентность определялась как развитие рецидива в течение 24 месяцев во время проведения пациенту адъювантной гормонотерапии или прогрессирование заболевания в течение 6 месяцев при проведении гормонотерапии по поводу распространенного заболевания.
- Вторичная резистентность определялась как развитие рецидива после проведения по меньшей мере 24 месяцев адъювантной гормонотерапии, рецидива в течение 12 месяцев после прекращения адъювантной гормонотерапии или прогрессирование по меньшей мере через 6 месяцев гормонотерапии для лечения распространенного заболевания.
- Считалось, что пациенты с рецидивом заболевания по меньшей мере через 12 месяцев после завершения адъювантной гормонотерапии, не получавшие терапии распространенного заболевания, имеют гормоночувствительную опухоль.
Конечные точки исследования SOLAR-1
В когорте больных HR+HER2-мРМЖ с мутацией гена PIK3CA в опухоли первичной конечной оценочной точкой была ВБП по оценке исследователей, согласно критериям RECIST (v.1.1).

Ключевой вторичной оценочной конечной точкой в когорте пациентов с мутацией гена PIK3CA в опухоли была ОВ.
Дополнительные вторичные конечные точки включали:
- ВБП без мутации гена PIK3CA в опухоли;
- ОВ в когорте пациентов без мутации гена PIK3CA в опухоли;
- ВБП в зависимости от уровня циркулирующей опухолевой ДНК;
- объективный ответ (ОО);
- клинически значимый ответ (сумма полного, частичного ответов и стабилизации заболевания в течение >6 месяцев);
- безопасность.
До включения в исследование статус когорты определялся централизованно методом ПЦР на основании наличия или отсутствия мутации гена PIK3CA в «горячих точках» – экзонах 7, 9 и 20.
Визуальную оценку (КТ и/или МРТ) выполняли при скрининге в течение 4 недель до рандомизации, каждые 8 недель в течение первых 18 месяцев, затем каждые 12 недель до прогрессирования заболевания или прекращения лечения по любой другой причине. Нежелательные явления регистрировали непрерывно вплоть до 30 дней после приема последней дозы исследуемого препарата.
Эффективность алпелисиба в комбинации с фулвестрантом для пациентов с HR+HER2-мРМЖ с мутацией гена PIK3CA
Применение алпелисиба обеспечивало практически двукратное увеличение ВБП у пациентов с мутацией PIK3CA: медиана ВБП составила 11,0 месяцев (95% ДИ: 7,5–14,5) в группе алпелисиба по сравнению с 5,7 месяца (95% ДИ: 3,7–7,4) в группе плацебо. Сни-жение риска прогрессирования при применении алпелисиба в комбинации с фулвестрантом составило 35% по сравнению с группой плацебо с фулвестрантом (ОР=0,65; 95% ДИ: 0,50–0,85; р<0,001).
Эти результаты подтвердились данными независимой оценки в слепом режиме, при которой медиана ВБП составила 11,1 месяца (95% ДИ: 7,3–16,8) в группе алпелисиба и лишь 3,7 месяца (95% ДИ: 2,1–5,6) в группе плацебо (ОР=0,48; 95% ДИ: 0,32–0,71) [рис. 1].
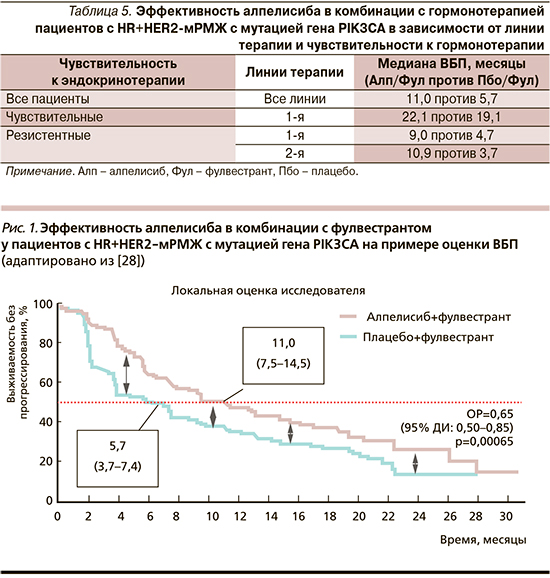
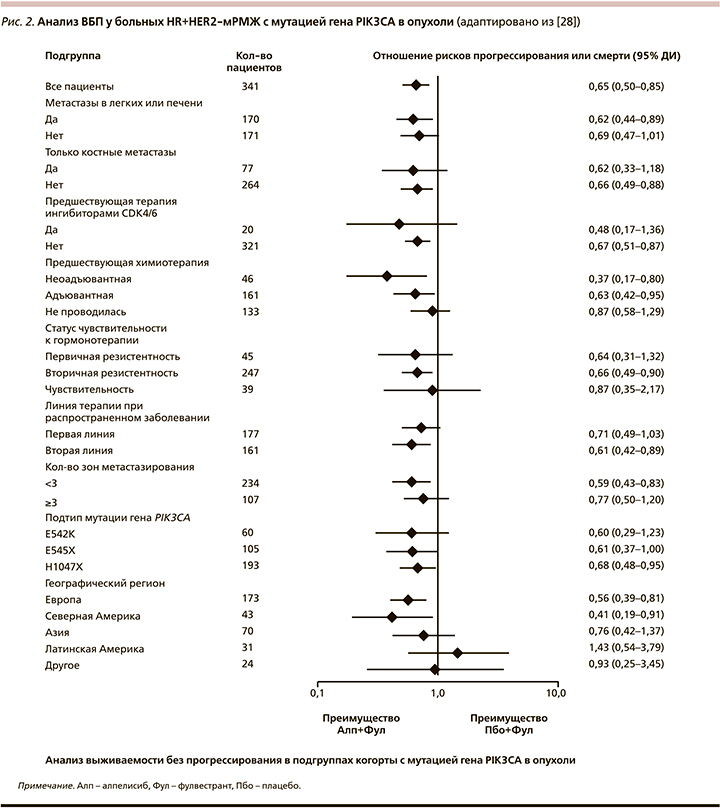
Результаты анализа выживаемости без прогрессирования в соответствии с критериями стратификации и важными демографическими и прогностическими факторами показали устойчивое преимущество комбинации алпелисиба и фулвестранта в заранее определенных подгруппах (рис. 2). Увеличение ВБП показано во всех исследуемых подгруппах независимо от линии системной терапии и типа резистентности к гормонотерапии (табл. 4, 5) [29].
Частота ОО среди всех пациентов с мутацией PIK3CA была выше при применении комбинации алпелисиба и фулвестранта, чем при назначениии комбинации плацебо и фулвестранта (26,6% против 12,8%); клинически значимый ОО был также выше в группе алпелисиба (61,5% против 45,3%) соответственно. Среди пациентов с измеримыми очагами частота ОО составила 35,7% в группе алпелисиба и 16,2% в группе плацебо; доля пациентов с клинически значимым ответом составила 57,1 и 44,1% соответственно.
Наблюдение за когортой пациентов без мутации PIK3CA проводилось с целью проверки концепции. Результаты анализа этой подгруппы показали отсутствие значимых отличий между группами, получавшими алпелисиб с фулвестрантом и плацебо с фулвестрантом (медиана ВБП составляла 7,4 месяца и 5,6 месяца соответственно; ОР=0,85; 95% ДИ: 0,58–1,25).
Профиль безопасности алпелисиба в комбинации с фулвестрантом
Профиль безопасности в исследовании SOLAR-1 был схожим с таковым в предыдущих исследованиях комбинации алпелисиба и фулвестранта (табл. 6).

Гипергликемия – это «таргетная токсичность», которая развивается у больных PIK3CA+HR+HER2- на фоне приема алпелисиба вследствие ингибирования α-изоформы PI3K, регулирующей захват глюкозы клетками в ответ на связывание инсулина со своим рецептором [18]. В исследование SOLAR-1 не включались пациенты с сахарным диабетом 1 типа или с неконтролируемым СД 2 типа (уровень глюкозы в плазме натощак >140 мг/дл [7,7 ммоль/л] или уровень гликозилированного гемоглобина >6,4%). Важно отметить, что «таргетная» гипергликемия на фоне алпелисиба и сахарный диабет имеют различные патогенетические механизмы развития. Сахарный диабет представляет собой хроническое заболевание, в то время как гипергликемия, развивающаяся на фоне приема алпелисиба, разрешается после отмены препарата.
В исследовании SOLAR-1 проведен тщательный мониторинг уровня глюкозы. При повышении уровня глюкозы проведена коррекция дозы, а также назначалась антигликемическая терапия. Подробный алгоритм коррекции гипергликемии представлен в табл. 7.
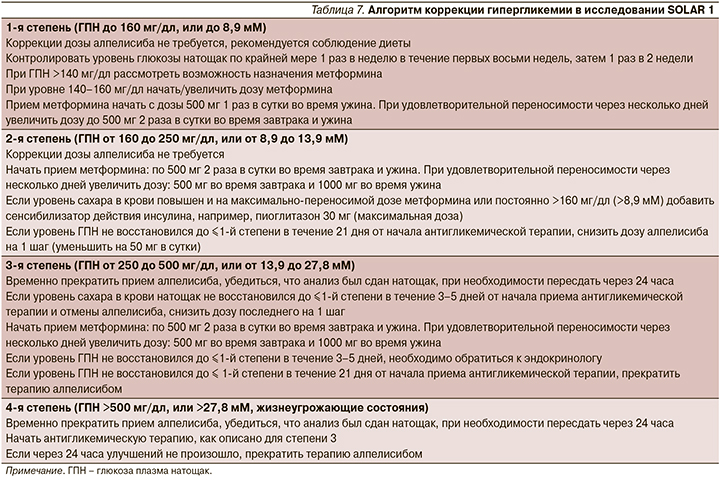
Гипергликемия была причиной окончательного прекращения приема алпелисиба только для 6,3% пациентов.
В целом наиболее часто регистрировались такие нежелательные явления, как гипергликемия, желудочно-кишечная токсичность и сыпь. Побочные явления при применении алпелисиба больными PIK3CA+HR+HER2-мРМЖ, как правило, были предсказуемыми, обратимыми и преимущественно низкой степени.
Заключение
На сегодняшний день определение мутации гена PIK3CA в ткани первичной опухоли или метастаза методом ПЦР позволяет выделить особую группу больных HR+HER2-мРМЖ, которые могут получить наибольшую пользу от молекулярно-направленной анти-PI3K терапии.
В Российской Федерации за 2018 г. зарегистрировано 70 378 новых случаев РМЖ, из которых доля злокачественных новообразований III и IV стадий составила 20,6 и 7,8% соответственно [30]. Высокая частота HR+HER2-опухолей (60%) [31] в сочетании с мутацией PIK3CA (40%) [20] позволяет оценить число пациентов, нуждающихся сегодня в комбинированной гормонотерапии на основе таргетного лечения алпелисибом. Это более 5000 больных HR+HER2-мРМЖ с мутацией PIK3CА в год.
В исследовании SOLAR-1 определен профиль пациентов, для которых назначение алпелисиба жизненно важно. Это пациенты с PIK3CA+HR+HER2-мРМЖ с прогрессированием на предшествующей терапии ингибиторами ароматазы в режиме монотерапии или в комбинации с ингибиторами CDK4/6 с учетом возможной резистентности к гормонотерапии (первичной или вторичной).
В рутинной клинической практике перед планированием лечения больных мРМЖ наряду с оценкой уровня рецепторов эстрогенов, прогестерона и HER2 необходимо определять мутацию гена PIK3CA, учитывая значимую роль этой мутации в патогенезе РМЖ, высокую частоту встречаемости и наличие эффективной биологически направленной таргетной анти-PIK3-терапии.



