В Гамбурге (Германия) 8–9 апреля 2011 г. состоялся 2-й ежегодный Конгресс экспертов, посвященный проблемам диагностики и лечения почечно-клеточного рака (ПКР) – Conference Of Renal cancer Experts (CORE).
Первый день Конгресса
Выступление профессора G. Tortora (Clinical Unit of Medical Oncology, Medical School and University Hospital, Verona, Italy) было посвящено развитию метастатического ПКР и новым стратегиям в лечении этого заболевания. Докладчик отметил, что в настоящее время известны два патогенетических механизма развития заболевания, которые являются мишенью для противоопухолевой терапии. Первый – основан на понимании функции гена VHL, нарушение которой приводит к стимуляции ангиогенеза. Второй – обусловлен воздействием на внутриклеточный путь передачи сигналов посредством mTOR. Препараты антиангиогенной направленности функционируют в просвете сосудов (бевацизумаб) или на уровне мембран клеток (сунитиниб, пазопаниб, сорафениб). Их применение приводит к временной остановке развития опухоли за счет уменьшения васкуляризации. Но затем происходит реактивация ангиогенеза по альтернативным путям передачи сигнала, в частности через фактор роста фибробластов (FGF), и как следствие – развивается резистентность к вышеуказанным лекарственным средствам. В этой ситуации эффективным может оказаться применение “горизонтальной блокады”, т. е. использование препаратов, блокирующих различные виды рецепторов на мембране клетки. Кроме того, возможно воздействие “по вертикальному пути” передачи сигналов с ингибированием мишеней ближе к ядру клетки. Этого можно достичь назначением ингибиторов mTOR (эверолимус, темсиролимус) [1].
Выступление E. Calvo (Centro Integral Oncologico Clara Campal University CEU San Pablo, Madrid, Spain) было посвящено проблеме прогностических факторов [2]. В настоящее время выбор препаратов лечения больных распространенным ПКР основывается на критериях, разработанных в Memorial Sloan-Kettering Cancer Center. Однако эти критерии отражают прогноз заболевания, но не дают ответа в отношении эффективности планируемой терапии. С этой целью продолжаются исследования, результаты некоторых работ позволяют надеяться на внедрение новых прогностических факторов в клиническую практику. В исследовании С. Porta и соавт. [3] было изучено воздействие исходных уровней фактора роста эндотелия сосудов (VEGF) и нейтрофильного желатиназа-ассоциированного липокалина (NGAL) в плазме крови на эффективность терапии сунитинибом. Установлено, что оба маркера имеют статистически значимое прогностическое значение. Медиана времени до прогрессирования (МВДП) у больных с уровнем VEGF < 707 пг/мл составила 11,2 месяца против 4,7 при значении маркера > 707 пг/мл (p = 0,0015). При исходном уровне NGAL < 177 нг/мл МВДП составила 8,15 месяца против 3,35, если регистрировалось повышение данного параметра (p = 0,03). При бивариантном анализе оба фактора сохраняли свое прогностическое значение. Совместный анализ низких уровней изученных маркеров обнаружил более высокую прогностическую значимость, т. е. у больных с низким содержанием VEGF и NGAL МВДП при назначении сунитиниба была достоверно выше. В работе Т.Е. Hutson и соавт. [4] было выявлено, что снижение количества рецепторов второго типа к VEGF через 12 недель после начала терапии пазопанибом коррелировало с ответом на лечение (p = 0,00002). Таким образом, появляются маркеры эффективности препаратов первой линии терапии больных метастатическим ПКР. Последующее изучение критериев прогноза, возможно, позволит выбирать наиболее эффективное лекарственное средство и/или своевременно назначать вторую линию терапии [2–4].
R.A. Figlin (Samuel Oschin Comprehensive Cancer Institute CedarsSinai Medical Center David Geffen School of Medicine University of California, Los Angeles, USA) представил последние результаты работ, посвященных применению VEGFR-направленной терапии больных диссеминированным ПКР [5]. Из новых ингибиторов тирозинкиназ (TKI), изучаемых в клинических испытаниях, были отмечены акситиниб, тивозаниб, довитиниб. Первые два препарата в эксперименте продемонстрировали наиболее эффективное подавление всех трех типов VEGFR. Сравнение проведено среди 12 TKI, в т. ч. с использованием уже зарегистрированных средств для лечения ПКР. Ингибитор TKI довитиниб in vivo обладает более широким спектром действия. Его отличием от других TKI является блокада рецепторов к FGF. Результаты исследований III фазы с использованием вышеуказанных TKI ожидаются в ближайшем будущем. На сегодняшний день повышение эффективности лечения больных распространенным ПКР возможно в случае преодоления резистентности к TKI, которая в случае применения сунитиниба и сорафениба развивается в среднем через 6–11 месяцев. По результатам проспективных исследований II фазы назначение сорафениба после сунитиниба оказалось эффективным не более чем в 9,6 % случаев [6–7]. Было высказано утверждение о развитии перекрестной резистентности к этим препаратам и неэффективности последовательного назначения сунитиниб → сорафениб. Комбинации указанных препаратов с бевацизумабом или цитокинами, или темсиролимусом в исследованиях I–II фаз показали высокую токсичность, вследствие чего их применение ограничено. Таким образом, решить поставленную задачу предлагается последовательным назначением TKI → TKI (с использованием препаратов, обладающих различным спектром мишеней) или TKI → ингибитор mTOR [5–7].
Тема роли ингибиторов mTOR была продолжена в докладе профессора S. Oudard (Oncology Translational Research Unit, Georges Pompidou Hospital, Paris, France) [8]. Приведенные результаты рандомизированного исследования RECORD-1 продемонстрировали, что назначение эверолимуса после TKI увеличивает МВДП по сравнению с плацебо на 4,9 месяца. Более того, эффективность препарата сохраняется и в случае его назначения в третьей линии терапии после последовательного применения двух TKI. Время до прогрессирования при назначении эверолимуса во второй линии составило 5,42 месяца, в третьей линии – 3,78 и 1,87 месяца – в группе плацебо (p < 0,001). На клиническом примере докладчик показал, что последовательное назначение эверолимуса после сунитиниба позволяет остановить прогрессирование заболевания. А за период стабилизации на фоне приема ингибитора mTOR опухолевые клетки вновь становятся чувствительными к TKI. При повторном назначении сунитиниба был зарегистрирован частичный регресс. Другими словами, последовательность TKI → ингибитор mTOR → TKI может являться еще одним вариантом преодоления резистентности к таргетным препаратам.
Темой доклада P.F.A. Mulders (Department of Urology, Radboud University Nijmegen Medical Centre, Nijmegen, The Netherlands) являлась иммунотерапия больных ПКР [9]. Ни одно из исследований по изучению адъювантной терапии больных локализованным и местнораспространенным ПКР не выявило преимуществ в выживаемости при назначении неспецифической иммунотерапии (интерферон альфа, интерлейкин-2). Изучение вакцинотерапии в этой группе пациентов представляется перспективным. В исследовании С. Wood и соавт. (2008) [10] проведено изучение эффективности аутологичной вакцины на основе белков теплового шока (БТШ-96). Назначение БТШ-96 после хирургического лечения позволило увеличить безрецидивную выживаемость в группе больных промежуточного прогноза по критериям Восточной кооперативной онкологической группы (ECOG). В стандартах Европейской ассоциации урологов 2010 г. иммунотерапия как самостоятельный вид лечения для больных распространенным ПКР не значится. Тем не менее цитокины могут быть эффективными для больных светлоклеточным ПКР и с благоприятным прогнозом по шкале MSKCC.
Второй день Конгресса
Заседание началось с докладов A. Ravaud (University Hospital of Bordeaux, Bordeaux, France) и A. Bamias (Medical Oncology Unit, Alexandra Hospital, Athens, Greece), посвященных проблемам безопасности применения таргетной терапии больных метастатическим ПКР с наличием и отсутствием сопутствующей патологии [11–12]. Первый докладчик привел сводные данные по наиболее часто регистрируемым побочным эффектам таргетной терапии (табл. 1). Артериальная гипертензия (АГ) – побочный эффект, характерный для группы TKI. АГ всех степеней тяжести наиболее часто регистрировали при использовании бевацизумаба в комбинации с интерфероном альфа, сунитиниба и пазопаниба: в 26, 24 и 41 % случаев соответственно [13–16]. По мнению автора, все пациенты до начала лечения должны быть обследованы на наличие АГ и при необходимости им следует назначить стандартную антигипертензивную терапию. Обязательной рекомендацией для больных должен стать ежедневный контроль артериального давления дома с ведением дневника пациента. Ранее существовавшая АГ может потребовать корректировки антигипертензивной терапии при лечении таргетными препаратами. При возникновении на фоне лечения неконтролируемой АГ необходима немедленная отмена терапии TKI с последующим возобновлением приема таргетных препаратов при достижении контроля над АГ. В своем выступлении докладчик также сделал акцент на том факте, что побочные эффекты со стороны сердечно-сосудистой системы, связанные с приемом TKI, встречаются чаще, чем регистрируются в клинических исследованиях. Так, по данным М. Schmidinger и соавт., у 25 (34 %) из 74 больных развивались побочные эффекты со сторонысердечно-сосудистой системы, из которых у 12 (48 %) были изменения по данным ЭКГ, а 7 (28 %) – потребовалась интенсивная терапия [17]. По мнению докладчиков, больные с сопутствующей сердечно-сосудистой патологией должны быть обследованы на предмет наличия клинических признаков и симптомов хронической сердечной недостаточности с оценкой фракции выброса левого желудочка и регистрацией ЭКГ до начала и в процессе терапии TKI, в частности сунитинибом. Пациентам с фракцией выброса левого желудочка менее 50 % или с ее снижением более чем на 20 % от начала лечения терапия TKI должна быть отменена или скорректирована в отношении дозировки независимо от наличия клинической симптоматики. Утомляемость – еще один частый побочный эффект, сопровождающий терапию TKI. Утомляемость может быть проявлением как основного, так и сопутствующих заболеваний – анемии, гипотиреоза, депрессии, почечной недостаточности. A. Bamias подчеркнул необходимость постоянного лабораторного контроля функции щитовидной железы у больных с подозрением на гипотиреоз как до назначения TKI, так и в процессе терапии каждые 2 месяца. При необходимости пациентам с гипотиреозом назначают стандартную гормоно-заместительную терапию. Для выявления анемии необходим контроль анализов крови до назначения TKI и в ходе лечения. По усмотрению врача для коррекции анемии могут быть использованы препараты класса эритропоэтинов или переливания крови. При терапии ингибиторами mTOR регистрировали специфичные побочные эффекты, такие как неинфекционный пневмонит, встречавшийся у больных, принимавших эверолимус в 14 % случаев, а темсиролимус – в 29 %. Больным необходимо выполнить компьютерную томографию органов грудной клетки и исследование функции внешнего дыхания при появлении кашля, одышки и подозрении на неинфекционный пневмонит. При снижении функции внешнего дыхания менее чем на 20 % возможно продолжение терапии эверолимусом с осторожностью. В зависимости от степени выраженности пневмонита рекомендуют снижение дозировки препарата до 5 мг или же его полную отмену с назначением курса антибиотиков и кортикостероидов. Метаболические побочные эффекты, характерные для ингибиторов mTOR и препарата эверолимус, включали, в частности, гиперхолестеринемию всех степеней у 77 % больных, гипертриглицеридемию – у 73 % и гипергликемию – у 57 %. Однако частота побочных эффектов 3–4-й степеней была невысокой. По мнению докладчиков, всем больным перед началом и в процессе лечения ингибиторами mTOR необходим контроль гликемического и липидного профилей. Коррекция выявленных изменений необходима при 2-й степени тяжести и выше; она должна включать диету, а при необходимости – стандартные гиполипидемические препараты. В заключение авторы отметили, что своевременная и эффективная терапия побочных эффектов, а также их профилактика являются важным звеном в достижении максимального эффекта лечения [11–17].
Таблица 1. Побочные эффекты всех степеней тяжести, возникающие на фоне таргетнойтерапии TKI при лечении метастатического ПКР [13–16].
В сообщении S. Nеgrier (Comprehensive Cancer Centre, Lyon, France) обсуждались вопросы новых подходов и мишеней в лечении метастатического ПКР [18]. Резистентность, развивающаяся при длительном использовании TKI, привела к поиску альтернативных патогенетических механизмов, воздействие на которые позволило бы снизить резистентность к TKI и увеличить эффективность терапии этими препаратами при несветлоклеточных вариантах ПКР [17]. Одним из них является путь mTOR, участвующий в ангиогенезе с активацией PI-3 и Akt сывороточных/треониновых киназ. Перспективными мишенями стали, кроме того, FGF и его рецепторы FGFR, а также гепатоцитарный фактор роста (HGF). По мнению докладчика, горизонтальная блокада рецепторов различных факторов роста может уменьшать вероятность возникновения резистентности к TKI. Наиболее интересные результаты получены при использовании препаратов довитиниб [19] и BIBF-1120 [20], отличительной особенностью действия которых является блокада рецепторов не только к VEGF и PDGF, но и к FGF, уровень которых повышен при терапии и резистентности к TKI (см. рисунок). В исследованиях I–II фаз с использованием довитиниба подтверждена эффективность препарата для больных метастатическим ПКР: частичный ответ зарегистрирован у 7,8 % больных, стабилизация опухолевого процесса в течение более 2 месяцев – у 56,9 %, а стабилизация в течение более 4 месяцев – у 37,3 % пациентов. Больные, получившие более 3 различных вариантов лечения, составили 65 % от общего числа участников исследования. Из них 80 % получили терапию TKI, 55 % – лечение ингибиторами mTOR и 15 % – цитокинами. Несмотря на это, в указанной группе частичный ответ зарегистрирован у 10 % пациентов, стабилизация опухолевого процесса – у 45 % и прогрессирование заболевания – у 25 %. Высокая эффективность довитиниба продемонстрирована и в группе больных с ранее зарегистрированной неэффективностью TKI и ингибиторов mTOR (табл. 2). При этом МВДП в общей популяции составила 5,5 (1,8–9,2) месяца. В настоящее время проводится исследование III фазы, сравнивающее довитиниб с сорафенибом в 3-й линии терапии после неэффективности TKI и ингибиторов mTOR [18–20].
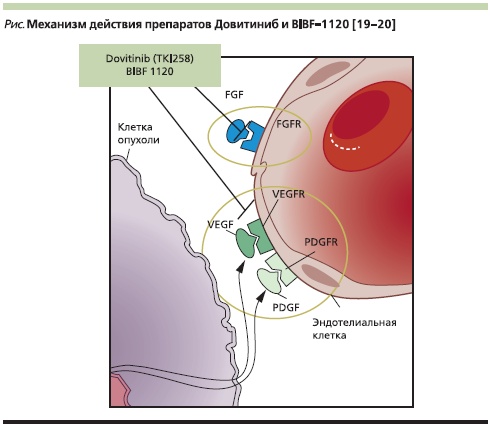
Таблица 2. Эффективность довитиниба в группе больных с неэффективностью TKI и ингибиторов mTOR [19].
J. Bellmunt (Hospital del Mar, Barcelona, Spain) в своем выступлении осветил проводимые и планируемые клинические исследования таргетных агентов [21]. Докладчик представил сводные данные по проводимым исследованиям с применением TKI и ингибиторов mTOR в неоадъювантном и адъювантном режимах. По его мнению, к основным недостаткам предшествующих работ следует отнести отсутствие исследований, предусматривающих сравнение различных препаратов и когорт больных. Среди проводимых и планируемых исследований наиболее интересны испытания по сравнению в первой линии терапии пазопаниба с сунитинибом и тивозаниба с сорафенибом при светлоклеточных вариантах ПКР, а также эверолимуса и темсиролимуса с сунитинибом – при несветлоклеточных вариантах. В исследованиях по изучению терапии второй линии – это сравнение темсиролимуса и акситиниба с сорафенибом. Не менее интересны и проводимые исследования по последовательному применению препаратов: эверолимус/сунитиниб против схемы сунитиниб/эверолимус, сунитиниб/сорафениб против схемы сорафениб/сунитиниб. В заключение докладчик отметил, что текущие исследования, возможно, дадут ответы на вопросы о наиболее оптимальном препарата первой линии или наиболее оптимальной последовательности препаратов в лечении распространенного ПКР, а также о целесообразности проведения неоадъювантной и адъювантной терапии указанной категории больных.
В связи с отсутствием опубликованных результатов завершенных исследований с новыми препаратами 1-й и 2-й линий в настоящее время рекомендации по лечению метастатического ПКР остаются без изменений. В первой линии лечения терапии пациентам со светлоклеточным метастатическим ПКР благоприятного и промежуточного прогноза по шкале MSKCC рекомендованы комбинация бевацизумаба и интерферона альфа, а также сунитиниб и пазопаниб. Препарат темсиролимус рекомендован для лечения светлоклеточного метастатического ПКР неблагоприятного прогноза по шкале MSKCC. Во второй линии терапии после неэффективности цитокинов целесообразно применение сорафениба и пазопаниба. В настоящее время эверолимус является первым и единственным зарегистрированным препаратом лечения пациентов метастатическим ПКР при неэффективности терапии TKI [22–23].
Информация об авторах:
Попов Александр Михайлович – кандидат медицинских наук, старший научный сотрудник отделения
лучевого и хирургического лечения урологических заболеваний с группой брахитерапии рака
предстательной железы, ФГБУ "Медицинский радиологический научный центр" МЗиСР РФ.
Калпинский Алексей Сергеевич – кандидат медицинских наук, врач отделения онкоурологии ФГУ МНИОИ им. П.А. Герцена,доцент кафедры урологии с курсом онкоурологии ФПКМР Российского Университета дружбы народов



