Введение
По сравнению со взрослыми общая заболеваемость злокачественными опухолями у детей относительно невелика. Например, по данным Госкомстата на 2014 г. (http://www.gks.ru), показатель распространенности злокачественных новообразований в 2014 г. составил 2241 случай на 100 тыс. населения (с учетом Крымского федерального округа – 2250 случаев), что выше уровня 2004 г. на 39% (в 2009 г. – 1625 случаев на 100 тыс. населения).
В то же время в 2014 г. заболеваемость среди детей составила примерно 12 случаев на 100 тыс. детей (т.е. почти в 190 раз меньше, чем у взрослых). Тем не менее эта проблема остается весьма актуальной, ведь в России ежегодно выявляется 2,3–2,9 тыс. детей со злокачественными опухолями.
Онкологи неоднократно изучали факторы, которые влияют на развитие злокачественных новообразований у детей и подростков: материнское и отцовское курение до зачатия ребенка, аборты в анамнезе, патологии беременности (токсикоз, отечный синдром, угроза прерывания, внутриутробная гипоксия). Наличие внутриутробной инфекции во время беременности (цитомегаловирусная инфекция, токсоплазмоз, герпес, хламидиоз, микоплазмоз и др.) ассоциировано почти с 10-кратным повышением риска опухолевых заболеваний у детей [1, 2].
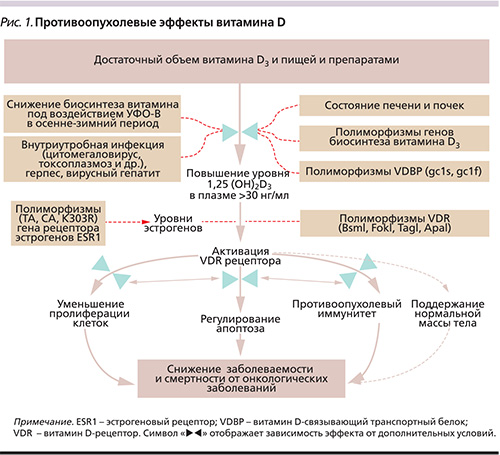
Особую роль в патогенезе опухолевых заболеваний играет дефицит витаминов и микроэлементов, прежде всего недостаточность витамина D. Витамин D – гормон, необходимый для нормального функционирования многих физиологических систем организма, в частности для поддержания противоопухолевой защиты организма. Противоопухолевый эффект витамина D основан на прямом влиянии витамина на транскрипцию более 3000 генов, вовлеченных в регуляцию роста, деления и апоптоза клеток [3]. Поддержка витамином D процессов апоптоза (программированной клеточной смерти) чрезвычайно важна для элиминации опухолевых клеток из организма ребенка с высокой восприимчивостью к опухолевым заболеваниям. На основе системно-биологического анализа противоопухолевых эффектов витамина D была сформулирована модель связи между риском опухолевых заболеваний и витамином D (рис. 1) [4].
Противоопухолевый эффект витамина D3 обусловлен активностью активированного рецептора витамина D3 VDR (vitamin D-receptor), который экспрессируется во многих клетках иммунной системы: моноцитах, макрофагах, Т-лимфоцитах и В-лимфоцитах. Активация транскрипции посредством VDR в этих и других типах клеток имеет антипролиферативный и иммуномодулирующий эффекты [5]. Принимая во внимание, что внутриутробная инфекция служит важным фактором риска опухолевых заболеваний, важно отметить потенцирование витамином D антибактериального и антивирусного иммунитета. В клинической практике было отмечено, что при применении витамина D с целью лечения рахита дети, часто болевшие респираторными заболеваниями, болели существенно реже. Установлена роль витамина D в профилактике и лечении инфекционных заболеваний [6]: хронического ринита и риносинусита [7], гриппа [8], вирусного гепатита С и др.
Говоря о взаимосвязи обеспеченности организма витамином D и риском развития раковых заболеваний, важно подчеркнуть, что повсеместно упоминаемый рефрен «синтез витамина D в коже под действием солнечных лучей» является с практической точки зрения не более чем красивым сценарием фантастического фильма. Однако такого рода фантастический сценарий для профилактики дефицита витамина D у детей не вполне научен, особенно в нашей стране [9].
Действительно, при достаточном облучении открытой поверхности кожи ультрафиолетовым излучением спектра «В» (УФ-В, длина волны 290–315 нм) в мальпигиевом и базальном слоях эпидермиса происходит синтез витамина D3 (холекальциферол) из 7-дегидрохолестерола (превитамин D). Синтез осуществляется в результате неферментативной реакции за счет фотолиза и термической изомеризации 7-дегидрохолестерола. Образовавшийся в эпидермисе холекальциферол связывается с витамин D-связывающим белком и затем поступает в кровоток.
Этот общеизвестный сценарий подтверждается данными достоверных биохимических и клинических исследований. В то же время данный сценарий не является практическим способом компенсации дефицита витамина D в организме ребенка, что особенно очевидно по отношению к России. При сочетании неблагоприятных факторов (недостаточная интенсивность излучения УФ-В, темный цвет кожи, высокая облачность, смог, использование солнцезащитных кремов, гиподинамия и т.д.) синтеза витамина D в коже под действием солнечного излучения практически не происходит [9]. Рассмотрим соответствующие аргументы более подробно.
Во-первых, бо́льшая часть территории России расположена в зоне низкой инсоляции и большинство населенных пунктов характеризуются малым числом солнечных дней в году (40–70 дней).
Во-вторых, для синтеза витамина D необходим не просто солнечный свет, а излучение спектра УФ-В, которое достигает поверхности Земли далеко не во всех регионах страны.
В-третьих, интенсивность УФ-В, достаточная для синтеза витамин D, наблюдается только в определенное время суток (как правило, с 11.00 до 14.00).
В-четвертых, при повышенной облачности, тумане, загрязненности воздуха и др. интенсивность синтеза витамина D3 в коже падает до нуля. Кроме того, солнечный свет спектра УФ-В не проникает через стекло, одежду и солнцезащитный крем, который повсеместно используется для защиты кожи ребенка в летнее время.
В-пятых, активность процесса синтеза витамина D3 в коже находится в обратной зависимости от степени пигментации кожи. Этот хорошо известный факт далеко не всегда полностью осознается. Например, у ребенка с исходно светлой кожей синтез витамина D постепенно падает по мере усиления загара. Все дети с темным цветом кожи составляют особую группу пациентов, у которых синтез витамина D3 в коже минимален и повышен риск дефицита витамина D.
В-шестых, достаточно активный переход синтезированного витамина D из эпидермиса в кровоток происходит только при активной физической нагрузке. Гиподинамия существенно снижает поступление синтезируемого в коже холекальциферола в кровеносное русло. Кроме того, на фоне гиподинамии снижаются эффекты воздействия витамина D на обмен кальция [9].
Поэтому наиболее эффективным методом компенсации дефицита витамина D остается использование специальных препаратов витамина, характеризующихся высокой биоусвояемостью. Сопоставление результатов системно-биологического анализа противоопухолевых эффектов витамина D3 [10] с данными доказательной медицины подтверждает клиническое значение использования дотаций витамина D3 для сокращения заболеваемости раком (все виды рака) [10]. Имеющиеся данные доказательной медицины показывают, что долговременный прием витамина D3 в дозировках 800… 3000 МЕ/сут достоверно снижает риск рака молочной железы [11], толстого кишечника [12] и смертность от всех видов рака.
 Например, мета-анализ 28 наблюдательных исследований показал, что увеличение уровней 25(ОН)D в крови на каждые 10 нмоль/л связано с 6%-ным (95% доверительный интервал [ДИ] – 3–9%) снижением риска рака толстого кишечника [12]. Систематический обзор проспективных исследований взаимодействий между витамином D и риском рака толстого кишечника включил 18 исследований и более 1 млн участников из европейских стран. Самый высокий квартиль потребления витамина D соответствовал снижению риска на 12% (относительный риск [ОР]=0,88, 95% ДИ – 0,80–0,96); самый высокий квартиль уровней 25(ОН) D – снижению риска на 33% (ОР=0,67, 95% ДИ – 0,54–0,80).
Например, мета-анализ 28 наблюдательных исследований показал, что увеличение уровней 25(ОН)D в крови на каждые 10 нмоль/л связано с 6%-ным (95% доверительный интервал [ДИ] – 3–9%) снижением риска рака толстого кишечника [12]. Систематический обзор проспективных исследований взаимодействий между витамином D и риском рака толстого кишечника включил 18 исследований и более 1 млн участников из европейских стран. Самый высокий квартиль потребления витамина D соответствовал снижению риска на 12% (относительный риск [ОР]=0,88, 95% ДИ – 0,80–0,96); самый высокий квартиль уровней 25(ОН) D – снижению риска на 33% (ОР=0,67, 95% ДИ – 0,54–0,80).
Витамин D в виде водного раствора мицелл является одной из перспективных фармакологических форм для длительного применения витамина D. В физической химии мицеллы (от лат. mica – крупинка) – частицы коллоидных систем, образующие мелкодисперсную взвесь в большом объеме растворителя. Мицеллообразование играет ключевую роль для усвоения витамина D из пищевых продуктов и фармакологических препаратов. Мицеллы – наночастицы (10… 1000 нм в диаметре) с «жировой» начинкой, содержащей витамин D, и гидрофильной оболочкой, которая позволяет им равномерно распределяться по всему объему водного раствора. Именно за счет образования мицелл происходит «солюбилизация» витамина D (т.е. перевод витамина в водорастворимую форму за счет образования мицелл) [13].
В настоящей работе исследованы эффекты мицеллированной формы витамина D на рост и метастазирование злокачественных новообразований перевиваемой карциномы легких Льюис (КЛЛ). Выбор модели обусловлен отчасти тем, что заболевания легких являются одними из наиболее часто встречающихся злокачественных новообразований в России: в 2014 г., как и в предшествующие годы, наиболее часто встречались новообразования кожи (14% от числа новых случаев рака), молочной железы (12%) и трахеи, бронхов, легкого (10%) [14]. В качестве препарата витамина D был использован Аквадетрим – водный раствор мицелл, содержащих витамин D.
Материал и методы
Исследования проведены на 50 самцах мышей-гибридов F1 (CBA×C57Bl6) в возрасте 2,5–3,0 месяцев с массой тела 26–29 г. Животные были получены из питомника ФГБУН НЦБМТ ФМБА России (филиал «Андреевка») и имели ветеринарный сертификат. Содержались животные в клетках Т-3 в соответствии с нормами группового размещения [15] в условиях естественного освещения с принудительной 16-кратной вентиляцией при температуре 18–20°C и относительной влажности воздуха 40–70% на подстилке из простерилизованных древесных стружек. Животные имели свободный доступ к питьевой воде и корму и получали стандартный (ГОСТ Р50258-92) брикетированный корм ПК-120-1 (ООО «Лабораторснаб», Россия). Все работы с лабораторными животными были выполнены на основе стандартных операционных процедур, принятых в МРНЦ, соответствующих правилам Европейской конвенции по защите позвоночных животных, используемых для научных целей [16].
В качестве опухолевой модели использована перевиваемая эпидермоидная с КЛЛ, относящаяся к списку опухолевых систем, обязательных к изучению при доклинических исследованиях потенциальных противоопухолевых и антиметастатических средств [17]. Штамм КЛЛ был получен из банка опухолевых материалов ФГБУ РОНЦ им. Н.Н. Блохина и поддерживался на самцах мышей С57BL6j. Для перевивки опухолевую ткань, взятую на 14-е сутки роста, измельчали до гомогенной консистенции, гомогенат фильтровали с помощью нейлонового фильтра с порами 40 мкм, оценивали клеточность суспензии в камере Горяева под микроскопом Olympus (Япония) и доводили средой 199 (Пан-Эко, Россия) до концентрации 1,9×107 кл/мл. Перевивку КЛЛ проводили путем подкожного введения 0,1 мл суспензии (1,9×106 клеток) на внешней поверхности правого бедра.
После перевивки КЛЛ мыши были распределены в три экспериментальные группы – контрольную (20 особей) и две опытные (по 15 особей в каждой). Животные контрольной группы в дальнейшем не подвергались никаким воздействиям. Животным первой опытной группы со 2-х по 20-е сутки после перевивки КЛЛ ежедневно, однократно, интрагастрально вводили раствор Аквадетрима в объеме 0,1 мл на 10 г массы тела (в расчете 5 мкг/кг/сут).
В ходе эксперимента ежедневно оценивали общее состояние животных, их поведенческие реакции, двигательную активность, потребление корма и воды и через каждые 3–4 суток измеряли массу тела подопытных мышей.
Влияние изучаемого препарата на рост и метастазирование КЛЛ оценивали морфологическими методами [10]. Для этого на 7-е, 10, 13, 17 и 21-е сутки после перевивки КЛЛ всем животным проводили измерение линейных размеров опухолевых узлов в ортогональных плоскостях и рассчитывали их объемы в эллиптическом приближении. В дальнейшем проводили статистическую проверку межгрупповых различий объемов опухоли на различных этапах роста и рассчитывали значения индекса торможения роста опухоли.
Животных выводили из опыта на 2-е сутки после перевивки КЛЛ методом цервикальной дислокации под эфирным наркозом. Выделяли легкие, фиксировали их 24 часа в жидкости Буэна и подсчитывали на их поверхности число малых и крупных метастазов. Далее проводили статистическую проверку межгрупповых различий числа легочных метастазов и проводили расчет индекса ингибирования метастазирования.
Начиная с 7–8-х суток экспериментов, когда опухолевые узлы достигали измеряемого размера, каждые 2–3 дня у всех животных измеряли линейные размеры опухолей и рассчитывали их объемы в эллиптическом приближении:
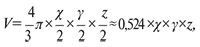
где V – объем опухоли (мм3); χ, γ, z – ортогональные линейные размеры (мм).
В дальнейшем строили кривые опухолевого роста, рассчитывали индексы торможения роста опухоли или индексы их роста на различных сроках наблюдения:
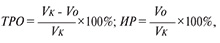
где ТРО – индекс торможения роста опухоли, ИР – индекс роста опухоли, VΚ и Vо – средние объемы опухоли в контрольной и подопытной группах на определенном сроке наблюдения, а также по экспоненциальным кривым роста оценивали длительность задержки роста новообразований, по которым судили о противоопухолевом действии [12].
Выводили животных из опыта на 21-е сутки после перевивки опухоли путем цервикальной дислокации под эфирным наркозом. Выделяли легкие, фиксировали их 24 часа в жидкости Буэна, проводили подсчет числа малых и крупных легочных метастазов КЛЛ и рассчитывали индексы ингибирования метастазирования:
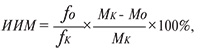
где ИИМ – индекс ингибирования метастазирования, fо, fΚ – доля животных с метастазами в подопытной и контрольной группах, Мо, МΚ – среднее число метастазов в подопытной и контрольной группах [18], по которым судили об антиметастатическом действии изучаемых соединений.
Значимость межгрупповых различий оценивали путем рангового дисперсионного анализа Краскела–Уоллиса с использованием критерия Данна, t-теста, а также с использованием непараметрических критериев А.Н. Колмогорова и Н.В. Смирнова. Во всех случаях различия считали достоверными при p<0,05.
Результаты и обсуждение
Экспериментальное исследование препарата Аквадетрим показало, что подопытные животные с КЛЛ легко переносили препарат. Ежедневное интрагастральное введение препарата Аквадетрим не сопровождалось какими-либо симптомами интоксикации и изменениями в общем состоянии, возбудимости и двигательной активности подопытных животных. Не было установлено и влияния изучаемого препарата на изменение массы тела животных (табл. 1).
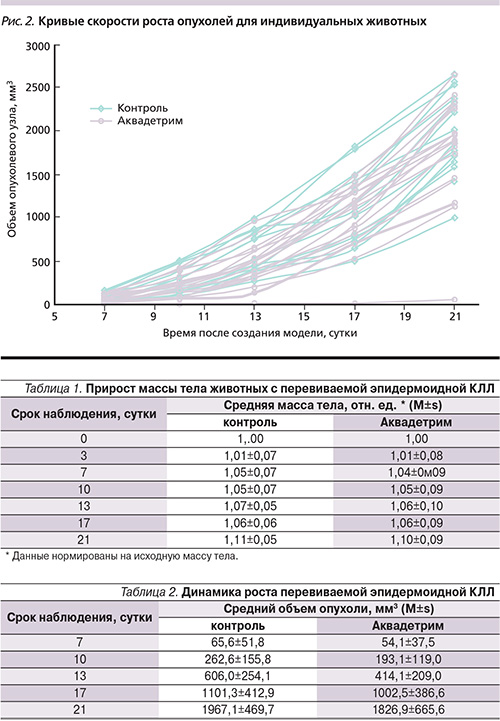
Развитие КЛЛ в контрольной группе в данном эксперименте в целом имело типичный для этой опухолевой системы характер – к 7-м суткам после перевивки опухолевый узел определялся у 100% животных и имел объем 70 мм3. Статистически значимого влияния на рост КЛЛ изучаемый препарат не оказывал на протяжении всей длительности эксперимента (табл. 2).
В то же время следует отметить, что воздействие препарата до 13-х суток развития КЛЛ сопровождалось нарастающей тенденцией торможения роста опухоли – индекс торможения роста опухоли возрастал до 25–30% (табл. 3).
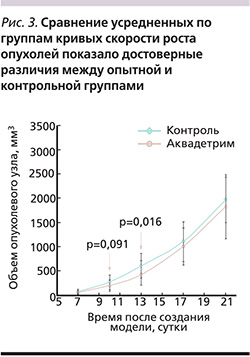
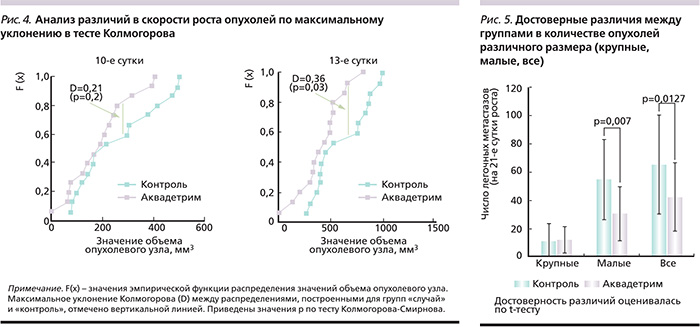
Анализ пучка индивидуальных кривых скорости роста опухолей подтвердил достоверные различия между опытной и контрольной группами до 13 суток (рис. 2).
К 10-м суткам эксперимента отмечена тенденция (р=0,09) к снижению скорости роста опухоли, а к 13-м – достоверное снижение интенсивности роста опухолей (р=0,016; рис. 3).
Достоверность различий в скорости роста опухолей на 13-е сутки была подтверждена и другим статистическим тестом – непараметрическим тестом А.Н. Колмогорова. Значение максимального уклонения (D) между распределениями, построенными для групп «случай» и «контроль», на 13-е сутки составило D=0,36 (что соответствовало достоверным различиям; р=0,033, рис. 4).
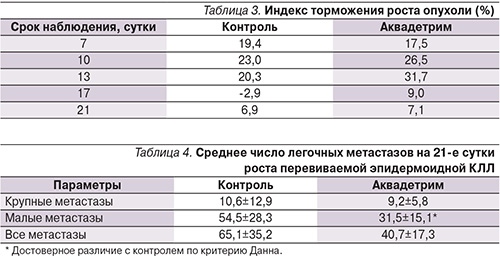
Более выраженным было антиметастатическое действие Аквадетрима (табл. 4). На рост метастазов, как и на рост первичной опухоли, изучаемый препарат не влиял – число крупных метастазов в опытных группах не отличалось от контроля. Вместе с тем в группе животных, получавших Аквадетрим, наблюдались отчетливые признаки подавления процессов метастазирования: статистически значимое снижение числа малых метастазов, индекс ингибирования метастазирования достигал 35–40% (рис. 5).
Выводы
В настоящей работе показано, что пероральное введение препарата Аквадетрим тормозит интенсивность роста перевиваемой КЛЛ и достоверно подавляет процессы метастазирования опухолей этого вида. Антиметастатическое воздействие витамина D, входящего в состав препарата Аквадетрим, вполне закономерно. Считается, что риск развития больше чем одной опухоли связан с факторами окружающей среды, питания и генетики организма [19]. Среди других известных причин – иммунодефицитные состояния, на фоне которых и развиваются вторая и последующие злокачественные опухоли [20].
Витамин D является доказанным стимулятором противоопухолевого иммунитета, который компенсирует иммунодефицитные состояния, способствующие метастазированию.



