Актуальность
Сахарный диабет 1 типа (СД1) является одной из наиболее важных проблем современной клинической медицины. В 2000 г. глобальная оценка взрослых, живущих с диабетом, составляла 151 млн. К 2009 г. она вырослв на 88% – до 285 млн. На сегодня 463 млн человек живут с диабетом. Еще 1,1 млн детей и подростков в возрасте до 20 лет страдают СД1.
В то же время, по данным Всемирного банка, Казахстан занимает 119-е место в мире по распространенности СД, что составляет 6,1%. По данным информационной системы «Национальный регистр "Сахарный диабе"т» Минздрава Республики Казахстан заболеваемость СД в Республике Казахстан за 2018–2020 гг. увеличилась на 12,1%.
В структуре заболеваемости среди всего населения от СД по возрасту на протяжении всего периода наблюдения преобладали взрослые (18 лет включительно) с удельным весом 98,9%, доля детей (от 0 до 14 лет включительно) составила 0,8%, доля подростков (от 15 до 17 лет включительно) – 0,3%.
По оценкам IDF (International Diabetes Federation), к 2030 г. будет 578 млн взрослых людей с СД, к 2045 г. – 700 млн [1]. Результаты исследования NOMAD указывают на необходимость улучшения диагностики СД в нашей стране.
Ведущее место среди специфических осложнений СД занимают поражения почек, приводящие к снижению качестваа, продолжительности жизни, к развитию хронической болезни почек (ХБП) и хронической почечной недостаточности (ХПН) уже в детском возрасте [2]. В связи с этим выявление поражения почек на ранних стадиях СД у детей и предотвращение терминальной почечной недостаточности, требующей заместительной терапии, является одной из актуальных проблем педиатрии. Вместе с тем раннее выявление поражения почек при СД относится к числу нерешенных проблем.
До настоящего времени в литературе недостаточно сведений о характере почечной патологии у детей с СД1. Мало работ по клинико-лабораторным критериям ранней диагностики поражения почек при СД1 у детей с учетом патогенетических факторов [3].
Актуально изучение альбуминурии (АУ) и скорости клубочковой фильтрации (СКФ) у детей и подростков с СД1.
Цель исследования: определить структуру патологии почек и обосновать клинико-лабораторные предикторы ХБП у детей и подростков с СД1.
Материал и методы
Проведен ретроспективный анализ историй болезней 109 детей и подростков с СД1 с поражением почек и дефицитом витамина D. Пациенты подразделены на две группы: основная группа – 75 пациентов с диабетической нефропатией (ДН) и с дефицитом витамина D, в контрольную группу вошли 34 пациента с ДН с нормальными показателями витамина D.
Верификация диагноза ДН проведена в стационаре и включила сбор и оценку жалоб, изучение анамнеза, клиническое обследование пациента, оценку самоконтроля по уровню гликогемоглобина, измерение артериального давления; лабораторное исследование: общий белок, креатинин и мочевина крови, общий анализ мочи на наличие протеинурии, суточный анализ мочи на АУ, СКФ, ультразвуковое исследование (УЗИ) почек. Все пациенты были проконсультированы нефрологом и эндокринологом.
Для оценки СКФ по уровню креатинина использовалась формула Schwartz (2009) [4, 5], (KDIGO, 2012) [6, 7] как наиболее пригодный скрининговый метод в амбулаторной и клинической практике.
Уровень достоверности различий абсолютных частот между группами (по сравнению с контрольной группой) определялся по t-критерию Стьюдента при сравнении относительных величин. Связь между факторным и результативным признаками статистически значима при уровне значимости (p<0,01).
Результаты и обсуждение
Данные клинико-лабораторных исследований представлены в табл. 1–3.
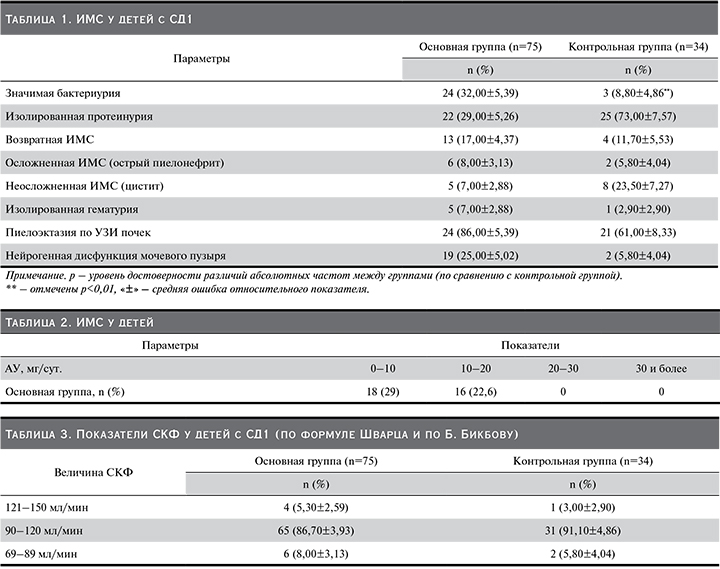
При изучении инфекции мочевой системы (ИМС) у детей с СД1 достоверно чаще встречалась значимая бактериурия 32% в основной группе по сравнению с контрольной – 8,8%. Связь между факторным и результативным признаками статистически значима при уровне значимости p<0,01.
Изолированная протеинурия составила 29% в основной группе, возвратная ИМС – 17%, изолированная гематурия – 7%. Вследствие проводимых лабораторно-диагностических мероприятий на ранних стадиях выявить ДН невозможно, т.к. ранним методом диагностики ДН признано выявление альбуминурии. Стадия альбуминурии – последняя обратимая стадия ДН. У детей на ранних стадиях проведено корректное и своевременное лечение инсулинотерапией, что повлияло на предотвращение развития ДН.
Неоднократно другие ученые заявляли, что одним из перспективных направлений оптимизации диагностики патологии почек при СД служит оценка бактериального воздействия, играющая важную роль в процессах формирования тубулоинтерстициального фиброза и в прогрессировании почечного поражения [8].
При обследовании на альбуминурию 75 детей основной группы в возрасте от 10 до 18 лет с СД1 выявление составило 34 (51,6%) ребенка. В результате в зависимости от уровней АУ все больные были распределены на две группы, что показано в табл. 2.
При обработке статистических данных у большинства (86,7%) детей основной группы выявлены нормальные показатели СКФ, однако настораживает такой факт: у 8,0% детей обнаружена третья стадия ХБП, характеризующаяся умеренным снижением СКФ. Также диагностированы явления гиперфильтрации в основной группе – 5,3% детей, что указывает на напряжение функции почек. В контрольной у 5,8% детей СКФ была менее 69 мл/мин, т.е. были критерии для постановки диагноза ХБП.
Заключение
Целью исследования стала демонстрация ранних не только клинических, но и лабораторных признаков для того, чтобы своевременно выявить ту или иную патологию почек при СД1.
Таким образом, одновременная оценка основных показателей – СКФ и АУ – необходима для первичной диагностики ренальной дисфункции, а также для контроля терапии, скорости прогрессирования патологического процесса и определения прогноза. В соответствии с классификацией National Kidney Foundation (2007) 8,0% детей с патологией ИМС имели С2стадию ХБП, соответствующую начальному или умеренному снижению ренальной функции [9].
Другие ученые, проводившие исследования в этой области знаний, также установили, что основным критерием ДН, определяющим ее стадию, следует считать СКФ.
Для практического здравоохранения необходимо разработать клиническое руководство по ранней диагностике ДН, которое позволит уменьшить развитие ХПН у детей и подростков, страдающих СД1.



