Введение
Внебольничная пневмония (ВП) – заболевание, возможные клинические проявления которого «простираются» от легких симптомов, которые можно спутать с простудой, до жизнеугрожающего недуга, требующего неотложной госпитализации в ОИТ, продолжает оставаться одной из ведущих причин заболеваемости и смертности в мире [1, 2]. Но не только эпидемиологическая значимость определяет актуальность ВП. Пневмония представляет собой пример глубокой и до настоящего времени недостаточно изученной проблемой взаимодействия двух миров – макро- и микроорганизмов, приспосабливающихся друг к другу и в отдельных случаях конкурирующих за выживание. В отличие от иных областей интернологии уникальность лечения инфекционных заболеваний заключается в необходимости уничтожения живого организма. Естественно, что последствия противодействия соответствующим лечебным вмешательствам не заставляют себя долго ждать и вслед за применением антибиотика неотступно как тень следует лекарственная устойчивость, ограничивающая возможности антибактериальной терапии (АБТ) [3].
Принимаемое в прошлом решение о начале или прекращении АБТ при любом инфекционном заболевании, в т.ч. и при ВП, основывалось исключительно на предшествовавшем опыте врача, но не на выводах исследований, признававших тот или иной лечебный подход наиболее эффективным и безопасным. Отсюда и существовавшая вплоть до недавнего времени вариабельность терапевтических решений, в итоге побудившая к созданию согласительных рекомендаций по ведению больных таким распространенным заболеванием, как ВП [4].
С начала 1990-х гг. начинаются интенсивная разработка, популяризация и внедрение в повседневную клиническую практику основанных на принципах доказательной медицины рекомендаций, представляющих собой своеобразный свод рациональных, экономически обоснованных лечебно-диагностических и профилактических мероприятий [5, 6]. Не обошла эта тенденция стороной и Российскую Федерацию, где с 2003 г. экспертами Российского респираторного общества (РРО) и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) создаются, пересматриваются и обновляются соответствующие рекомендации по ведению ВП у взрослых [7–11].
Сегодня с трудом можно найти страну, которая не была бы вовлечена в этот по сути глобальный процесс по разработке соответствующих национальных рекомендаций [12–27], некоторые из которых de facto приобрели статус общепризнанных международных стандартов. К ним можно без преувеличения отнести и согласительные рекомендации ATS/IDSA, вышедшие в свет в 2019 г. [28], спустя 12 лет после предыдущей версии подобного документа [29].
Ниже мы предлагаем вам ознакомиться с основными положениями новой редакции согласительных рекомендаций ATS/IDSA [29] по ведению взрослых больных ВП, которые при необходимости будут сопровождаться краткими комментариями.
Вопросы и ответы
Вопрос № 1: следует ли бактериоскопию и культуральное исследование респираторных образцов проводить всем больным ВП?
Американские эксперты указывают на следующие аргументы, обосновывающие установление этиологии ВП: а) возможность выделения культуры лекарственноустойчивого возбудителя; б) возможность деэскалации АБТ; в) выделение культуры отдельных микроорганизмов, значимых для общественного здоровья (например, Legionella spp.); г) целенаправленная коррекция АБТ в случаях ранней терапевтической неудачи; д) постоянно меняющаяся эпидемиология ВП, требующая постоянного изучения и оценки.
При этом выделяют несколько целевых групп пациентов, которым указанные исследования безусловно показаны (речь идет только о госпитализированных больных); а) больные с тяжелым течением ВП, особенно интубированные; б) больные ВП, получающие эмпирическую АБТ, активную в отношении MRSA (метициллинорезистентный Staphylococcus aureus) или Pseudomonas aeruginosa; в) больные ВП, кто ранее был инфицирован MRSA или P. aeruginosa, особенно если имела место соответствующая инфекция нижних дыхательных путей; г) больные ВП с историей госпитализации и парентеральной АБТ за последние 90 дней.
Сходны и показания к исследованиям гемокультуры.
В противоположность этому в обсуждаемом документе указывается на нецелесообразность микробиологических исследований респираторных образцов амбулаторных больных ВП. Это положение подкрепляется многочисленными свидетельствами отсутствия влияния результатов бактериоскопии/культурального исследования мокроты на эффективность АБТ у данной категории пациентов [30–32]. По той же причине американские эксперты считают неоправданным широкое применение методов микробиологического исследования у больных ВП, не отвечающих вышеприведенным критериям [33, 34].
Комментарий. Позиция российских экспертов [11] схожа, но не идентична американской. Соглашаясь с тем, что амбулаторным больным ВП микробиологические исследования не рекомендуются ввиду их недостаточной информативности и отсутствия существенного влияния на тактику лечения и прогноз, они рекомендуют их проведение каждому госпитализированному пациенту.
Но в чем мнение авторов американского и российского документа совпадает, так это в признании того факта, что нередко плохое качество мокроты/бронхиального секрета существенно ограничивает возможности управления результатами АБТ.
Вопрос № 2: следует ли при диагностике ВП проводить тесты с определением в моче растворимых антигенов Legionella pneumophila и Streptococcus pneumoniae?
Американские эксперты сдержанно относятся к перспективе широкого использования иммунохроматографических экспресс-тестов с определением легионеллезной и пневмококковой антигенурии, ссылаясь при этом на результаты исследований, свидетельствующих об отсутствии различий в эффективности эмпирической и целенаправленной (т.е. основанной на результатах экспресс-тестов) АБТ больных ВП (схожие показатели госпитальной летальности, частоты перевода пациентов в ОИТ, длительности госпитализации и продолжительности лечения) [35, 36].
Предлагается ограничить их использование конкретной эпидемиологической ситуацией (вспышечная или групповая заболеваемость; недавнее путешествие), что позволяет заподозрить легионеллез, а также случаями тяжелой ВП.
Комментарий. Позиция российских экспертов идентична.
Вопрос № 3: следует ли при решении вопроса о целесообразности лечения в палатном отделении или в ОИТ полагаться только на клинические данные или наряду с ними использовать шкалы оценки прогноза?
Это один из вопросов, ответ на который не претерпел никаких изменений по сравнению с североамериканскими рекомендациями 12-летней давности [29]: в новой версии документа указывается на необходимость неотложной госпитализации в ОИТ больных ВП, нуждающихся в вазопрессорной или респираторной поддержке/механической вентиляции («большие» критерии). Если же необходимость в подобных вмешательствах отсутствует, следует проанализировать наличие т.н. малых критериев (табл. 1).
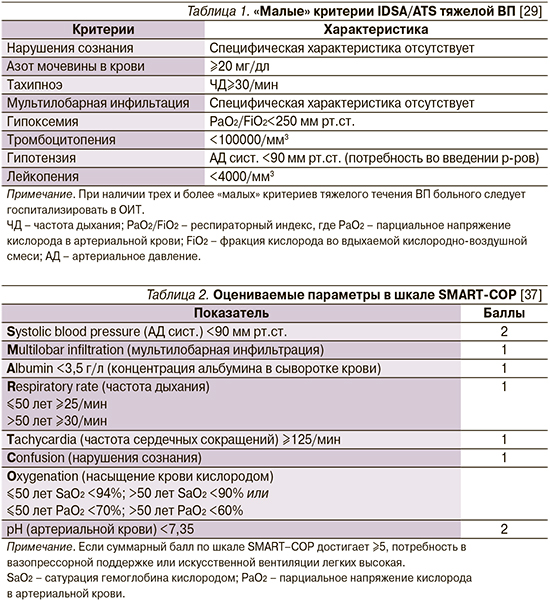
Комментарий. Согласно рекомендациям РРО/МАКМАХ (2018), в отношении госпитализированных пациентов с ВП для оценки тяжести и определения показаний к госпитализации в ОИТ следует использовать «большие» и «малые» критерии IDSA/ATS (2007) [29] или шкалу SMART-COP (табл. 2).
Вопрос № 4: Какую эмпирическую АБТ следует рекомендовать при лечении больного ВП в амбулаторных условиях?
Логика выбора эмпирической АБТ больных ВП в амбулаторных условиях, изложенная на страницах рекомендаций ATS/IDSA (2019), во многом совпадает с таковой, представленной в предыдущей версии документа (табл. 3).
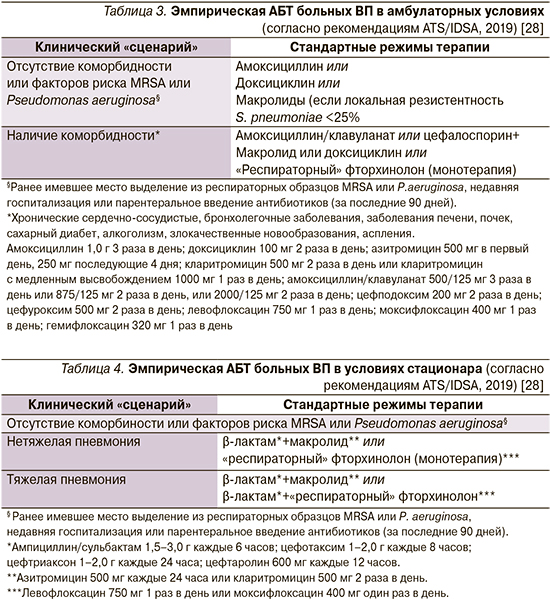
Комментарий. Как и их американские коллеги, российские эксперты предлагают учитывать известные факторы риска «встречи» с лекарственноустойчивыми/проблемными возбудителями ВП (сопутствующие заболевания, предшествовавшая АБТ и др.; рис. 1). Сходным оказывается и настороженное отношение к назначению макролидов в регионах с высокой распространенностью (>25%) изолятов S. pneumoniae, резистентных к эритромицину (для РФ такими регионами являются Москва, Санкт-Петербург, Хабаровск [38]). Вместе с тем имеются и различия. Они касаются отсутствующего в российских рекомендациях доксициклина (ввиду сохраняющейся в нашей стране высокой устойчивости пневмококка к тетрациклинам (>33% [39]) и избегания комбинированной АБТ (недостаточные доказательства превосходства комбинации β-лактамов с макролидом или доксициклином над монотерапией β-лактамами амбулаторных больных ВП с факторами риска терапевтической неудачи).
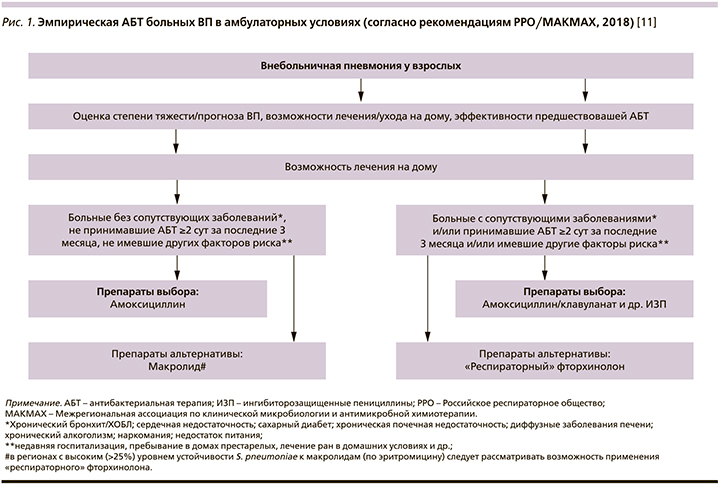
Вопрос № 5. какую эмпирическую антибактериальную терапию следует рекомендовать при лечении больного ВП в условиях стационара?
Принципиальных изменений в подходах к эмпирической АБТ больных ВП в стационаре не произошло. По-прежнему в качестве оптимальных терапевтических стратегий предлагаются комбинация β-латама и макролида или монотерапия «респираторным» фторхинолоном (в условиях палатного отделения) и комбинации β-лактам+макролид или β-лактам+«респираторный» фторхинолон (в условиях ОИТ; табл. 4).
В тех же случаях, когда у пациента имеются факторы риска (см. табл. 3) или доказательства инфицирования MRSA или P. aeruginosa, рекомендуется соответствующая анти-MRSA1 и антипсевдомонадная терапия2.
Комментарий. В подходах американских и российских экспертов к выбору эмпирической АБТ госпитализированных больных ВП существуют определенные различия. Так, в частности, в рекомендациях РРО/МАКМАХ-2018 [11] указывается на возможность применения широкого круга антибиотиков – ампициллина, ингибиторозащищенных аминопенициллинов, цефалоспоринов с высокой антипневмококковой активностью (цефотаксим, цефтриаксон, цефтаролин), эртапенема, «респираторных» хинолонов (рис. 2).
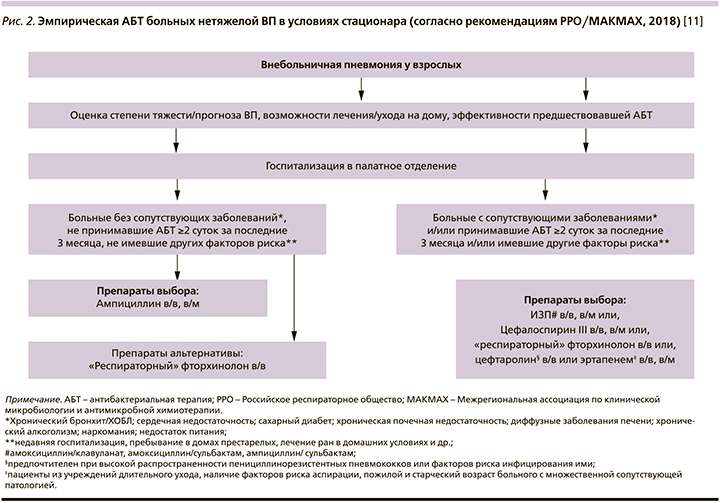
Стратификация пациентов аналогичная таковой для амбулаторных больных, принимает во внимание спектр потенциальных возбудителей, факторы риска инфицирования полирезистентными патогенами, а выбор препаратов учитывает потенциальное экологическое влияние разных режимов АБТ и их затратную эффективность в РФ. Несмотря на различия в спектре активности in vitro, рекомендованные режимы АБТ данной категории пациентов обладают сопоставимой эффективностью [40, 41]. В регионах с высокой распространенностью пенициллинрезистентных пневмококков (ПРП) при наличии индивидуальных факторов риска инфицирования ПРП определенные преимущества может иметь цефтаролин [42].
У пожилых пациентов с множественной сопутствующей патологией и высоким риском неблагоприятного прогноза при наличии факторов риска аспирации, у обитателей домов престарелых можно ожидать более высокую эффективность при назначении эртапенема [43].
Несмотря на демонстрируемые в ряде когортных проспективных и ретроспективных исследований определенные преимущества комбинации «β-лактам+макролид» по сравнению с монотерапией β-лактамными антибиотиками госпитализированных пациентов с нетяжелой ВП, по мнению авторов обсуждаемого проекта рекомендаций РРО/МАКМАХ [11], рутинное назначение комбинированной АБТ нецелесообразно в связи с риском селекции антибиотикорезистентности.
Вопрос № 6: какова оптимальная продолжительность АБТ больных ВП при лечении на дому и в стационаре?
В новых рекомендациях ATS/IDSA-2019 [28] указывается, что больные, у которых в ближайшие 48–72 часа достигнуто клиническое улучшение (клиническая стабильность), могут продолжать лечение в общей сложности в течение 5 дней. В случаях же предполагаемой или доказанной MRSA- или P. aeruginosa-инфекции лечение следует продолжать в течение 7 дней.
Комментарий. В ответе на этот вопрос их российские коллеги менее определенны. Они считают, что оптимальная продолжительность АБТ при ВП до настоящего времени не установлена и зависит от различных факторов: возраста, сопутствующих заболеваний, наличия осложнений, скорости «ответа» на стартовое лечение и др. [11]. При этом формулируются своего рода «целевые» критерии клинической стабильности, которые следует учитывать при решении вопроса о прекращении АБТ: а) стойкое снижение температуры тела <37,2ºС в течение не менее 48 часов; б) отсутствие интоксикационного синдрома; в) частота дыхания <20/мин (у пациентов без хронической дыхательной недостаточности); г) отсутствие гнойной мокроты (за исключением пациентов с ее постоянной продукцией); д) количество лейкоцитов в крови <10×109/л, нейтрофилов <80%, юных форм <6%.
Вопрос № 7: следует ли больным ВП с достигнутым клиническим улучшением (выздоровлением) проводить контрольное рентгенологическое исследование органов грудной клетки?
Ответ американских экспертов для большинства их российских коллег может показаться неожиданным. Они считают, что больным ВП, в отношении которых наблюдается разрешение клинических симптомов в течение ближайших 5–7 дней, нецелесообразно проведение контрольного рентгенологического исследования. Аргументируя это положение, авторы рекомендаций ATS/IDSA-2019 [2] ссылаются, в частности, на исследование, предполагавшее длительное наблюдение за больными (преимущественно пожилыми курящими/курившими мужчинами), перенесшими ВП. В этом исследовании в среднем через 297 дней в 9,2% случаев был установлен диагноз рака легкого, однако только у 27% этих пациентов злокачественное новообразование было диагностировано в течение первых 90 дней после выписки из стационара [44]. Полученные данные свидетельствуют о невысокой диагностической ценности повторной рентгенографии органов дыхания как инструмента онкологического скрининга в ходе проспективного наблюдения за реконвалесцентами ВП.
Комментарий. Подобный подход вряд ли можно считать приемлемым в РФ в силу распространенности туберкулеза органов дыхания и сохраняющегося у немалой части россиян (≈40%) пристрастия к табакокурению. При этом российские эксперты подчеркивают, что длительность обратного развития инфильтративных изменений в легких может различаться в широких пределах, но обычно составляет 3–4 недели. Контрольное рентгенологическое исследование в эти сроки позволяет выявлять нормальную картину или остаточные изменения в легких в виде локальных участков уплотнения легочной ткани или деформации легочного рисунка.

Заключение
Завершая краткий анализ новых рекомендаций ATS/IDSA-2019 [28], можно заключить, что содержащиеся в них отдельные положения лишь в минимальной степени отличаются от таковых, высказанных в 2007 г. (табл. 5). А значит, ключевые подходы к диагностике и лечению ВП у взрослых, сформулированные в начале XXI в., остаются актуальными и в наши дни.



