Анализ современных данных позволяет считать, что модификация образа жизни и снижение веса служат терапией первой линии неалкогольной жировой болезни печени (НАЖБП). Для лечения НАЖБП рекомендуют снижение калорийности диеты (уменьшение на 500–1000 ккал в день по сравнению с привычным режимом), увеличение в составе рациона количества продуктов, содержащих ω-3 полиненасыщенные жирные кислоты (морепродукты), и снижение доли рафинированных углеводов, систематическое применение физических упражнений средней интенсивности и в целом повышение физической активности, снижение веса в случае его избыточности на 7–10% от начальных величин. Принципиальное значение имеет изменение поведенческих стереотипов, которые должны способствовать формированию здорового образа жизни.
Неалкогольная жировая болезнь печени (НАЖБП) – одна из основных проблем здоровья населения из-за высокой распространенности и риска прогрессирования в цирроз и рак печени, а также ассоциации с заболеваниями сердечно-сосудистой системы и онкологической патологией [1, 2]. НАЖБП представляет собой широкий спектр патологических процессов – начиная от стеатоза и стеатогепатита до фиброза и цирроза [3]. В связи с этим в последнее время появились новые международные консенсусы по НАЖБП в Европе [4], США [5], Азии [6] и России [7], которые уделяют принципиальное внимание модификации питания и образа жизни.
Избыточная калорийность пищи – один из ведущих факторов риска НАЖБП [8]. Важное значение имеет не только чрезмерная калорийность диеты, но и частота питания. В 6-недельном рандоминизированном контролируемом исследовании к увеличению содержания жира в печени приводило присутствие перекусов, тогда как относительно редкое по частоте гиперкалорийное питание не сопровождалось патологическими изменениями [9]. В положении 20 нового американского руководства содержатся рекомендации по снижению калорийности питания лицам с НАЖБП на 500–1000 ккал в сутки [5].
Общеизвестно, что липидный метаболизм тесно связан с развитием различных заболеваний [10, 11]. Экспериментальные исследования показали, что диета с ω-3 полиненасыщенными жирными кислотами (ПНЖК) увеличивает чувствительность к инсулину, уменьшает содержание внутрипеченочных триглицеридов и улучшает течение стеатогепатита [12]. Эпидемиологические работы демонстрируют низкое потребление ω-3 ПНЖК и высокое соотношение ω-6/ω-3 ПНЖК у пациентов с НАЖБП и неалкогольным стеатогепатитом по сравнению с контролем [13]. Вместе с тем существует исследование, показавшее способность ω-6 ПНЖК понижать количество жира в печени [14]. Доказательная база, верифицирующая снижение содержания жира в печени в результате приема ω-3 ПНЖК, весьма значительна, но подобные выводы не подтверждены для влияния на течение стеатогепатита и фиброза печени [15, 16].
Европейские рекомендации 2016 г. содержат однозначный вывод о положительном влиянии средиземноморской диеты на течение НАЖБП [4]. Подобная точка зрения поддерживается в новом американском руководстве [5]. В азиатском руководстве по НАЖБП 2018 г. представлен осторожный взгляд на целесообразность новых исследований по этой проблеме [6]. Традиционная средиземноморская диета характеризуется высоким потреблением оливкового масла, орехов, фруктов, овощей и рыбы, в результате чего 40% калорий приходятся на производные мононенасыщенных и ω-3 ПНЖК. Средиземноморская диета также характеризуется сокращением потребления сахаров и рафинированных углеводов. Отношение к употреблению алкоголя, который является типичным компонентом средиземноморской диеты, остается в настоящее время неясным [17]. Следует учитывать, что употребление алкоголя увеличивает риск гепатоцелюлярной карциномы у пациентов с неалкогольным стеатогепатитом [18].
В ряде исследований показано, что употребление подслащенных напитков ассоциировано с развитием НАЖБП [19]. Фремингеймское кардиологическое когортное исследование, которое включало поперечный анализ жировой инфильтрации печени путем томографии у 2634 человек и измерение активности АЛТ у 5908 участников, выявило дозозависимую ассоциацию между употреблением безалкогольных подслащенных напитков и жировой болезнью печени [20]. В европейском проспективном исследовании риск рака печени увеличивался на 43% при суточном потреблении 50 г сахара [21].
Несмотря на наличие очевидных доказательств связи оксидативного стресса с неалкогольным стеатогепатитом, работы по изучению эффективности антиоксидантной терапии весьма немногочисленны. Лечебное действие антиоксидантов доказано только в отношении высоких доз витамина Е [22]. Возможность применения витамина С для терапии НАЖБП заслуживает внимания и продолжает изучаться [23].
В последнее время активно развивается идея, согласно которой изменение питания должно сопровождаться модификацией образа жизни и снижением веса для достижения оптимальных результатов терапии НАЖБП.
В оценке поведения людей выделяют образ жизни, физическую активность (неструктурированная, незапланированная активность) и упражнения (целенаправленная активность). Разделение статичного поведения и физической активности обусловлено их различным влиянием на метаболические процессы [24]. Сидячий образ жизни, сопровождающийся времяпрепровождением у телевизора больше 3 часов, ассоциирован с увеличением общей смертности от всех причин [25]. В одном из когортных исследований показано, что сидячий образ жизни служит независимым фактором риска НАЖБП [26]. Поперечные исследования продемонстрировали, что пациенты с НАЖБП имеют более низкий уровень физической активности [27]. Необходимо заметить, что описан поведенческий фенотип «тройного удара», состоящий из сидячего образа жизни, низкой физической активности и плохой диеты [28].
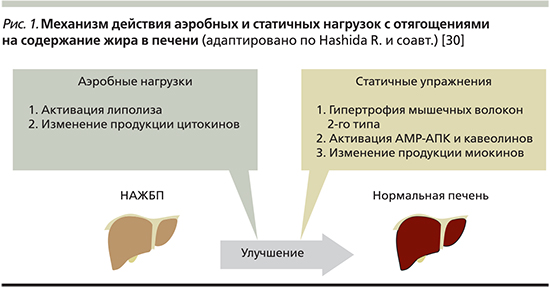
В настоящее время нет сомнений, что физические упражнения ассоциированы с уменьшением количества жира в печени [29]. В современном систематическом обзоре были отобраны для анализа 13 работ по влиянию аэробных физических нагрузок и 4 протокола по действию статичных физических упражнений с отягощениями на течение НАЖБП. Авторы пришли к заключению, согласно которому статичные упражнения не уступают аэробным нагрузкам по способности снижать содержание жира в печени и требуют меньших затрат энергии [30]. Механизм действия аэробных нагрузок по уменьшению количества жира в печени заключается в активации липолиза в различных тканях, включая жировую ткань. Статичные упражнения с отягощениями приводят к гипертрофии мышечных волокон 2-го типа, характеризующихся быстрым метаболизмом глюкозы, и регулируют выделение ключевых молекул, определяющих внутриклеточную чувствительность к инсулину, включая АМР-активированную протеинкиназу и кавеолины [31]. Схематично механизм действия аэробных и статичных упражнений показан на рис. 1. Вместе с тем следует подчеркнуть, что влияние физических нагрузок на содержание жира в печени считается доказанным, но действия упражнений на течение неалкогольного стеатогепатита и гистологическую картину печени пока не установлено [5].
Влияние снижения веса на течение НАЖБП в настоящее время хорошо документировано [32]. K. Promrat и соавт. и E. Vilar-Gomez и соавт. продемонстрировали, что снижение веса на 7% и более не только уменьшает количество жира в печени, но и снижает выраженность воспаления и фиброза в этом органе [33, 34]. В связи с этим снижение веса на 7–10% рассматривается в современных европейском и американском руководствах как важная цель для лечения пациентов с НАЖБП [4, 5].
M. Romero-Gómez и соавт. справедливо отмечают, что изменение образа жизни, снижение веса представляют собой труднореализуемую задачу [24]. Неоднократно устанавливалось, что снижение веса в результате изменений диеты является максимальным в течение 6 месяцев, после чего нередко происходит его восстановление [35].
В связи с этим важно не только решать частные задачи по изменению диеты, повышению физической активности и снижению веса, но в целом менять поведенческие стереотипы пациента. На рис. 2 показано направление необходимых изменений в поведении пациента с НАЖБП. Целесообразно не только декларировать намерения, но и разрабатывать конкретные планы модификации образа жизни и контролировать характер изменений. Врач и пациент должны понимать, что подобная работа должна быть постоянной.

Заключение
Современные европейские [4], американские [5], азиатские [6] и российские [7] руководства содержат рекомендации по модификации образа жизни, повышению физической активности и снижению веса у пациентов с НАЖБП в качестве терапии первой линии. Рекомендации включают снижение калорийности диеты (уменьшение на 500–1000 ккал в день по сравнению с привычным режимом), увеличение в рационе количества продуктов, содержащих ω-3 ПНЖК (морепродукты) и снижение доли рафинированных углеводов, систематическое применение физических упражнений средней интенсивности и повышение физической активности в целом, снижение веса в случае его избыточности на 7–10% от начальных величин. Принципиальное значение имеет изменение поведенческих стереотипов, которые должны способствовать формированию здорового образа жизни.
1. Younossi Z.M., Koenig A.B., Abdelatif D., Fazel Y., Henry L., Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64(1):73–84.
2. Маев И.В., Цуканов В.В., Лукичева Э.В., Самсонов А.А., Васютин А.В., Никушкина И.Н. Распространенность, патогенез и принципы лечения неалкогольной жировой болезни печени. Фарматека. 2011;12:12–5.
3. Chalasani N., Younossi Z., Lavine J.E., Diehl A.M., Brunt E.M., Cusi K., Charlton M., Sanyal A.J. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology. 2012;55(6):2005–23.
4. Marchesini G., Day C.P., Dufour J.F., Canbay A., Nobili V., Ratziu V., Tilg H., Roden M., Gastaldelli A., Yki-Järvinen H., Schick F., Vettor R., Frühbeck G., Mathus-Vliegen L. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J. Hepatol. 2016;64(6):1388–402.
5. Chalasani N., Younossi Z., Lavine J.E., Charlton M., Cusi K., Rinella M., Harrison S.A., Brunt E.M., Sanyal A.J. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018;67(1):328–57.
6. Chitturi S., Wong V.W., Chan W.K., Wong G.L., Wong S.K., Sollano J., Ni Y.H., Liu C.J., Lin Y.C., Lesmana L.A., Kim S.U., Hashimoto E., Hamaguchi M., Goh K.L., Fan J., Duseja A., Dan Y.Y., Chawla Y., Farrell G., Chan H.L. The Asia-Pacific Working Party on Non-alcoholic Fatty Liver Disease guidelines 2017-Part 2: Management and special groups. J. Gastroenterol. Hepatol. 2018;33(1):86–98.
7. Ивашкин В.Т., Маевская М.В., Павлов Ч.С., Тихонов И.Н., Широкова Е.Н., Буеверов А.О., Драпкина О.М., Шульпекова Ю.О., Цуканов В.В., Маммаев С.Н., Маев И.В., Пальгова Л.К. Клинические рекомендации по диагностике и лечению неалкогольной жировой болезни печени Российского общества по изучению печени и Российской гастроэнтерологической ассоциации. Рос. журн. гастроэнтерол., гепатол., колопроктол. 2016;2:19–23.
8. Zelber-Sagi S., Lotan R., Shlomai A., Webb M., Harrari G., Buch A., Nitzan Kaluski D., Halpern Z., Oren R. Predictors for incidence and remission of NAFLD in the general population during a seven-year prospective follow-up. J. Hepatol. 2012;56(5):1145–51.
9. Koopman K.E., Caan M.W., Nederveen A.J., Pels A., Ackermans M.T., Fliers E., la Fleur S.E., Serlie M.J. Hypercaloric diets with increased meal frequency, but not meal size, increase intrahepatic triglycerides: a randomized controlled trial. Hepatology. 2014;60(2):545–53.
10. Тонких Ю.Л., Цуканов В.В., Каспаров Э.В., Бронникова Е.П., Васютин А.В. Изменение соотношения насыщенных и ненасыщенных жирных кислот в крови – универсальный маркер нарушения липидного обмена у больных холелитиазом. Тер. архив. 2017;89(2):66–9.
11. Цуканов В.В., Куперштейн Е.Ю., Тонких Ю.Л., Бронникова Е.П. Ассоциация жирнокислотного состава сыворотки крови с липидным составом желчи у больных холелитиазом. Тер. архив. 2008;80(2):71–5.
12. Levy J.R., Clore J.N., Stevens W. Dietary n-3 polyunsaturated fatty acids decrease hepatic triglycerides in Fischer 344 rats. Hepatology. 2004;39(3):608–16.
13. Zelber-Sagi S., Nitzan-Kaluski D., Goldsmith R., Webb M., Blendis L., Halpern Z., Oren R. Long term nutritional intake and the risk for non-alcoholic fatty liver disease (NAFLD): a population based study. J. Hepatol. 2007;47(5):711–17.
14. Bjermo H., Iggman D., Kullberg J., Dahlman I., Johansson L., Persson L., Berglund J., Pulkki K., Basu S., Uusitupa M., Rudling M., Arner P., Cederholm T., Ahlström H., Risérus U. Effects of n-6 PUFAs compared with SFAs on liver fat, lipoproteins, and inflammation in abdominal obesity: a randomized controlled trial. Am. J. Clin. Nutr. 2012;95(5):1003–12.
15. Parker H.M., Johnson N.A., Burdon C.A., Cohn J.S., O’Connor H.T., George J. Omega-3 supplementation and non-alcoholic fatty liver disease: a systematic review and meta-analysis. J. Hepatol. 2012;56(4):944–51.
16. Argo C.K., Patrie J.T., Lackner C., Henry T.D., de Lange E.E., Weltman A.L., Shah N.L., Al-Osaimi A.M., Pramoonjago P., Jayakumar S., Binder L.P., Simmons-Egolf W.D., Burks S.G., Bao Y., Taylor A.G., Rodriguez J., Caldwell S.H. Effects of n-3 fish oil on metabolic and histological parameters in NASH: a double-blind, randomized, placebo-controlled trial. J. Hepatol. 2015;62(1):190–97.
17. Moriya A., Iwasaki Y., Ohguchi S., Kayashima E., Mitsumune T., Taniguchi H., Ando M., Yamamoto K. Roles of alcohol consumption in fatty liver: a longitudinal study. J Hepatol. 2015;62(4):921–27.
18. Ascha M.S., Hanouneh I.A., Lopez R., Tamimi T.A., Feldstein A.F., Zein N.N. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. Hepatology. 2010;51(6):1972–78.
19. Ouyang X., Cirillo P., Sautin Y., McCall S., Bruchet-te J.L., Diehl A.M., Johnson R.J., Abdelmalek M.F. Fructose consumption as a risk factor for non-alcoholic fatty liver disease. J. Hepatol. 2008;48(6):993–99.
20. Ma J., Fox C.S., Jacques P.F., Speliotes E.K., Hoffmann U., Smith C.E., Saltzman E., McKeown N.M. Sugar-sweetened beverage, diet soda, and fatty liver disease in the Framingham Heart Study cohorts. J. Hepatol. 2015;63(2):462–69.
21. Fedirko V., Lukanova A., Bamia C., Trichopolou A., Trepo E., Nöthlings U. et al. Glycemic index, glycemic load, dietary carbohydrate, and dietary fiber intake and risk of liver and biliary tract cancers in Western Europeans. Ann. Oncol. 2013;24(2):543–53.
22. Sanyal A.J., Chalasani N., Kowdley K.V., McCullough A., Diehl A.M., Bass N.M., et al. Pioglitazone, vitamin E,or placebo for nonalcoholic steatohepatitis. N. Engl. J. Med. 2010;362(18):1675–85.
23. Wei J., Lei G.H., Fu L., Zeng C., Yang T., Peng S.F. Association between Dietary Vitamin C Intake and Non-Alcoholic Fatty Liver Disease: A Cross-Sectional Study among Middle-Aged and Older Adults. PLoS One. 2016;11(1):e0147985.
24. Romero-Gómez M., Zelber-Sagi S., Trenell M. Treatment of NAFLD with diet, physical activity and exercise. J. Hepatol. 2017;67(4):829–46.
25. Grøntved A., Hu F.B. Television viewing and risk of type 2 diabetes, cardiovascular disease, and all-cause mortality: a meta-analysis. JAMA. 2011;305(23):2448–55.
26. Ryu S., Chang Y., Jung H.S., Yun K.E., Kwon M.J., Choi Y., Kim C.W., Cho J., Suh B.S., Cho Y.K., Chung E.C., Shin H., Kim Y.S. Relationship of sitting time and physical activity with non-alcoholic fatty liver disease. J. Hepatol. 2015;63(5):1229–37.
27. Zelber-Sagi S., Nitzan-Kaluski D., Goldsmith R., Webb M., Zvibel I., Goldiner I., Blendis L., Halpern Z., Oren R. Role of leisure-time physical activity in nonalcoholic fatty liver disease: a population-based study. Hepatology. 2008;48(6):1791–98.
28. Santaliestra-Pasías A.M., Mouratidou T., Huybrechts I., Beghin L., Cuenca-García M., Castillo M.J. et al. Increased sedentary behaviour is associated with unhealthy dietary patterns in European adolescents participating in the HELENA study. Eur. J. Clin. Nutr. 2014;68(3):300–8.
29. Van der Windt D.J., Sud V., Zhang H., Tsung A., Huang H. The Effects of Physical Exercise on Fatty Liver Disease. Gene Expr. 2017.
30. Hashida R., Kawaguchi T., Bekki M., Omoto M., Matsuse H., Nago T., Takano Y., Ueno T., Koga H., George J., Shiba N., Torimura T. Aerobic vs. resistance exercise in non-alcoholic fatty liver disease: A systematic review. J. Hepatol. 2017;66(1):142–52.
31. Oh Y.S., Kim H.J., Ryu S.J., Cho K.A., Park Y.S., Park H., Kim M., Kim C.K., Park S.C. Exercise type and muscle fiber specific induction of caveolin-1 expression for insulin sensitivity of skeletal muscle. Exp. Mol. Med. 2007;39(3):395–401.
32. Musso G., Cassader M., Rosina F., Gambino R. Impact of current treatments on liver disease, glucose metabolism and cardiovascular risk in non-alcoholic fatty liver disease (NAFLD): a systematic review and meta-analysis of randomised trials. Diabetologia. 2012;55(4):885–904.
33. Promrat K., Kleiner D.E., Niemeier H.M., Jackvony E., Kearns M., Wands J.R., Fava J.L., Wing R.R. Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis. Hepatology. 2010;51(1):121–29.
34. Vilar-Gomez E., Yasells-Garcia A., Martinez-Perez Y., Calzadilla-Bertot L., Torres-Gonzalez A., Gra-Oramas B., Gonzalez-Fabian L., Villa-Jimenez O., Friedman S.L., Diago M., Romero-Gomez M. Development and validation of a noninvasive prediction model for nonalcoholic steatohepatitis resolution after lifestyle intervention. Hepatology. 2016;63(6):1875–87.
35. Jensen M.D., Ryan D.H., Apovian C.M., Ard J.D., Comuzzie A.G., Donato K.A., et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. J. Am. Coll. Cardiol. 2014;63(25 Pt B):2985–3023.
Автор для связи: В.В. Цуканов – д.м.н., проф., зав. клиническим отделением патологии пищеварительной системы у взрослых и детей ФИЦ КНЦ СО РАН, НИИ МПС, Красноярск, Россия; e-mail:





