Введение
Кампилобактериоз (КБ) служит ведущей причиной геморрагических колитов и одной из наиболее распространенных бактериальных инфекций во всех регионах мира [1, 2]. Ежегодный экономический ущерб от КБ во всем мире составляет не менее 5 млрд долл. [3]. В нашей стране информация о заболеваемости данной инфекцией фрагментарна и не дает полного представления об истинных масштабах распространения этого заболевания [4].
Особенностью КБ является разнообразие клинических проявлений заболевания. Помимо «классических» форм КБ, характеризующихся преимущественно симптомами острого гастроэнтерита или гастроэнтероколита, доказана возможность развития артритов, синдрома Гиена–Барре и Миллера–Фишера [5]. Особого внимания заслуживают данные о частом развитии воспалительных заболеваний кишечника и функциональных расстройств желудочно-кишечного тракта после перенесенной инфекции [6].
Лечение КБ основано на проведении комплекса лечебных мероприятий, включающих лечебно-охранительный режим, соблюдение диетических рекомендаций, а также применение комбинирований медикаментозной этиотропной (антибактериальная терапия) патогенетической (применение пробиотиков, ферментных препаратов, сорбентов) и симптоматических средств [7, 8].
Наибольшие вопросы в практической медицине возникают в отношении антибактериальных препаратов при КБ. Эффективность антибактериальной терапии КБ макролидами и фторхинолонами была рассмотрена в нескольких крупных исследованиях. Так, по данным мета-анализа, включившего результаты 11 исследований, показано, что антимикробная терапия уменьшает продолжительность диспепсических явлений на 1,3 дня [9]. Однако последние данные свидетельствуют о повышении устойчивости кампилобактерий к антимикробным воздействиям и быстром распространении резистентных штаммов в пищевых продуктах и окружающей среде. Этот процесс чрезвычайно ускоряется в связи с широким применением антибиотиков в животноводстве и ветеринарии [10].
Так, недавние исследования в Таиланде и Ирландии продемонстрировали высокие темпы роста резистентности к макролидным антибиотикам [11–13]. Аналогичным образом отмечается стремительное возрастание резистентности кампилобактерий к фторхинолонам. В исследованиях испанских и венгерских ученых была установлена частота выделения резистентных к фторхинолонам штаммов возбудителя на уровне 50–60% [14, 15]. Отмечается рост резистентности к данной группе антибиотиков и в США. По данным CDC (Centers for Disease Control and Prevention), частота выявления резистентных к ципрофлоксацину штаммов кампилобактерий возросла за последние 20 лет до 20–27% [14].
Все эти данные свидетельствуют о необходимости постоянного мониторинга региональной резистентности кампилобактерий к антибактериальным препаратам в нашей стране.
Цель исследования: установить частоту выделения штаммов, резистентных к антибактериальным препаратам, у пациентов с манифестными формами заболевания.
Методы
Изучение резистентности кампилобактерий проводилось у пациентов с манифестными формами заболевания. В исследование были включены 50 пациентов в возрасте от 18 до 67 лет (средний возраст – 35,8±12,4 года) c диагнозом основного заболевания «кампилобактериоз», проходивших лечение в 2017–2019 гг. в КИБ им. С.П. Боткина. Исследуемую группу составили 28 (53,3%) мужчин и 22 (46,7%) женщины. Подтверждение этиологии осуществляли с применением набора реагентов для выявления и дифференциации генетического материала микроорганизмов рода Shigella spp., Salmonella spp., Campylobacter spp., аденовирусов группы F, ротавирусов группы А, норовирусов 2-го генотипа и астровирусов в объектах окружающей среды и клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс® ОКИ скрин-FL» (ИнтерЛабСервис, Москва). Выделение культур кампилобактерий осуществлялось на специфические питательные среды для избирательного роста кампилобактерии. Отбор образцов и подготовку проб к посевам проводили стандартизованными и общепринятыми методами по ГОСТ 31904-2012 и ГОСТ 26669-85. Для выделения штаммов рода Campylobacter использовали жидкие и плотные питательные среды (бульон и агар Престона, бульон для бруцелл, модифицированный угольный агар с дезоксихолатом натрия, кровяной агар) («Merck», «HiMedia»); алгоритм посевов и учет результатов выполнены в соответствии с МУК 4.2.2321-08 и ГОСТ ISO 10272-1-2013.
Профили антибиотикорезистентности культур определяли дискодиффузионным методом в чашках Петри на агаре Мюллера–Хинтона с дефибринированной кровью с использованием дисков с антибиотиками («Oxoid», Великобритания) в соответствии с методикой Европейского комитета по тестированию антимикробной чувствительности (EUСAST), 2015, и МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам».
В работе использованы диски с антибиотиками, эритромицином (15 мкг), ципрофлоксацином (5 мкг), налидиксовой кислотой (30 мкг), гентамицином (10 мкг), амикацином (30 мкг), тетрациклином (30 мкг), доксициклином (30 мкг), ампициллином (10 мкг), хлорамфениколом (30 мкг) и цефотаксимом (30 мкг). Результаты интерпретировали путем сопоставления величин диаметров зон ингибиции роста культур с пограничными значениями этих параметров. Помимо этого оценивали клинические и лабораторные данные, полученные в ходе стационарного лечения пациентов, а также особенности эпидемиологического анамнеза и анамнеза жизни.
Статистическая обработка материала проведена с помощью программы Statistica for Windows, v. 10 (StatSoft, США) с использованием параметрических и непараметрических критериев. Для каждой группы вычислены дескриптивные характеристики: частота встречаемости признака (для дискретных признаков), среднее значение показателя (M), стандартное отклонение (σ), ошибка среднего (m), минимум, максимум, медиана и квартили для признаков с непрерывным распределением. Статистическую обработку данных о концентрации возбудителей в кале выполняли после предварительной логарифмической трансформации исходных величин.
Для определения достоверности различий в двух сравниваемых выборках использовали t-критерий Стьюдента, ранговый U-критерий Вилкоксона–Манна–Уитни, а при сравнении 3 и более групп – ранговый дисперсионный анализ Краскела–Уоллиса. Сравнение частоты встречаемости признаков в группах и анализ таблиц сопряженности выполняли с помощью χ2-критерия Пирсона и точного метода Фишера. При анализе динамики показателей в процессе лечения использовали парный td-критерий и ранговый Ud-критерий Вилкоксона (для связанных выборок). Для анализа связи между признаками применялся ранговый корреляционный анализ (rs-критерий Спирмена). Графики и диаграммы построены в программах Statistica for Windows, Excel, GraphPadPrism. Достоверными считали результаты статистического анализа при p<0,05.
Результаты
Выделенные штаммы кампилобактерий признакам были отнесены к видам Campylobacter jejuni (n=39; 78,0%) и Campylobacter coli (n=15; 30,0%).
У 4 пациентов было выделено сочетание C. jejuni и C. coli.
Все выделенные штаммы были каталазо- и оксидазоположительными, не росли при температуре ниже +25°С, утилизировали гиппурат (C. jejuni), редуцировали нитраты до нитритов, не продуцировали сероводород, были устойчивыми к цефалотину и характеризовались типичными морфологическими признаками (грамотрицательные спиралевидные подвижные палочки).
Для оценки распространенности антибиотико-резистентных штаммов Сampylobacter spp. проведен скрининг чувствительности выделенных культур к клинически значимым антимикробным препаратам. Всего исследовано 54 штамма Campylobacter spp. Результаты определения резистентности Campylobacter spp. к антибактериальным препаратам представлены на рисунке.
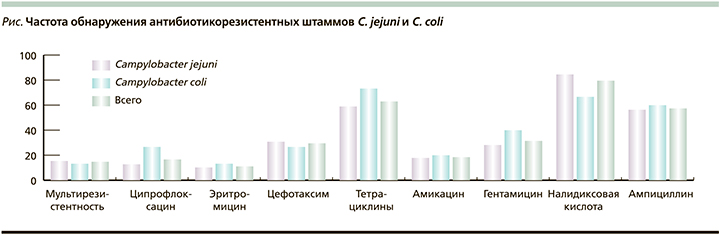
По результатам определения чувствительности к антибактериальным препаратам большинство штаммов были нечувствительными к налидиксовой кислоте (n=43; 79,6%) и тетрациклинам (n=34; 79,6%). Чувствительными к ципрофлоксацину были 83,3% штаммов. Это подтверждают данные, свидетельствующие о высоких рисках формирования резистентности к антибиотикам данной группы, а также показывает отсутствие положительной динамики снижения резистентности к данной группе антимикробных препаратов в отсутствие эффективных мер по противодействию. Стоит также отметить тенденцию более частого выявления резистентных к ципрофлоксацину C. coli по сравнению с С. jejuni (26,7 и 12,8% соответственно; p=0,08). Однако стоит отметить, что частота выявления резистентных изолятов к фторхинолонам остается на сравнительно невысоком уровне, позволяя сохранять данную группу лекарственных препаратов в списке высокоэффективных этиотропных препаратов при лечении КБ у взрослых пациентов.
Обсуждение
Наиболее широко применяемыми при лечении КБ в педиатрической практике являются антибиотики группы макролидов, которые оказывали достаточное воздействие на spp. у 88,9% изолятов Campylobacter. Тем не менее выявление у 11,1% штаммов Campylobacter spp. резистентности к препаратам данной группы имеет большое значение при лечении КБ. До недавнего времени считалось, что бактерии рода Campylobacter spp. не обладают генетически закрепленной устойчивостью к эритромицину [16].
Однако, по данным A. Gibreel, регистрируемая возрастающая устойчивость к макролидам может объясняться мутациями в рибосомных РНК, в частности в пептидил-кодирующей последовательности V домена гена 23S рРНК [17]. Данные, полученные при оценке распространенности резистентности к макролидам, сопоставимы с результатами, выявляемыми в настоящее время в ряде стран Евросоюза, где 5,9–14,5% штаммов Campylobacter spp. резистентны к эритромицину [10].
Полирезистентность возбудителей КБ является предметом специальных исследований, направленных на изыскание эффективных способов лечения этого зоонозного заболевания у людей. В исследовании преобладали изоляты, устойчивые к действию четырех и более групп антибактериальных препаратов. В изученной выборке 14,8% штаммов обладали полирезистентностью к 3–7 антибиотикам различных групп, в т.ч. 2 культуры С. jejuni были не чувствительны к 6 группам антибактериальных препаратов.
Такая полирезистентность может объясняться наличием у C. jejuni разных путей и механизмов формирования защитных свойств к неблагоприятным воздействиям в присутствии тех или иных антибиотиков. Особенностью формирования резистентности у кампилобактерии является не только быстрое наступление эффекта нечувствительности штаммов к действию антибиотиков, но и множественный характер этого явления. Более того, данные, полученные многими авторами на обширном материале различных географических зон, убедительно свидетельствовали, что полирезистентные культуры доминируют в популяциях микроорганизмов [18]. Более того, Taraadon Luangtongkum et al. доказали, что специфической особенностью Campylobacter spp. является наличие положительной корреляции между резистентностью к антибактериальным препаратам и прогрессивно возрастающей вирулентностью данного микроорганизма.
Высокий уровень полирезистентности выделенных штаммов Campylobacter spp. свидетельствует об интенсивных процессах формирования генетически закрепленных признаков изменчивости, что сопровождается появлением толерантных популяций Campylobacter spp. и усилением их патогенного потенциала в условиях повсеместного применения антимикробных средств в медицине, ветеринарии и животноводстве.
При анализе анамнестических сведений установлено, что в большинстве случаев (n=23; 46,0%) заболевание (КБ) можно было связать с употреблением в пищу мясных продуктов. Среди них наиболее часто имело место употребление курицы (n=9; 18,0%), колбасы и сосисок (n=7; 14,0%), 6 (12,0%) человек накануне заболевания отмечали выезд за пределы Российской Федерации в Азиатский (n=4; 8,0%) или Восточно-Европейский (n=2; 4,0%) регионы.
Из 8 пациентов с выделенными полирезистентными штаммами Campylobacter spp. 3 (37,5%) в течение календарного года проходили курс эрадикационной терапии в связи с хеликобактериозом. Нельзя исключить потенциальной передачи генов резистентности между двумя данными близкородственными микроорганизмами, что было описано в недавнем исследовании O. Oyarzabal et al. [19].
Аналогичным образом отмечалось повышение риска выделения частоты резистентных к фторхинолонам штаммов Campylobacter spp. после посещения Азиатского региона. Подобные результаты были описаны J. Engberg et al., которые на основании изучения эпидемиологических и микробиологических особенностей КБ в Великобритании [20] сделали вывод, согласно которому подобные зарубежные поездки служат ведущим фактором риска приобретения ципрофлоксацин-резистентных штаммов C. jejuni.
Заключение
Изучены фенотипические профили антибиотикорезистентности 54 штаммов Campylobacter spp., выделенных у пациентов с манифестными формами заболевания. Определена чувствительность выделенных штаммов к 10 антимикробным препаратам 8 фармакологических групп (эритромицин, ципрофлоксацин, налидиксовая кислота, гентамицин, амикацин, тетрациклин, доксициклин, ампициллин, хлорамфеникол и цефотаксим) дискодиффузионным методом.
Большинство исследованных культур Campylobacter spp. были устойчивыми к налидиксовой кислоте и тетрациклину. Частота выделения резистентных штаммов к макролидам и фторхинолонам составила 11,1 и 16,7% соответственно, 14,8% изолятов были полирезистентными к 4 антибиотикам и более. Полученные данные свидетельствуют о высокой распространенности антибиотико-резистентных штаммов среди кампилобактерий, выделенных от пациентов с манифестными формами заболевания.
Таким образом, анализ данных позволяет говорить о широком распространении среди кампилобактерий, выделяемых от пациентов с манифестными формами заболеваний, явлений лекарственной устойчивости. Формирующиеся резистентные штаммы представляют высокую опасность за счет утяжеления течения заболевания и снижения эффективности этиотропной терапии. В большом проценте случаев лекарственная устойчивость возбудителей приобретает характер множественной резистентности к препаратам различных групп.



