Введение
Диффузный токсический зоб (ДТЗ) представляет собой аутоиммунное заболевание щитовидной железы (ЩЖ), развивающееся вследствие врожденного дефекта в иммунной системе. Известно, что в основе патогенеза ДТЗ лежат иммунные нарушения, происходящие вследствие генетической предрасположенности под воздействием факторов внешней среды [1]. Однако работы последних лет доказывают, что ключевую роль в этиопатогенезе, в частности во взаимодействиях между факторами внешней среды и генетической предрасположенностью, играют эпигенетические механизмы регуляции экспрессии гена. Одним из таких механизмов являются микро-РНК (miRNA, miR). Микро-РНК контролируют экспрессию гена путем связывания с комплементарными последовательностями 3’-нетранслируемой области таргетной матричной РНК (мРНК) и являются негативным регулятором гена на посттранскрипционном уровне либо путем подавления трансляции, либо за счет деградации таргетной мРНК [2].
В работах последних лет показана роль микро-РНК в патогенезе различных аутоиммунных заболеваний, включая сахарный диабет 1 типа, ревматоидный артрит, системную красную волчанку [3–5]. В связи с этим начались исследования, посвященные оценке экспрессии разных микро-РНК как в ткани ЩЖ, так и в крови больных ДТЗ [6, 7]. Помимо этого предметом исследований на протяжении последних нескольких лет стало изучение взаимосвязи полиморфных вариантов генов miRNA с особенностями клинического течения ДТЗ. Одной из изучаемой микро-РНК является микро-РНК125A (miR125A). Ген MIR125A располагается на хромосоме 19 в положении 13.41. В работе Y. Inoue, M. Watanabe et al., выполненной в японской группе больных ДТЗ, показано, что пациенты с отсутствием ремиссии заболевания чаще были носителями аллеля С и генотипа СТ полиморфизма rs12976445 гена MIR125A [8]. Вместе с тем, по данным T. Cai et al., которые провели исследование среди китайской группы больных, не было выявлено ассоциации данного однонуклеотидного полиморфизма (ОНП) MIR125A ни с риском развития ДТЗ, ни с особенностями его клинического течения [9]. На сегодняшний день подобные работы были выполнены только в азиатской группе больных ДТЗ и результаты обследования противоречивы.
В связи с этим целью исследования было изучить влияние ОНП rs12976445 в гене MIR125A на характер клинического течения ДТЗ в группе больных – жителей Санкт-Петербурга.
Методы
Представленное ретроспективное исследование выполнено в Первом Санкт-Петербургском государственном медицинском университете им. акад. И.П. Павлова. В исследование были включены 270 больных ДТЗ (210 женщин, 60 мужчин), средний возраст которых составил 57,6±3,5 года. Группу сравнения составили 200 человек (155 женщин, 45 мужчин) – пациенты без семейного анамнеза заболеваний ЩЖ, без структурных изменений ЩЖ, с нормальным уровнем тиреотропного гормона (ТТГ). Группы были сопоставимыми по возрасту и полу (p>0,5). Все участники исследования подписали информированное письменное согласие. Исследование одобрено Этическим комитетом ПСПбГМУ им. акад. И.П. Павлова.
В группе больных ДТЗ была проведена оценка уровней ТТГ, свободного тироксина (свТ4), свободного трийодтиронина (свТ3), соотношения свободных Т3/Т4, антител к рецепторам ТТГ (АТ-рТТГ) и антител к тиреопероксидазе (АТ-ТПО) как на момент выявления заболевания, так и через 12–18 месяцев терапии антитиреоидными препаратами. Данные исследования были получены с помощью иммунохимического метода в лаборатории гормональных исследований ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова. До начала терапии тиреостатиками у 87 больных ДТЗ был оценен уровень интерлейкина-6 (ИЛ-6) методом иммунноферментного анализа в условиях, рекомендованных производителем (ООО «Цитокин», Россия). Молекулярно-генетическое исследование выполнено в отделе молекулярно-генетических и нанобиологических технологий научно-исследовательского центра ПСПбГМУ им. акад. И.П. Павлова. ДНК была выделена из цельной венозной крови фенол-хлороформным методом в модификации по D.W. Stafford и N. Blin [10]. С целью идентификации полиморфных аллелей rs12976445 в гене MIR125A был использован метод полимеразной цепной реакции (ПЦР) и последующий рестрикционный анализ с использованием эндонуклеазы рестрикции BaeGI в условиях, рекомендованных производителем (New England Biolabs, США), по методике, указанной в работе Y. Inoue et al. (2014) [8].
В настоящем исследовании в качестве ремиссии ДТЗ считали отсутствие клинических и лабораторных признаков синдрома тиреотоксикоза на протяжении не менее 1 года после отмены антитиреоидных препаратов.
Статистическая обработка результатов произведена в программе Statistica 10 (StatSoft Inc., США). Сопоставление частотных характеристик качественных показателей проводилось с помощью непараметрических методов χ2-критерия, точного критерия Фишера. При сравнении двух групп с нормальным распределением данных был использован критерий Стьюдента. Для оценки значимости различий изучаемых показателей, которые отличались от нормального распределения, был использован непараметрический критерий Манна–Уитни. Критерием статистической значимости получаемых результатов считали величину p<0,05.
Результаты
Всем пациентам с ДТЗ, включенным в исследование, в качестве первой линии терапии была назначена консервативная терапия, которая заключалась в приеме антитиреоидных препаратов (тиреостатиков). На основании проведенного ретроспективного анализа характера течения заболевания все больные ДТЗ были разделены на три группы. Первую группу составили пациенты, достигшие ремиссии заболевания на фоне консервативной терапии (35/13%); 2-ю – лица, у которых был рецидив синдрома тиреотоксикоза в первый год после отмены терапии (85/31,5%), и 3-ю группу – больные, которыми не была достигнута ремиссия ДТЗ на фоне приема антитиреоидных терапии в течение 12–18 месяцев (150/55,5%).
Среди всех пациентов с ДТЗ у 75 женщин и 25 мужчин была диагностирована инфильтративная офтальмопатия, которая значимо чаще была выявлена в группе пациентов с рецидивом синдрома тиреотоксикоза и отсутствием ремиссии ДТЗ, чем у лиц с ремиссией заболевания (р=0,001).
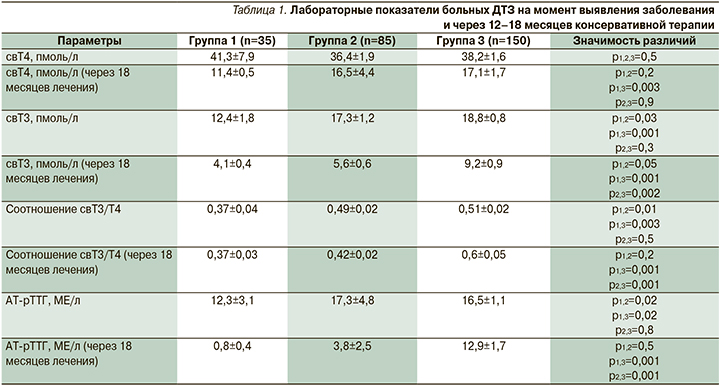
По данным статистической обработки результатов лабораторного обследования больных ДТЗ показано, что до начала проведения консервативной терапии и через 12–18 месяцев лечения уровни свТ3, АТ-рТТГ и соотношение свТ3/Т4 были значимо выше в группе пациентов с неблагоприятным течением ДТЗ, чем у лиц со стойкой ремиссией заболевания (табл. 1). Среди групп больных ДТЗ не было установлено статистической значимого различия уровней ТТГ и АТ-ТПО на момент выявления заболевания и через 18 месяцев лечения.
Помимо этого в данном исследовании выявлено, что уровень ИЛ-6 значимо различался в группе больных ДТЗ. Так, в группе пациентов с ДТЗ, которыми была достигнута ремиссия заболевания, уровень ИЛ-6 составил 3,8±0,9 пг/мл, а у пациентов с неблагоприятным течением ДТЗ содержание ИЛ-6 оказалось выше – 13,5±5,3 пг/мл (р=0,016).
В дальнейшем была проведена оценка результатов молекулярно-генетического обследования. В исследовании проанализирована встречаемость генотипов по вариантам rs12976445 гена MIR125А в группе больных ДТЗ и группе сравнения. Распределение генотипов и частота встречаемости аллелей ОНП rs12976445 в гене MIR125A в обследованных группах не различались (табл. 2).

У больных ДТЗ – носителей различных генотипов ОНП rs12976445 гена MIR125A уровни АТ-рТТГ и АТ-ТПО не различались. Установлено, что у носителей генотипа СС уровень ТТГ на момент выявления ДТЗ был ниже, чем у носителей аллеля Т изучаемого полиморфизма. Достоверного различия уровней свТ4, свТ3 и соотношение свТ3/Т4 как на момент манифестации заболевания, так и через 18 месяцев консервативной терапии не установлено (р>0,5). В связи с тем что микро-РНК125А влияет на концентрацию ИЛ-6, была проведена оценка содержания данного цитокина у больных ДТЗ – носителей различных генотипов ОНП rs12976445 гена MIR125A. Установлено, что у носителей аллеля Т (генотипы ТТ и СТ) уровень ИЛ-6 был значимо выше, чем у носителей генотипа СС, – 15,3±7,2 и 2,9±0,8 пг/мл соответственно (р=0,03).
В результате оценки частоты рецидива ДТЗ и отсутствия ремиссии заболевания среди носителей различных генотипов ОНП rs12976445 гена MIR125A выявлено, что у носителей аллеля С (генотипы СС и СТ) рецидив тиреотоксикоза наблюдался в 81,8% случаев, у носителей генотипа ТТ – в 18,2%. Таким образом, методом статистической обработки полученных данных определено, что у пациентов – носителей аллеля С (генотипы СС и СТ) изучаемого ОНП гена MIR125A риск неблагоприятного течения ДТЗ был в 4,5 раза выше, чем среди носителей генотипа ТТ (р=0,001, отношение шансов (ОШ)=4,5, 95% доверительный интервал (ДИ) – 1,8–13,8).
Обсуждение
Микро-РНК участвуют в регуляции широкого спектра биологических процессов, включая рост и созревание клеток, их апоптоз также участвует в функционировании врожденного и приобретенного иммунитета [11, 12]. Микро-РНК125а подавляет экспрессию ИЛ-6, фактора некроза опухоли α (ФНО-α) и хемокина, экспрессируемого и секретируемого при активации Т-хелперами (RANTES), [13, 14]. В случае полиморфизма rs12976445 гена MIR125A снижается экспрессия и активность данной микро-РНК.
В связи с этим в нашем исследовании была проведена оценка уровня ИЛ-6, на который влияет микро-РНК125А. Установлено, что у носителей аллеля Т уровень ИЛ-6 был значимо выше, чем у носителей генотипа СС. Помимо этого показано, что содержание ИЛ-6 было значимо выше у пациентов с рецидивом синдрома тиреотоксикоза, чем в группе с ремиссией ДТЗ. Результаты исследований, посвященных изучению роли полиморфизма rs12976445 гена MIR125A в патогенезе ДТЗ, носят неоднозначный характер среди разных этнических групп. На основании данных молекулярно-генетического исследования, полученных в представленной работе, не было выявлено различий в распределении генотипов и встречаемости аллелей ОНП rs12976445 MIR125A среди больных ДТЗ и группы сравнения. Таким образом, в настоящем исследовании не было выявлено ассоциации данного полиморфизма гена MIR125А с предрасположенностью к ДТЗ, что согласуется с данными литературы. Также в настоящем исследовании было установлено, что носительство аллеля С ОНП гена MIR125A ассоциировано с неблагоприятным течением ДТЗ: рецидив тиреотоксикоза и отсутствие ремиссии заболевания наблюдались в 4,5 раза чаще, чем у носителей генотипа ТТ. Полученные результаты противоречат данным, выявленным в работе Y. Inoue и T. Cai [8, 9].
В связи с этим не вызывает сомнений необходимость проведения подобных исследований на большей выборке пациентов с ДТЗ.
Выводы
Распределение генотипов и частот аллелей полиморфизма rs12976445 гена MIR125А не различаются среди больных ДТЗ и группы сравнения. У больных ДТЗ носительство аллеля С полиморфизма rs12976445 гена MIR125A ассоциировано с повышением риска рецидива тиреотоксикоза и отсутствием ремиссии ДТЗ в 4,5 раза (р=0,001, OШ=4,5, 95% ДИ – 1,8–13,8).
Вклад авторов
Концепция и дизайн исследования – Волкова А.Р., Пейкришвили Н.Э., Дора С.В.
Сбор материала – Абрамова И.М., Алламова Г.Г.
Статистическая обработка данных – Пейкришвили Н.Э., Дора С.В.
Написание текста – Волкова А.Р., Пейкришвили Н.Э.
Редактирование текста – Волкова А.Р.



