Обоснование
Пролапс тазовых органов (ПТО) – патологический процесс, при котором происходит опущение тазового дна и органов малого таза изолированно или в сочетании. Генитальный пролапс нужно рассматривать как разновидность грыжи тазового дна, определяющейся в области влагалищного входа [1]. Пик заболеваемости ПТО приходится на пожилой и старческий возраст [2]. Однако многие женщины начинают отмечать симптомы опущения тазовых органов уже в репродуктивном возрасте. По данным научного сообщества, распространенность генитального пролапса у пациенток молодого возраста составляет порядка 20–30% [2–6]. Такие пациентки нуждаются в своевременном оказании медицинской помощи для восстановления репродуктивной функции. Нередко пациентки с симптоматической формой пролапса тазовых органов, проявляющейся сексуальной дисфункцией, не обращаются в медицинские организации, считая эту проблему постыдной, незначительной и некорригируемой [7].
Женская сексуальная дисфункция определяется как отсутствие полового влечения, нарушение возбуждения, любрикации, неспособность достичь оргазма, боль при половом акте или сочетание этих проблем. При этом сексуальная дисфункция приводит к выраженному личностному дистрессу и нарушению межличностных коммуникаций. Половая дисфункция у пациенток с ПТО выше общепопуляционной в среднем на 20–33% [8–10]. По данным литературы, отмечено снижение сексуальной дисфункции у пациенток с хирургически корригированным ПТО [11–13]. Однако, по данным некоторых авторов, отмечено формирование нарушения сексуальной функции «de novo» после операции на тазовом дне, которая возникает преимущественно у пациенток, которые перенесли заднюю кольпоперинеорафию, леваторопластику [14]. На изменение сексуальной функции в послеоперационном периоде влияет множество факторов, которые разделяют на органические, эмоциональные и психологические. Диспареуния и нарушение любрикации относят к органическим причинам, которые нередко ассоциированы с синдромом клиторальной и вагинальной сосудистой недостаточности, которые связаны со снижением кровообращения в половых органах [14]. Некоторые пациентки после оперативного лечения опущения тазовых органов для оптимального восстановления половой функции нуждаются в помощи не только врача-акушера-гинеколога, но психолога или сексолога. В свою очередь врач-акушер-гинеколог может влиять на анатомо-физиологические причины послеоперационной сексуальной дисфункции с помощью специальных инвазивных или неинвазивных методик, которые могут применяться на до- и послеоперационном этапах.
Коллективы авторов под руководством Бельских О.Л. (2019), Шатуно-вой Е.П. (2019) предлагают для предоперационной подготовки пациенткам, находящимся в менопаузе, использовать крем, содержащий эстрогеновый компонент. Гипоэстрогения является одним из факторов, приводящих к атрофическим и воспалительным изменениям слизистой оболочки влагалища. При увеличении эстрогеновой насыщенности слизистой оболочки влагалища были отмечены лучшие исходы – своевременное заживление послеоперационной раны, формирование «стойкого рубца» в области оперативного вмешательства [15, 16].
D.D. Rahn et al. (2023) установили объективные изменения в эпителии влагалища, соответствовавшие повышенной эстрогенизации. Однако, по данным стратифицированных опросников (PISQ-IR – оценка сексуальной функции при пролапсе тазовых органов, UDI-6 – мочевого дистресса, симптомов вагинальной атрофии), отсутствует улучшение функции мочеиспускания, сексуальной жизни [17].
В обзоре рандомизированных контролируемых исследований, выполненном коллективом авторов во главе с N. Haya (2018), представлены данные о сомнительной пользе структурированной тренировки мышц тазового дна в качестве предоперационной подготовки и послеоперационной реабилитации. Рассмотрены и другие методы подготовки к оперативному лечению: подготовка кишечника перед операцией и введение сосудосуживающих средств в область операционной раны. По данным исследования, данные методики не позволяют снижать число послеоперационных осложнений [18].
Ю.Э. Доброхотова и соавт. (2021) применяли динамическую квадриполярную радиочастоту (ДКРЧ) для реабилитации после хирургического лечения пролапса тазовых органов собственными тканями. Отмечено, что через 3 месяца после оперативного лечения у пациенток, использовавших ДКРЧ на послеоперационном этапе, по данным гистологического исследования отмечено увеличение показателей коллагеногенеза по сравнению с группой, где не применялся исследуемый метод реабилитации. Отмечено изменение соотношения коллагена I и III типов, что демонстрирует увеличение прочности стенки влагалища [19]. Также пациенткам была проведена высокочастотная микрососудистая визуализация, основанная на методе эластографии. По данным эластографии, отмечена неоваскуляризация стенок влагалища у пациенток, имевших в послеоперационном периоде курс ДКРЧ-терапии [20].
Вышеперечисленные методики успешно применяются у женщин, находящихся в постменопаузе. Обзор литературных данных не позволил выделить обоснованную тактику периоперационного ведения женщин репродуктивного возраста перед реконструктивно-пластическими операциями на тазовом дне по поводу ПТО. Пациенткам репродуктивного возраста для восстановления анатомо-функциональной взаимосвязи половых органов после хирургического лечения ПТО необходимо разработать и стратифицировать методики предоперационной подготовки. Возможно, стоит рассмотреть малоинвазивные или неинвазивные способы, основными эффектами которых будут неоколлагеногенез, неоваскуляризация, а также снижение локального воспаления. Вышеуказанные процессы будут способствовать лучшему заживлению тканей в послеоперационном периоде, а также восстановлению их функциональности [28].
К таким методикам можно отнести применение ДКРЧ (RF-лифтинг влагалища) и PRP-терапию (введение аутоплазмы, обогащенной тромбоцитами).
ДКРЧ – новая неинвазивная методика, основанная на взаимодействии между субэпителиальными слоями вульвы, слизистой оболочки влагалища и энергией, излучаемой 4 динамическими электродами с электронным управлением радиочастотного генератора [21]. По данным Ю.Э. Доброхотовой и соавт., применение ДКРЧ на послеоперационном этапе у пациенток, перенесших оперативное лечение ПТО, повышает эластичность тканей, васкуляризацию и экспрессию м-РНК коллагена I типа [20]. Также были отмечены нормализация обмена белков межклеточного матрикса в сторону его нормализации, рост экспрессии генов TIMP-1 и TIMP-2 в ткани влагалища, что демонстрирует ремоделирующее действие ДКРЧ [22].
Аутоплазма, обогащенная тромбоцитами, применяется во многих сферах современной медицины: травматологии, стоматологии, косметологии и гинекологии. В подготовленной с использованием специальных методик плазме содержится на 66% больше тромбоцитов и факторов роста, связанных с тромбоцитами, чем в цельной крови [23]. Концентраты PRP (Platelet Rich Plasma) способствуют ангиогенезу, клеточной пролиферации и дифференцировке тканей преимущественно за счет высвобождения факторов роста, содержащихся в аутоплазме, таких как трансформирующий фактор роста-β (TGF-β), эпидермальный и сосудистый эндотелиальный факторы роста (EGF и VEGF), тромбоцитарный фактор роста (PDGF), факторы роста фибробластов (FGF) и инсулиноподобные факторы роста (IGF-1) [23, 24]. Применение аутоплазмы, обогащенной тромбоцитами, у пациенток с ПТО на данный момент не имеет широкого распространения. По данным литературы, интраоперационное введение PRP в слизистую оболочку влагалища улучшает не только анатомический, но и функциональный результат от оперативного лечения [25, 26].
Цель исследования: оценить влияние предоперационной подготовки с использованием ДКРЧ и PRP-терапии на сексуальное здоровье и морфологическую структуру слизистой оболочки влагалища женщин репродуктивного возраста с ПТО.
Методы
Проведено рандомизированное сравнительное проспективное исследование, включившее 52 сексуально активных женщин с опущением тазовых органов II–III стадий по POP-Q (Pelvic Organ Prolapse Quantification) в возрасте от 31 года до 49 лет. Пациентки были рандомизированы с использованием генератора случайных чисел на три группы. В I группе (n=17) перед оперативным лечением пациенткам проведена предоперационная подготовка с использованием ДКРЧ – 4 процедуры с интервалом в 2 недели, во II группе (n=14) проведена PRP-терапия слизистой оболочки влагалища за месяц до оперативного лечения, III группа (n=21) – контрольная. Всем пациенткам было проведено оперативное лечение в следующем объеме: передняя кольпорафия, пластика цистоцеле собственными тканями и/или задняя кольпорафия, леваторопластика, пластика ректоцеле собственными тканями. Интраоперационно получен гистологический материал – слизистая оболочка влагалища. Размер биоптата составлял 10–15×10–15 мм. Парафиновые срезы были выполнены толщиной 4,0 мкм Полученный материал был окрашен с использованием гематоксилина Карацци и эозином по стандартной методике. Для оценки морфологического состояния слизистой оболочки проведена световая микроскопия и фотографирование биоптатов стенки влагалища на микроскопе Axioplan-2 («CarlZeissJena», Germany) с использованием цифровой фотокамеры. Оценка линейных показателей материала проведена с использованием программы ImageJ (National Institutes of Health, США).
До предоперационной подготовки и через 4 месяца после оперативного вмешательства оценено качество сексуальной функции пациенток с использованием валидированного опросника FSFI – The Female Sexual Function Index (индекс женской сексуальной функции). Он включает 19 вопросов, которые позволяют оценить аспекты влечения, возбуждения, любрикации, оргазма, диспареунии и удовлетворенностью сексуальной жизнью женщины. Обработка статистических данных проведена с использованием программ Statistica for Windows 12 (StatSoft, США), Office Excеl (2013). Были рассчитаны средние значения показателей (М), стандартная ошибка среднего (m). Для сравнения средних значений в двух группах показателей с нормальным распределением использовался t-критерий Стьюдента. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Производили расчет показателей структуры (в процентах). Отличия между группами считали статистически значимыми при р<0,05.
Для показателей, распределение которых не отличается от нормального, рассчитаны средние значения (М), стандартная ошибка среднего (m). Для связей между количественными показателями использовали коэффициенты корреляции Пирсона. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Производили расчет показателей структуры (в процентах). Отличия между группами считали статистически значимыми при р<0,05.
Критерии включения: возраст 18–50 лет, наличие опущения тазовых органов II–III стадий по POP-Q, сексуальная активность пациенток, подписанное добровольное информированное согласие на исследование и использование биологического материала в научных целях. В исследование не были включены пациентки младше 18 и старше 50 лет, сексуально неактивные, женщины с ПТО I или IV стадии по POP-Q, воспалительными заболеваниями органов малого таза и онкологическими заболеваниями в анамнезе. Критерием исключения являлся отзыв информированного добровольного согласия на проведение исследования.
Исследование было проведено на базе гинекологического отделения ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава РФ с сентября 2022 по декабрь 2024 г.
Описание медицинского вмешательства. За 2 месяца до оперативного лечения пациентки были рандомизированы в 3 группы с использованием генератора случайных чисел.
Женщинам I группы проводили терапию по технологии ДКРЧ на аппарате EVAТМ (Novaclinical, Италия) с помощью влагалищной и наружной насадок по технологии ДКРЧ при температуре 41–42°С, мощностью 25% 1 раз в 14 дней – 4 сеанса. За месяц до оперативного лечения пациенткам II группы была выполнена подготовка слизистой оболочки влагалища с использованием PRP-терапии: произведен забор крови в 3 вакуумные пробирки объемом 4 мл с цитратом натрия 3,8%. Пробирки были помещены в центрифугу, где при 1500 об/мин произведено отделение эритроцитов в течение 5 минут. После окончания центрифугирования содержимое пробирки представляло собой 2 части: верхняя – аутоплазма, обогащенная тромбоцитами, нижняя – конгломерат форменных элементов [27, 28]. Плазма, обогащенная тромбоцитами, набрана в шприцы объемом 1 мл.
В асептических условиях после соответствующей обработки и подготовки под местной анестезией (Лидокаин спрей 10%) в слизистую оболочку влагалища мелкопапульно введена аутоплазма, обогащенная тромбоцитами.
После предоперационной подготовки проведено хирургическое лечение в объеме пластики собственными тканями. При цистоцеле выполнена передняя кольпорафия с укреплением пузырно-влагалищной фасции. Хирургическое вмешательство проведено по следующей методике: отступя 1,5 см от наружного отверстия уретры, выкроен веретенообразный лоскут из передней стенки влагалища. Мочевой пузырь отслоен от стенок влагалища. После отслоения мочевого пузыря от стенок влагалища на пузырно-влагалищную фасцию накладывался непрерывный шов, далее было произведено ушивание передней стенки влагалища непрерывным швом по Ревердену. После завершения ушивания слизистой оболочки влагалища проводилась тампонада влагалища. Мочевой катетер и тампон во влагалище были оставлены на 24 часа после оперативного лечения [29].
При ректоцеле проведена задняя кольпорафия, леваторопластика с укреплением ректовагинальной фасции и cужением hiatus genitalis. Ход операции: произведена гидропрепаровка слизистой оболочки задней стенки влагалища, выкроен ромбовидный лоскут задней стенки влагалища. Ножки m. levator ani прошиты 2 лигатурами. Края m. levator ani соединены посредством завязывания наложенных ранее лигатур. Далее слизистая оболочка влагалища ушита непрерывно. На кожу промежности наложены швы по Донати.
Продолжительность оперативного вмешательства варьировалась в зависимости от объема и от исходной клинической ситуации (анатомические особенности) и составила в среднем 43,0±6,5 минут. Интраоперационная кровопотеря была оценена в пределах от 20 до 100 мл. Послеоперационных осложнений не зарегистрировано. Средний койко-день составил 4,2±0,9 дня.
После проведения хирургического лечения пациентки были приглашены на гинекологический прием через 1 и 4 месяца.
Результаты
Средний возраст пациенток I группы составил 40,9±5,9 года, II – 41,0±4,6, III группы – 41,9±7,0 года (p1–2, p1–3, p2–3>0,05). Индекс массы тела пациенток I группы составил 24,6±4,9 кг/м2, II– 24,5±4,3, III – 26,9±4,1 кг/м2 (p1–2, p1–3, p2–3>0,05). Таким образом, пациентки исследуемых групп были сопоставимыми по антропометрическим и возрастным показателям.
При подробном анализе жалоб было выявлено их разнообразие: все (100%) пациентки предъявляли жалобы на ощущение инородного тела во влагалище, усиливавшееся к вечеру или после физической нагрузки. Тянущие и ноющие боли внизу живота и в промежности были зарегистрированы у 39 (74,7%) женщин. Дизурические расстройства – ощущение неполного опорожнения мочевого пузыря, удлинение времени акта мочеиспускания отмечали 22 (42,3%) пациентки, включенные в исследование. Тринадцать (25%) пациенток отметили расстройства дефекации – задержку стула, чувство неполного опорожнения прямой кишки.
По данным анамнеза, все пациентки имели роды через естественные родовые пути, 31 (59,62%) женщина при этом имела в родах разрывы промежности и/или эпизиоперинеотомию. Порядка трети (28%) являлись многорожавшими – имели 3 и более родов в анамнезе. Роды крупными плодами были у 13 (25%) пациенток.
Среди исследуемых женщин в 44,2% случаев наблюдалась сочетанная форма ПТО. В структуре ПТО преобладали ректоцеле – у 42 пациенток, цистоцеле – у 29 пациенток. В меньшей степени были отмечены апикальный пролапс (10 пациенток) и уретроцеле (2 пациентки).
При анализе сексуальной функции пациенток на этапе до проведения предоперационной подготовки у пациенток всех групп обращает на себя внимание исходно низкий уровень половой функции. Особенно низкими были показатели в доменах оргазма и удовлетворенности сексуальной жизнью (см. рисунок). Так, в I группе пациенток среднее значение показателей составило соответственно 1,9±0,4 и 2,2±0,5 из 6 возможных; во II группе – 2,0±0,5 и 2,2±0,4; в III – 2,0±0,5 и 2,2±0,4. После проведения предоперационной подготовки и оперативного лечения во всех группах произошло увеличение индекса сексуальной функции практически вдвое. Так, в I группе индекс сексуальной функции увеличился на 57,7%, во II группе – 50,6%, в III группе – на 48,1%. Были выявлены статистически значимые различия в домене любрикация между тремя исследуемыми группами (p1–2<0,0001, p2–3<0,0001, p1–3<0,000).
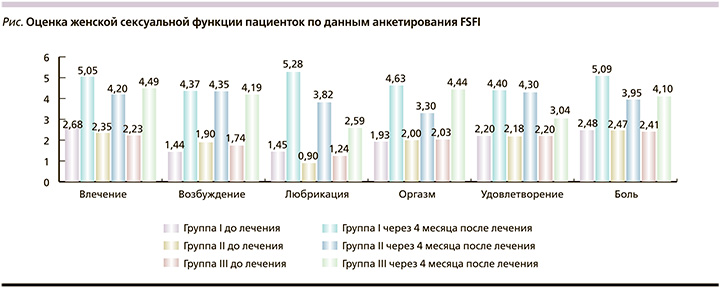
В I группе показатель любрикации составил 5,3±0,5 (исходно 1,4±0,4), во II – 3,8±0,7 (исходно 0,9±0,2), в III – 2,6±0,4 (исходно 1,2±0,3). У пациенток произошло и увеличение удовлетворения сексуальной жизнью. Так, в I группе этот показатель составил 4,4±0,6 (исходно 2,2±0,5), во II – 4,3±0,2 (исходно 2,2±0,4), в III – 3,0±0,5 (исходно 2,2±0,4). Различия в полученных данных были статистически значимы (p1–2<0,0001, p1–3<0,0001). После проведенного вмешательства все пациентки отметили увеличение влечения. Так, в I группе этот показатель составил 5,0±0,5 (исходно 2,7±0,8), во II – 4,2±0,4 (исходно 2,3±0,7), в III – 4,5±0,4 (исходно 2,2±0,5). Статистические значимые различия выявлены между I и II, I и III группами (p1–2<0,005, p1–3<0,005).
После проведения оперативного лечения произошло увеличение показателей в домене боль во всех исследуемых группах. При подсчетах данного критерия используется реверсивная оценка. Так, наибольшие баллы пациентки набирают, если они не испытывают дискомфорт в процессе или после полового акта. Существенное увеличение этого критерия произошло у пациенток группы ДКРЧ.
Всего было получено 68 фрагментов слизистой оболочки влагалища. Параметры оценки гистологического материала включали в себя: неоангиогенез, состояние эпителия влагалища и стромы, наличие и степень фиброза, «упорядоченность» пучков коллагена.
При анализе морфологической картины выявлены следующие особенности (таблица).
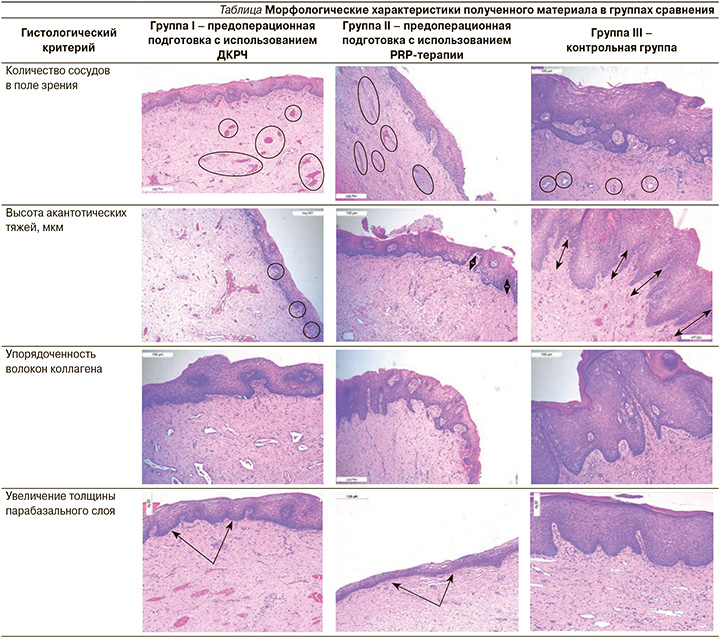
Выраженные изменения определялись у I группы пациенток (группа ДКРЧ). В строме была отмечена выраженная васкуляризация. Также были выражены реактивные изменения: увеличение толщины парабазального слоя многослойного плоского эпителия слизистой оболочки влагалища. Характерным для образцов пациенток данной группы являлось упорядоченность пучков коллагена. При оценке гистологического материала II группы (группа PRP-терапии) отмечена меньшая выраженность воспалительной реакции – отсутствие инфильтрации стромы, а также регенеративные изменения в виде пролиферации клеток парабазального слоя.
У пациенток контрольной группы в слизистой оболочке влагалища обращали на себя внимание признаки слабовыраженного хронического неактивного воспаления, такие как лимфоплазмоцитарная инфильтрация стромы, увеличение высоты фиброэпителиальных тяжей, признаки фиброза в подслизистой оболочке. У части пациенток зарегистрировано ороговение поверхностного слоя эпителия.
Для оценки васкуляризации произведен расчет числа сосудов в полученных фрагментах слизистой оболочки влагалища. У пациенток I группы, которым произведена предоперационная подготовка с применением ДКРЧ, среднее количество сосудов в фрагменте составило 20,2±6,6, в группе PRP-терапии 12,5±3,6, в контрольной группе 7,7±2,2 в поле зрения. Различия в сравниваемых группах имели статистическую значимость (p1–2<0,005, p1–3<0,0001, p2–3<0,0001). Выраженность реактивных изменений эпителия слизистой оболочки влагалища оценивалась посредством измерения высоты акантотических тяжей. Морфологически акантотические тяжи представляют собой реакцию эпителия на хроническое воспаление в строме – это удлиненные эпидермальные выросты, которые проникают в подлежащую строму. Процесс формирования тяжей вызван не только воспалительной реакцией, но и нарушением дифференцировки тканей [30].
У пациенток I группы высота акантотических тяжей составила 20,8±16,2 мкм, в группе PRP-терапии – 31,6±22,1, в контрольной группе – 104,7±41,5 мкм. Была получена статистически значимая разница между результатами 1-й и 3-й, 2-й и 3-й групп (p1–3<0,0001, p2–3<0,0001).
В основе любрикации у женщин лежит выделение жидкости из субэпителиального слоя слизистой оболочки влагалища. Субэпителиальная область содержит плотную сеть капилляров, из которых активно траснфундирует плазма, превращаясь во влагалищный секрет. Ключевым фактором любрикации влагалища является внеклеточная проницаемость эпителия. Перенос жидкости в свою очередь регулируется сопротивлением эпителиальных плотных контактов и межклеточного пространства [30]. Плотные контакты состоят из трансмембранных белков, которые контактируют через межклеточное пространство и создают препятствие, ограничивающее параклеточную диффузию молекул через эпителий [30, 31]. По литературным данным, структура плотных контактов может изменяться, увеличивая резистентность под воздействием стимулов, таких как эстроген, медиаторы воспаления и инвазия патогенов [31].
Полученные нами данные подтверждают литературные. Так, при определении зависимости показателя «число сосудов в поле зрения» и доменом «любрикация» после проведенного лечения от женщин в группах с проведенной предоперационной подготовкой получена сильная положительная корреляционная связь rxy=0,7, р>0,05. Наряду с этим отмечена сильная отрицательная корреляционная связь между высотой акантотических тяжей и показателями любрикации всех групп пациенток rxy=-0,73, р>0,05. Однако коэффициенты корреляции оказались статистически незначимы из-за малого числа пациенток, включенных в исследование.
Обсуждение
Безусловно хирургические методы коррекции оказывают значительное влияние на сексуальную жизнь пациенток по сравнению с консервативными методами. В голландском исследовании, проведенном L.R. van der Vaart et al. (2022), среди 539 женщин разных возрастов сравнивали влияние консервативной и оперативной коррекции опущения тазовых органов на сексуальную функцию пациенток. Через 2 года после хирургической коррекции ПТО пациентки практически в 3 раза чаще возобновляли половую жизнь и отмечали общее улучшение сексуального здоровья, чем группа, применявшая для коррекции пессарии [11]. Французские ученые B. Fatton et al. (2020) отметили улучшение сексуальной функции вне зависимости от использованной техники оперативного лечения. Этот феномен связан с изменением в благоприятную сторону «образа тела» самими женщинами [13]. J. Geynisman-Tan et al. (2018) отметили возобновление сексуальной функции через 6 недель у пациенток, перенесших оперативное лечение ПТО. Женщины, находившиеся в менопаузальном переходе, после операции отметили снижение вагинизма, аноргазмии, неудовлетворенности сексуальной жизнью [12].
Несмотря на хирургические методы коррекции, немаловажными являются предоперационная подготовка и консервативные методы лечения. Оценку гистоархитектоники слизистой оболочки влагалища при воздействии определенных манипуляций проводили ряд авторов. Так, в ранее проведенном нами исследовании «Влияние предоперационной подготовки на архитектонику влагалища женщин с пролапсом гениталий тяжелой степени в постменопаузе» в 2020 г. при предоперационной подготовке к хирургическому лечению пациенток с пролапсом гениталий тяжелой степени использовали вагинальную форму эстриола, прогестерона и лактобацилл [32]. При оценке гистологической картины у пациенток, которым проводилась данная предоперационная подготовка, было отмечено уменьшение воспалительного процесса в виде снижения лимфоплазмоцитарной инфильтрации. Однако это исследование проведено среди пациенток, находившихся в постменопаузе [32].
Ю.Э. Доброхотова и соавт. (2021) провели гистологическую оценку слизистой оболочки влагалища до и после оперативного лечения ПТО у пациенток в постменопаузе. Сравнивали две группы пациенток, одной из групп проводилась послеоперационная реабилитация с использованием ДКРЧ. Авторы отметили статистически значимое преобладание неоколлагеногенеза в группе послеоперационной терапии с использованием ДКРЧ [16].
Эффекты ДКРЧ описывают И.А. Аполихина и соавт. (2020). Проникновение радиочастот происходит на 3,5–15 мм, в зависимости от выбранной терапевтической программы, что обеспечивает гидратацию коллагена, ориентацию структурированных коллагеновых волокон, увеличиваются внутри- и межмолекулярные поперечные связи, открываются резервные капилляры и существенно улучшается васкуляризация тканей. Авторами была проведена оценка сексуальной функции 25 пациенток репродуктивного возраста с синдромом релаксированного влагалища, которым проводили 4 процедуры ДКРЧ. Оценка сексуальной функции была проведена через 1 и 6 месяцев после завершения курса ДКРЧ. У всех пациенток было отмечено улучшение качества сексуальной функции. Продемонстрировано увеличение любрикации, удовлетворенности сексуальной жизнью и повышение оргазмичности [33].
J.I. Einarsson et al. в 2009 г. при хирургической коррекции цистоцеле в объеме передней кольпорафии, пластики цистоцеле собственными тканями вводили в слизистую оболочку влагалища аутоплазму, обогащенную тромбоцитами. Затем была проведена оценка биоптатов слизистой оболочки влагалища, полученных интраоперационно и через 3 месяца после оперативного лечения. Исследователи отмечают увеличение содержания коллагеновых волокон в материале, полученном через 3 месяца после хирургической коррекции пролапса. Однако статистической значимости различий получено не было [34].
F. Gorlero et al. в 2012 г. провели исследование, в ходе которого пациенткам с рецидивной формой ПТО при выполнении оперативного лечения интраоперационно вводили обогащенный тромбоцитами фибрин (одна из форм PRP-терапии). Исследователи отметили полное купирование субъективной симптоматики у пациенток, в 80% случаев полное восстановление анатомических структур и увеличение сексуальной активности пациенток на 20% [25].
Также группа авторов во главе с A.E. Atilgan (2021) при интраоперационном введении аутоплазмы, обогащенной тромбоцитами, зарегистрировали снижение частоты рецидивов и более значимое снижение симптомов опущения тазовых органов по сравнению с контрольной группой, пациенткам которой проводили только хирургическое лечение [26].
Таким образом, можно предполагать, что влияние неинвазивных и малоинвазивных методик, таких как ДКРЧ и PRP, на слизистую оболочку влагалища заключается в формировании в той или иной степени регенеративных изменений и снижении хронического неактивного воспаления. Использование данных методик в качестве предоперационной подготовки может использоваться как дополнительный метод с целью улучшения состояния тканей в предоперационном периоде.
В настоящее время ведение пациенток репродуктивного возраста с ПТО является трудной задачей. Мани-фестирование генитального пролапса в молодом возрасте может являться неблагоприятным прогностическим фактором течения данного заболевания. Оперативное лечение ПТО должно быть стратифицировано, тактика ведения пациенток должна быть направлена не только на восстановление анатомических структур, но и на возобновление их функциональной активности, в т.ч. сексуальной. На момент написания данной публикации отсутствуют сведения о применении методов предоперационной подготовки, активно применяемых в группах пациенток молодого возра-ста. Необходимо проведение большего числа исследований, ориентированных на периоперационное ведение пациенток репродуктивного периода с опущением тазовых органов.
Заключение
По данным морфологического исследования слизистой оболочки влагалища, применение предоперационной подготовки положительно влияет на процессы регенерации. Эффекты от предоперационной подготовки, такие как снижение хронической воспалительной реакции, ангиогенез, неоколлагеногенез, проявляются в увеличении сексуальной функции пациенток.
Так, отмечено значимое повышение любрикации, влечения и удовлетворенности пациенток сексуальной жизнью. С учетом безопасности и неинвазивности методики, выраженного ангиогенеза, неоколлагеногенеза, снижения хронической воспалительной реакции применение ДКРЧ может быть рассмотрено на этапе подготовки к оперативному лечению для улучшения функциональных результатов хирургического лечения. Использование аутоплазмы, обогащенной тромбоцитами, показало меньшую эффективность, однако ее применение также оказывает положительное влияние на ткани слизистой оболочки влагалища. Необходимо проведение полномасштабных исследований, направленных на изучение различных методов предоперационной подготовки для улучшения исхода лечения опущения тазовых органов у пациенток репродуктивного возраста.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы: «Обоснование персонифицированной тактики лечения и реабилитации синдрома тазовой десценции у женщин репродуктивного возраста».



