Гиперфосфатемия – частое проявление при хронической болезни почек (ХБП). Известно, что у пациентов с ХБП гиперфосфатемия увеличивает как заболеваемость, так и смертность, особенно сердечно-сосудистую. Трудности в лечении гиперфосфатемии в клинической практике часто возникают из-за не всегда адекватного взаимодействия врачей-клиницистов и больных ХБП, а также общей низкой приверженности к назначаемой терапии последних. В данном обзоре будут рассмотрены наибольшие трудности, связанные с приверженностью, с точки зрения клиницистов и пациентов с ХБП, при лечении гиперфосфатемии. Особое внимание уделено к тем из них, которые связаны с особенностями диализа, пищевыми предпочтениями и медикаментозной терапии.
Введение
Развитие медицинской науки и прогресс в области медицинских технологий и фармакологии привели к тому, что в руках нефрологов появились инструменты, позволяющие увеличивать продолжительность и качество жизни пациентов с ХБП. Однако реализовать в полной мере эти достижения в реальной клинической практике мешают подчас, как это ни парадоксально, сами пациенты. Проблема выполнения, вернее невыполнения, врачебных рекомендаций была и остается одной из самых острых в практической нефрологии. Учитывая высокую коморбидность и как следствие – массу назначаемых лекарственных средств пациентам с ХБП на диализе, проблема приверженности терапии этой категории больных наиболее актуальна.
На современном этапе медицины к теме приверженности терапии неоднократно обращались различные исследователи. Это позволило сформулировать определение и концепцию термина «приверженность». Одним из первых терминов, отражающих выполнение или невыполнение рекомендаций врача, стал «комплаенс» (от англ. сompliance – уступчивость, податливость). Термин «комплаенс» предложен учеными в прошлом веке и использовался в научной литературе с 1950-х гг., впоследствии определил такие понятия, как «комплаентность» или «некомплаентность». Позднее в качестве альтернативы был предложен термин «приверженность» (от англ. adherence – соблюдение, следование) [1].
Согласно определению Всемирной организации здравоохранения (ВОЗ; World Health Organization, WHO), под «приверженностью» понимают степень соответствия поведения пациента рекомендациям, полученным от врача в отношении приема препаратов, соблюдения диеты и/или других мероприятий по изменению образа жизни. В более узком смысле под приверженностью к лечению подразумевается соответствие количества реально принимаемых препаратов тому, что предписано врачом [2].
Для объективизации данного понятия степень приверженности измеряется показателем MPR (Medication possession ratio) в процентах доз, принятых пациентом от назначенных врачом, и считается удовлетворительной, если пациент принимает не <80% и не >120 % таблеток от предписанных в определенный промежуток времени [3].
В настоящее время принято считать, что понятие «приверженность» более точно отражает взаимодействие врача и пациента в совместном принятии решений по стратегии лечения. Термин «приверженность» активно используется учеными и клиницистами, потому что ранее применяемое понятие «комплаенс» предусматривало пассивное подчинение врачу и выполнение пациентом рекомендаций, предписанных им, а понятие «приверженность» означает сотрудничество и партнерство врача с пациентом, с активным вовлечением последнего в процесс лечения.
Таким образом, термин «приверженность» предполагает более тесное взаимодействие «врач–пациент», повышает ответственность пациента за свое здоровье, тем самым способствует лучшему выполнению рекомендаций, полученных от врача.
Факторы, оказывающие влияние на приверженность, классифицируют на пять групп [4]:
- группа 1 связана с особенностями пациента и его личности (пол, возраст, образование, социальные и психологические характеристики);
- группа 2 связана с болезнью (тяжесть, течение, длительность, наличие осложнений и сопутствующей патологии);
- группа 3 связана с проводимым лечением (медикаментозным и немедикаментозным);
- группа 4 зависит от системы здравоохранения (доступность и стоимость лечения);
- группа 5 обусловлена эффективностью взаимодействия пациента и лечащего врача (уровень доверия к врачу и мотивация пациента)
Гиперфосфатемия считается частым осложнением хронической болезни почек (ХБП), служащим ключевым первичным фактором развития каскада минерально-костных нарушений (МКН) у пациентов с ХБП. К ним относятся повышение фактора роста фибробластов-23 (FGF-23), снижение уровня витамина D, развитие вторичного гиперпаратиреоза (ВГПТ), гиперкальциемии и внекостной кальцификации [5]. Несмотря на важность строгого контроля над уровнем фосфатов и ВГПТ, в последние годы данные DOPPS (The Dialysis Outcomes and Practice Patterns Study) описывают повсеместное прогрессирующее увеличение числа больных, не достигших целевых уровней сывороточного фосфора и парагормона (ПТГ) в популяции пациентов с ХБП на диализе. Опубликованные данные исследований подтвердили неоптимальный контроль над гиперфосфатемией и ее последствиями в популяции пациентов с ХБП, связанный с низкой приверженностью к терапии [6].
Основные трудности коррекции гиперфосфатемии и предотвращения ее последствий вызваны медицинскими факторами ХБП. Наличие клинических рекомендаций, содержащих различные целевые уровни для фосфатов сыворотки крови и ПТГ, может привести к путанице и усугубить отсутствие медицинской приверженности при лечении гиперфосфатемии и МКН-ХБП [7]. С учетом этих положений недавно пересмотренные международные Рекомендации CKD-MBD KDIGO (2017) предписывают снижать повышенный уровень фосфатов до значений, находящихся в нормальном диапазоне. Это означает, что терапия должна быть направлена на снижение развивающейся гиперфосфатемии, а не на «поддержание нормофосфатемии», как было обозначено в рекомендациях 2009 г. [8]. Это также отчасти может объяснить, почему в последние годы среди диализных центров во всем мире отмечается тенденция к снижению приверженности при лечении гиперфосфатемии и МКН-ХБП [9].
К сожалению, надо принять и тот факт, что существует масса негативно настроенных на лечение, часто депрессивных и тревожных пациентов, что затрудняет проведение адекватной терапии гиперфосфатемии [10].
В этом обзоре будут рассмотрены три различных направления лечения: (1) назначение эффективного диализа; (2) диетотерапия; (3) лекарственная терапия.
Режим диализа
Эффективный режим диализа крайне важен для получения хорошего контроля над гиперфосфатемией [11].
Адекватные по продолжительности и частоте сеансы диализа необходимы для эффективного удаления избытка неорганического фосфора (Рi). У пациентов, находящихся на гемодиализе (ГД), удаление Рi в значительной степени зависит от уровня преддиализного и диалитического клиренса Рi [12].
В исследовании, опубликованном Eloot et al. [13], пациенты с ХБП на ГД получали сеансы в режиме 4, 6 или 8 часов. Результаты этого исследования показали повышение эффективности в удалении Рi в зависимости от продолжительности сеанса ГД. Интересно, что максимальная скорость снижения Рi отмечалась в течение первых 120 минут при всех вариантах длительности сеансов с последующими стабилизацией и нарастанием концентрации Р в ходе проведения процедуры ГД.
Кроме того, на удаление Рi, по-видимому, оказывает влияние частота проведения диализа. В 2005 г. 77 пациентов на ГД наблюдали в течение 12 месяцев. Двадцать шесть из них были включены в группу с ежедневным укороченным графиком ГД (6 сеансов/нед. по 3 часа каждый), в то время как 51 пациент получали сеансы по стандартному графику хронического ГД (3 сеанса/нед. по 4 часа каждый). В течение 12 месяцев наблюдения значительное снижение уровня Рi и ПТГ наблюдалось только в группе, получавших сеансы ГД ежедневно. Следует отметить, что снижение уровня ПТГ в этой группе получено с использованием меньших доз активного витамина D3, вероятно благодаря большей эффективности диализа. Кроме того, отмечено достоверное снижение индекса массы миокарда левого желудочка только у больных на ежедневном ГД, причем достоверная корреляция между процентными изменениями Pi и индексом массы миокарда левого желудочка (ИММЛЖ) выявлена как в исходном состоянии, так и через 1 год наблюдения. Частота ГД и процентное снижение сывороточного Pi оказались лучшими независимыми предикторами снижения ИММЛЖ. Влияние частоты диализа также продемонстрировано при среднетяжелых сосудистых кальцификациях стоп и кистей, которые были достоверно ниже при ежедневном диализе [14]. В более позднем исследовании Даугирдас и соавт. [15] установлено значительное улучшение параметров МКН-ХБП и снижение потребности в ФСП при еженощном домашнем диализе. По сравнению с пациентами, получавшими стандартный диализ в центре амбулаторного ГД, в группе еженощного домашнего ГД отмечено снижение среднего значения сывороточного Pi на 1,24 мг/дл. Кроме того, 73% пациентов на еженощном ГД не требовалось назначения ФСП на 12-м месяце терапии по сравнению только с 8% пациентов, получавших стандартный ГД [15].
Выбор метода диализа – еще один важный вопрос в терапии гиперфосфатемии и ВГПТ. В ряде исследований показана более высокая способность удаления Pi при постдилюционной гемодиафильтрации (пост-ГДФ) по сравнению с обычным ГД. Сравнение эффективности удаления P между высокопоточным ГД и пост-ГДФ продемонстрировало дополнительное удаление +19% Pi в ходе гемодиафильтрации [16]. Более эффективное удаление Рi при проведении ГДФ было также подтверждено в исследованиях с большим количеством пациентов [17, 18]. В сравнительном исследовании эффективности выведения P ГД часть пациентов переводили с низкопоточного ГД на ГДФ, другая половина больных оставалась на низкопоточном ГД. В группе, получавшей ГДФ, были достигнуты достоверно более низкие уровни Рi и увеличение доли пациентов, достигших целевых показателей Рi (5,5 мг/дл). Кроме того, применение ГДФ сопровождалось снижением потребности в ФСП по сравнению с группой, получавшей низкопоточный ГД [19].
Перитонеальный диализ (ПД) также обеспечивает хорошее удаление Р. Непрерывный амбулаторный перитонеальный диализ, вероятно, несколько более эффективен, чем автоматизированный перитонеальный диализ по клиренсу перитонеального фосфата, особенно для пациентов с низкими транспортерами [20].
Значение приверженности диализной терапии
Пациенты на ГД сильно различаются по степени тяжести проявлений осложнений и интенсивности ГД терапии. Это факторы, способные повлиять на приверженность режиму лечения [21–23]. Пропуски сеансов ГД, не связанных с госпитализацией, можно рассматривать как одну из форм низкой приверженности к терапии. В 1999 г. Bleyer et al. [24] отметили гораздо более высокую частоту пропусков сеансов ГД среди пациентов в четырех центрах диализа в США по сравнению с четырьмя центрами в Японии и одним центром в Швеции. В дальнейшем были более подробно описаны последствия низкой приверженности к диализной терапии, связанные с повышением риска смерти и частоты госпитализаций [25, 26]. Установлены многочисленные факторы, влияющие на пропуски пациентами сеансов ГД, не все из которых относились к некомплаентности как таковой, включая логистические факторы (проблемы транспортировки к диализному центру, ненастную погоду, проведение сеансов ГД в субботу или праздничные дни), влияние медицинских проблем диализных больных (расстройства ЖКТ, дисфункцию сосудистого доступа, злоупотребление алкоголем/наркотиками, хроническую боль и депрессию), а также культурные, религиозные или демографические характеристики пациентов (ограниченную медицинскую грамотность, возраст, расу/этническую принадлежность или семейную поддержку/статус).
Возможное повышение приверженности к диализной терапии позволяет улучшить результаты лечения таких пациентов. В международном проспективном когортном исследовании результатов лечения пациентов на ГД (5 DOPPS, 2012–2015), представлена оценка последствий низкой приверженности к диализной терапии (пропусков сеансов ГД в течение 4 месяцев) для различных международных систем финансирования здравоохранения [27]. Двадцать стран использовали данные фазы 5 DOPPS для оценки феномена некомплаентности/неприверженности больных на ГД и его связи с характеристиками пациентов, лечебными мероприятиями, клиническими результатами и субъективными показателями качества жизни. Данные 5 DOPPS о приверженности к терапии были собраны с марта 2012-го по июль 2015 г. для 11 488 пациентов на ГД в возрасте 18 лет и старше в 439 центрах ГД Австралии, Бельгии, Канады, Китая, в 6 странах Совета сотрудничества арабских государств Персидского залива (ССАГПЗ: Катаре, Кувейте, Омане, Саудовской Аравии и Объединенных Арабских Эмиратах), Германии, Италии, Японии, Новой Зеландии, России, Испании, Швеции, Турции, Великобритании и США. В исследовании 5 DOPPS установлено, что у пациентов с низкой приверженностью к диализной терапии наблюдаются гиперфосфатемия, более высокие уровни ПТГ, низкие показатели гемоглобина (<10 г/дл) и Kt/V (<1,2), тогда как параметры калия в сыворотке крови и интрадиализной массы были аналогичными наблюдавшимся у пациентов без пропусков сеансов ГД. Четырехмесячный риск по крайней мере 1 пропуска сеанса ГД был самым высоким в Соединенных Штатах – 24%, затем 20 и 14% соответственно в ССАГПЗ и России и 6–10% в Австралии – Новой Зеландии, Великобритании, Канаде, Швеция и Турции. При этом в таких странах, как Япония и Италия, такой риск оставался на уровне <1%.
Было установлено, что у пациентов, пропускавших минимум 1 сеанс диализа в течение 4 месяцев, отмечается увеличение риска смерти в среднем на 68%. Это обстоятельство поднимает вопрос: почему показатель смертности так чувствителен к пропуску даже одного сеанса лечения ГД? Влияет ли один пропущенный сеанс ГД на электролитный баланс, что приводит к долгосрочным необратимым нежелательным последствиям для здоровья; и/или отражает ли это неизмеренные показатели бремени ХБП, низкого качества медицинской помощи или плохой приверженности пациентов в целом; или связаны с социокультурными причинами, также связанными с худшим выживанием?
В качестве еще одного важного последствия низкой приверженности к терапии диализом является 4-кратное увеличение частоты госпитализаций [28].
В исследовании 5 DOPPS пациенты, пропустившие 1 или более сеансов лечения в течение 4 месяцев, были моложе и имели более короткий стаж диализа, а также более короткое среднее время сеанса ГД по сравнению с комплаентными пациентами.
Молодые пациенты могут чувствовать себя физически лучше, что приводит к пропускам сеансов ГД. Медицинская неграмотность может способствовать восприятию пациентами на ГД неправильного представления о том, что пропуск сеанса диализа не окажет значительного влияния на здоровье. Brar et al. [29] установили, что это вторая по значимости причина снижения приверженности терапии после проблем с транспортировкой пациентов в центр ГД. Также было высказано предположение, будто пропуск лечения может быть для пациентов одним из способов самоконтроля состояния своего здоровья.
Результаты исследования 5 DOPPS показывают, что время в пути до центра ГД более часа четко связано со снижением приверженности терапии ГД. У пациентов с организованной транспортировкой отмечена лучшая посещаемость диализа, чем в случае использования общественного транспорта [30]. Таким образом, обеспечение хорошей транспортной доступности позволяет улучшить приверженность пациентов на ГД.
По данным 5 DOPPS, у пациентов с низкой приверженностью к терапии ГД имели место значительное ухудшение общего состояния здоровья, более низкие показатели шкалы ментального здоровья (MCS), а показатель шкалы депрессии (CES-D>10) был в 1,7 раза выше, что свидетельствует о выраженных проявлениях депрессивной симптоматики [27].
Таким образом, низкая приверженность терапии ГД обусловливает значительное ухудшение клинических результатов пациентов с ХБП-5D, включая более высокие показатели смертности и госпитализации; неудовлетворительный контроль гиперфосфатемии и костно-минеральных нарушений, а также анемии; недостижение адекватности диализа; более низкие показатели качества жизни на фоне выраженной депрессивной симптоматики и тяжелого бремени ХБП. При этом более чем 50-кратная разница в частоте пропусков сеансов ГД в разных странах и значительная вариабельность таких случаев в разных диализных центрах отдельных стран убедительно свидетельствуют о том, что ситуацию с приверженностью терапии этой категории пациентов можно изменить в лучшую сторону [27].
Гипофосфатная диета
Гипофосфатная диета остается неотъемлемой частью терапии гиперфосфатемии у пациентов с ХБП. К сожалению, коррекция питания не всегда учитывается перед началом медикаментозной терапии и пациенты не получают адекватной информации о составе пищи. Ограничение потребления фосфатов сильно влияет на уровень сывороточного Рi.
Какие стратегии могут снизить потребление фосфатов с пищей?
Прямая связь между содержанием белка и фосфатов в пищевом рационе хорошо известна: в среднем смешанная диета содержит 12–14 мг фосфатов на 1 г белка [31]. Ограничение потребления белка пациентами с ХБП на додиализных стадиях позволяет уменьшить потребление фосфатов. Однако такие ограничения невозможны для пациентов на диализе, с учетом их высоких потребностей в белке, следовательно, необходимо использовать другие стратегии для данной категории больных ХБП.
Стратегии ограничения потребления фосфатов для пациентов на диализе:
Увеличение потребления продуктов с низким содержанием фосфатов и/или низкой биодоступностью фосфатов.
Анализ содержания фосфатов (мг/100 г съедобной части пищи).
Известно, что из всех продуктов наибольшую нагрузку по фосфатам составляют орехи, твердые сыры, яичный желток, мясо, птица и рыба. Использование фосфат-белкового коэффициента (ФБК), определяющего содержание фосфатов в мг на 1 г белка (мг/г белка), особенно полезно при выборе продуктов, содержащих меньше фосфатов при одинаковом количестве белка. Основываясь на взаимосвязи между фосфатами и белками, был принят верхний предел 12 мг/г для определения продуктов с «хорошим» ФБК [32].
Помимо абсолютного содержания фосфатов определяющим фактором является степень абсорбции фосфатов в кишечнике. В целом всасывание в кишечнике фосфатов из продуктов растительного происхождения ниже, чем животного происхождения, например из мяса, рыбы, птицы и молочных продуктов [33].
Отваривание продуктов
Кипячение вызывает деминерализацию пищи, что снижает содержание фосфатов, а также натрия, калия и кальция в продуктах растительного и животного происхождения. Степень потери минералов пропорциональна количеству кипящей воды, размеру кусочков и времени приготовления. Установлено снижение фосфатов после варки в овощах на 51%, в бобовых – на 48 и в мясе – на 38% [34]. Следует отметить, что кипячение снижает содержание фосфатов при незначительной потере азота [35], что обеспечивает улучшение ФБК.
Выявление и рекомендации избегать потребления неорганических фосфатных пищевых добавок
Фосфаты – основной компонент нескольких добавок (фосфорная кислота, фосфаты и полифосфаты), используемых в пищевой промышленности для продления срока хранения, улучшения цвета или вкуса и сохранения влаги в продуктах [38]. Пищевые консерванты добавляются на различных этапах производства, обработки, приготовления, упаковки, транспортировки или хранения. Также фосфорную кислоту обычно добавляют в безалкогольные напитки (например, кока-кола). Количество фосфатов, потребляемых с консервантами, значительно по сравнению с содержанием природного фосфора в продуктах. При этом неорганические фосфаты практически полностью абсорбируются в кишечнике [36]. Поэтому гипофосфатную диету следует начинать с идентификации продуктов питания с многочисленными пищевыми добавками, содержащими неорганические фосфаты, например готовых замороженных продуктов, сухих пищевых смесей или консервов: их следует избегать! [37] Использование простой и понятной информации об ингредиентах на упаковке пищевых продуктов могло бы поддержать пациентов в этой важной цели [39]. Действующие правила требуют от производителей сообщать о наличии фосфорсодержащих добавок на этикетках пищевых продуктов, но указания их количеств не требуется и недоступно в большинстве баз данных о составе пищевых продуктов. Кроме того, в России на этикетках пищевых продуктов редко указаны консерванты по их полному названию (как, например, в США), а обычно по сокращению (как серия «Е»): например, от E340 до E349 – это фосфорсодержащие консерванты, используемые в качестве антиоксидантов, в то время как от E450 до E458 служат загустителями, эмульгаторами и регуляторами кислотности. Этот дополнительный фосфор иногда также называют «скрытый фосфор», т.к. он обычно не появляется в общих базах данных и в таблицах составов пищевых продуктов [36]. Установлено, что дополнительная нагрузка фосфатами, поступающими из обработанных продуктов, может достигать 700–800 мг в день [37]. Такое высокое содержание фосфатов может уменьшать эффективность и увеличивать стоимость терапии фосфат-связывающими препаратами. Трехмесячная образовательная программа для пациентов на диализе по исключению потребления продуктов с фосфорсодержащими добавками обеспечила снижение уровня фосфатов в сыворотке крови на 1 мг/дл [40].
Образование пациентов и диетологическое консультирование
Обучение пациентов играет ключевую роль в управлении приверженностью гипофосфатной диете. Пациенты на диализе нуждаются в информации о пищевых источниках фосфатов, особенно «скрытых» фосфатах, т.к. часто просто не знают о фосфатных пищевых добавках в продуктах и напитках. Осведомленность пациентов с ХБП о фосфатах в продуктах в целом ниже, чем о других питательных веществах (натрий, калий и белки) [41]
Систематический обзор эффективности образовательных стратегий по снижению фосфатов у пациентов ХБП с гиперфосфатемией показал среднее уменьшение уровня сывороточных фосфатов на 0,72 мг/дл после любого образовательного вмешательства, с последующим снижением до 1,07 мг/дл, когда образовательные мероприятия продолжались более 4 месяцев [42].
Следует сосредоточиться на непосредственном участии в образовательном процессе не только пациентов, но и лиц, осуществляющих уход за ними, с особым вниманием к членам семьи, участвующим в выборе, покупке продуктов и приготовлении пищи. Содержание курса должно быть актуальным и своевременным. Формат должен быть интересным и иметь практическое применение в жизни пациента.
Новые образовательные инициативы включают маркировку продуктов питания с использованием схемы «светофора», мотивационных методов интервьюирования и программы обучения контроля над фосфатами, направленной на осознанное использование фосфат-связывающих препаратов (ФСП) [43].
Диетологическое консультирование играет важную роль в повышении приверженности гипофосфатной диете. Консультирование по вопросам питания больных ХБП может способствовать получению не только лучшего контроля параметров костно-минерального обмена, в частности фосфатов, но и других нарушений метаболизма, характерных для уремического статуса. При этом диетологическое вмешательство не должно ограничиваться сообщением пациенту, чего следует избегать, но и содержать предложения решения и альтернативных вариантов с учетом пищевых предпочтений пациентов, особенно при составлении плана питания. Рекомендации по питанию при ХБП наиболее эффективны, если они соответствуют конкретным потребностям и интересам пациентов. Пациенты обычно пытаются выбрать продукты, соответствующие их предпочтениям. Они постоянно будут стремиться к выбору знакомых и доступных для них продуктов. Адаптация существующих рецептов и методов питания часто будет более успешной, чем создание новых, менее знакомых рецептов блюд. Еще одна эффективная стратегия – уменьшение размеров порций для существующих рецептов, а не резкое изменение их ингредиентов [44]. Индивидуализация и личное общение служат краеугольным камнем достижения более высокой приверженности. В последнее время были разработаны стратегии, направленные на повышение приверженности пациентов рекомендациям диетологов по питанию на диализе. Среди них наиболее часто используются технологии «говорящего контроля» и интеграции с устройствами, принадлежащими пациенту (например, приложения для компьютеров и смартфонов) [45].
Существует твердое убеждение, будто в каждом нефрологическом отделении должен быть диетолог. Однако эта цель остается недостижимой в ближайшей перспективе. Государственные службы здравоохранения в целом не считают важным консультирование по вопросам питания. Даже в США, где хорошо развита служба диетологов, отмечается, что только 12% посещений медицинских офисов включают консультирование по диете у пациентов, страдающих сердечно-сосудистыми заболеваниями, диабетом, ожирением, АГ и ХБП [46]. В такой ситуации наличие простых, но эффективных инструментов может быть очень важным компонентом для образовательных программ для пациентов по снижению содержания фосфора. Такими инструментами могут быть, например, брошюры для пациентов с ХБП, предназначенные для облегчения выбора пищевого рациона, доступные в режиме онлайн, электронные приложения.
Использование инфографики (фосфатная пирамида) [47]
Цель создания итальянскими нефрологами данной пирамиды состоит в упрощении для пациентов выбора продуктов, обеспечивающих снижение фосфатной нагрузки, без необходимости запоминать содержание фосфатов в каждом продукте питания.
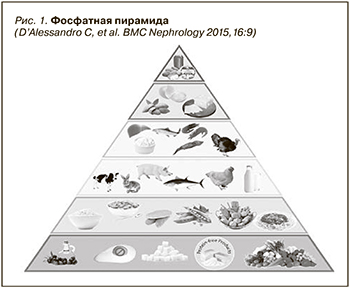 Пирамида состоит из шести уровней, в которых продукты расположены на основе содержания фосфатов, ФБК и биодоступности фосфатов. Каждый уровень имеет цветовую шкалу (от зеленого до красного), соответствующую рекомендуемой частоте потребления тех или иных продуктов (рис. 1).
Пирамида состоит из шести уровней, в которых продукты расположены на основе содержания фосфатов, ФБК и биодоступности фосфатов. Каждый уровень имеет цветовую шкалу (от зеленого до красного), соответствующую рекомендуемой частоте потребления тех или иных продуктов (рис. 1).
Уровень 1: низкое содержание или низкая биодоступность фосфатов – потребление без ограничений.
Уровень 2: фосфор содержится в виде фитатов (растительная пища) – потребление 2–3 раза/сут.
Уровень 3: продукты животного происхождения с низким соотношением Р/белок – потребление 1 раз/сут.
Уровень 4: высокое соотношение Р/белок (>12 мг/г) – потребление 1 раз/нед.
Уровень 5: высокофосфатные продукты – потребление 2–3 раза/мес.
Уровень 6: продукты с пищевыми добавками – максимально избегать потребления.
Лекарственная терапия
Лекарственная терапия является третьим уровнем лечения гиперфосфатемии и МКН-ХБП. Теоретически лекарственная терапия должна рассматриваться после оптимизации диализа и диеты. К сожалению, частое отсутствие организационных и логистических ресурсов, необходимых для оптимизации диализного лечения, а также неудовлетворительная приверженность пациентов предписанной диетотерапии делают медикаментозную терапию необходимым подходом для большинства пациентов на диализе. И тогда одной из главных проблем пациентов на диализе становится высокая лекарственная нагрузка, часто связанная с применением фосфат-связывающих препаратов (ФСП). Применение различных лекарственных препаратов позволяет индивидуализировать терапию.
Фосфат-связывающие препараты
ФСП являются наиболее часто используемым лекарственным средством для пациентов на диализе. Их влияние на всасывание Рi в кишечнике служит важным компонентом при лечении гиперфосфатемии. Отсутствие в настоящее время четких рекомендаций и рандомизированных интервенционных исследований, способных с высокой степенью доказательности указать первую линию в выборе ФСП, делает терапию этими препаратами одним из наиболее персонализированных методов лечения пациентов с ХБП.
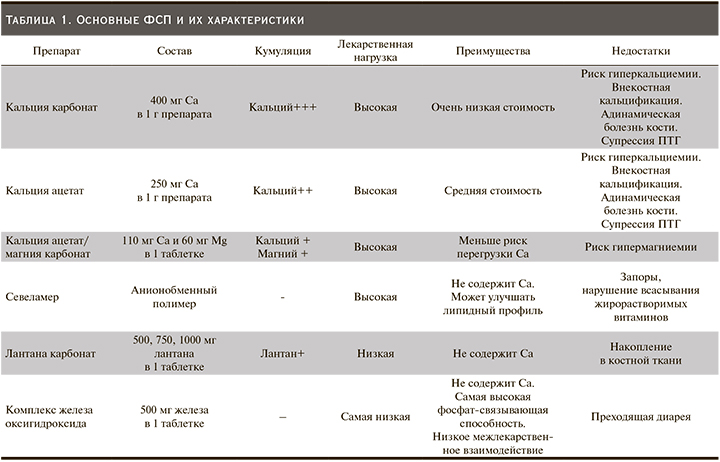
В арсенале нефрологов сегодня имеются различные ФСП (характеристики представлены в табл. 1). ФСП подразделяются на два основных класса: кальцийсодержащие и бескальциевые. Несмотря на массу ФСП, в настоящее время в Европе только 52% пациентов поддерживают уровень фосфатов в сыворотке крови в пределах целевых значений KDOQI [48]. Отчасти это можно объяснить снижением приверженности к терапии этими препаратами из-за большого числа таблеток, необходимых для лечения, и частых побочных эффектов, особенно со стороны ЖКТ, характерных для всех препаратов этой группы. По данным систематического обзора, посвященного приверженности терапии ФСП у пациентов на ГД, низкие показатели приверженности терапии ФСП отмечены от 22 до 74% [49].
В этом обзоре представлен анализ влияния различных факторов, влияющих на приверженность терапии ФСП:
Основные демографические факторы низкой приверженности пациентов терапии ФСП:
- возраст – молодой возраст,
- семейное положение – одинокие,
- образование – низкий уровень,
- доход – низкий уровень,
- социальный статус – безработные и самозанятые.
Основные факторы приверженности пациентов терапии ФСП, связанные с лекарственными препаратами:
- недостаток информации о лекарственных средствах,
- общее количество таблеток, общее количество
назначенных ФСП,
- размеры и вкус таблеток,
- эффективность – относительная фосфат-связывающая способность (коэффициент в пересчете относительно активности карбоната кальция),
- сложность режима приема (частота, график приема, дозировки),
- удобство применения (жевательные таблетки),
- переносимость (побочные эффекты),
- доступность – высокая стоимость препарата, покрываемая страховкой [50].
Существует два типа нарушений приверженности лечению ФСП:
• Непреднамеренное (ситуационное): пациенты не соблюдают курса лечения, потому что они не имеют возможности принять ФСП, могут забыть принять препарат; лишены возможности приобрести; не знать, как правильно принимать (всегда во время еды, включая «перекусы», а не только с основными приемами пищи). Это препятствия для приверженности, которые можно компенсировать повышением доступности ФСП, использованием памяток и инфографики для упрощения понимания пациентами схем терапии.
Одной из главных причин нерегулярного приема лекарств, по мнению самих пациентов, остается забывчивость. Тем, кто забывает принимать таблетку, могут помочь различные технические средства напоминания. Самое простое из них – обычный будильник. Также можно использовать наручные часы или мобильный телефон, они имеют функцию выставления напоминаний и очень удобны для использования в общественных местах. Некоторым пациентам помогает ведение дневника с указанием режима приема препаратов, включая время, дозировки и диетические предписания. После приема определенной дозы они делают отметку в списке. Можно повесить напоминание или картинку на внутреннюю сторону входной двери или на холодильник. Более сложным и наукоемким воплощением той же идеи стали телефонные, электронные и почтовые напоминания, а также разнообразные электронные устройства для напоминания о приеме препарата – от простой коробочки до таблетницы-смарт системы с микрочипом (см. рис. 2).
При приеме одновременно нескольких препаратов несколько раз в день удобны специальные коробочки для лекарств с отсеками разного цвета для разных дней недели. Они позволяют принимать несколько препаратов по схеме без существенных отклонений даже пожилым пациентам.
В последние годы появились различные варианты электронных таблетниц. Например, система Med Signals, которая имеет несколько различных отсеков для разного вида таблеток, где можно указать часы приема того или иного препарата. В установленное время устройство напоминает о необходимости принять лекарство и запоминает, когда пациент открыл крышку, чтобы взять таблетку, а также может передавать все данные лечащему врачу, загружая их на удаленный сервер.
• Преднамеренное (поведенческое): пациенты не выполняют назначений, потому что они сознательно решили не делать этого из-за собственных убеждений или предпочтений. Это воспринимаемые барьеры для приверженности (см. рис. 3) В этом случае мотивация становится существенным фактором для получения соответствующих результатов приверженности. Это одна из самых сложных проблем, которую необходимо преодолеть, но врачи способны сделать это.
Независимо от того, являются ли нарушения приверженности преднамеренными или непреднамеренными, неадекватность лечения препятствует получению пациентами полной пользы от назначенных лекарственных средств. Более того, несоблюдение режима приема ФСП пациентами с терминальной ХБП связано со снижением эффективности проводимой терапии и увеличением показателей госпитализаций и смертности [51]. Таким образом, приверженность терапии ФСП – это ключевой компонент эффективного ведения пациентов на диализе.
Основные положения при выборе ФСП
Во-первых, это состав. Присутствие некоторых катионов, таких как кальций, алюминий или лантан, может обусловливать развитие у пациентов системных побочных эффектов, связанных с их накоплением. Например, длительное широкое применение в прошлом алюминий-содержащих ФСП было связано с церебральной, гематологической и костной токсичностью [51]. Костная токсичность также развивалась при применении лантана карбоната [52]. Са-содержащие ФСП (кальция карбонат и ацетат) характеризуются оптимальным соотношением затраты/эффективность, поэтому они часто применяются в качестве первой линии терапии. Но эти препараты могут индуцировать развитие и/или прогрессирование внекостной кальцификации и нарушения обмена костной ткани, повышая риск сердечно-сосудистых осложнений и смерти пациентов с ХБП [53]. Использование добавок Mg или Ca-Mg в составе ФСП (ОсваРен) может уменьшать кальциевую нагрузку и одновременно корректировать уровни Mg, часто сниженные у пациентов с ХБП. Кроме того, это может обеспечивать снижение уровня Рi и ПТГ, а также улучшать модуляцию процессов кальцификации сосудов и минерализации костной ткани [54]. Препаратами выбора являются бескальциевые ФСП (севеламер, лантана карбонат, комплекс оксигидроксида железа). Два мета-анализа показали, что бескальциевые ФСП по сравнению с кальцийсодержащими снижают смертность среди пациентов с ХБП [55, 56]. Мета-анализ 11 открытых рандомизированных исследований (4622 пациента) выявил 22%-ное снижение смертности от всех причин среди пациентов, получавших бескальциевые ФСП (севеламер, 10 исследований, включавших 3268 пациентов, или лантана карбонат, одно исследование, включившее 1354 пациента) по сравнению с ФСП на основе кальция (относительный риск [ОР был равен 0,78; 95% ДИ – 0,61–0,98) [56]. В соответствии с международными рекомендациями KDIGO сегодня предлагается ограничивать дозировки кальцийсодержащих ФСП всем взрослым больным ХБП С3а–С5Д, в отличие от старой версии, где это ограничение относилось только к пациентам со стойкой или рецидивирующей гиперкальциемией [8]. Недавно в клиническую практику были внедрены ФСП на основе железа. Наиболее часто используется комплекс железа оксигидроксида (Вельфоро® 500). Комплекс железа оксигидроксида обладает самой высокой фосфат-связывающей способностью среди существующих ФСП, обеспечивая снижение лекарственной нагрузки и повышение приверженности фосфат-снижающей терапии пациентов на диализе. Таким образом, комплекс железа оксигидроксида представляет хороший выбор в лечении гиперфосфатемии, обеспечивая оптимальные возможности для поддержания долгосрочной приверженности [57, 58].
Второй момент, который необходимо учитывать при назначении ФСП, – это лекарственная нагрузка, поскольку контроль Рi часто невозможен при назначении только одного класса ФСП. Кроме того, часто требуется сочетание различных молекул для уменьшения эффекта накопления при использовании высоких доз одного ФСП. К сожалению, большая часть не содержащих кальция ФСП имеют достаточно высокую стоимость. Недавнее исследование 233 пациентов на диализе показало, что общая лекарственная нагрузка составляет 19±12 таблеток в день. Интересно, что в этой когорте ФСП составляли более чем 50% от общего числа таблеток, принимаемых пациентами на диализе. Субанализ, проведенный в этой когорте, продемонстрировал прогрессирующее снижение общей приверженности и качества жизни с увеличением лекарственной нагрузки [59]. Согласно руководству по диализной терапии Daugirdas et al., по лекарственной нагрузке существующие ФСП распределены следующим образом: самое высокое количество таблеток у севеламера <препараты кальция <лантана карбонат <оксигидроксида железа [60]. Снижение лекарственной нагрузки при применении комплекса железа оксигидроксида почти в 3 раза по сравнению с севеламером в условиях долгосрочного РКИ с участием более 1000 пациентов обеспечило существенное увеличение приверженности терапии ФСП до 86% у пациентов на ГД и > 91% на ПД [57]. Результаты когортных исследований эффективности комплекса железа оксигидроксида в условиях реальной практики в течение года у пациентов на ГД [58] и ПД [61] демонстрируют, что переход на монотерапию комплексом железа оксигидрокида с других ФСП, обеспечивает двукратное увеличение доли пациентов, достигших целевых уровней сывороточных фосфатов при 50%-ном снижении лекарственной нагрузки ФСП. Высокие показатели MPR у большинства этих пациентов свидетельствует, что это может быть результатом улучшения приверженности терапии [62].
Тип ФСП, используемого диализными пациентами, может влиять на частоту госпитализаций. Установлено, что у пациентов, которым назначался комплекс оксигидроксида железа, отмечены более низкие показатели частоты госпитализаций по сравнению с больными, получавшими другие ФСП (7,97 на 100 пациентов/мес.). Наиболее высокая частота госпитализаций на 100 пациентов/мес. отмечена у пациентов, получавших кальция ацетат (Eliphos, PhosLo), – 11,28 (+42%), затем по мере убывания для севеламера (Renagel, Renvela) – 10,52 (+32%), железа цитрата (Auryxia) – 9,54 (+20%), лантана карбоната (Fosrenol) – 8,86 (+11%) [50]. Таким образом, по сравнению с комплексом железа оксигидроксида, терапия другими ФСП демонстрировала более высокую частоту госпитализаций: от 11 до 42%. Авторы также сообщили, что общие затраты на лечение были наименьшими при назначении комплекса железа оксигидроксида по сравнению с другими ФСП. Средняя ежемесячная стоимость терапии в расчете на одного пациента, получавшего лечение комплексом оксигидроксида железа, составила 5670 долл., расходы на лечение одного пациента цитратом железа, карбонатом лантана, ацетатом кальция и севеламером в среднем имели более высокие показатели и составили 6104, 6303 и 6354 долл. соответственно [64]. В Российской Федерации метод «анализ влияния на бюджет» показал, что терапия препаратом Вельфоро® 500 – наименее затратная схема лечения гиперфосфатемии у больных ХБП, а также с позиции анализа «затраты–эффективность» доминантная технология лечения гиперфосфатемии у больных ХБП по сравнению с другими фосфат-связывающими препаратами [67].
Третий компонент, влияющий на приверженность ФСП, – соотношение эффективности и переносимости лекарственной терапии. Отсутствие субъективного улучшения самочувствия от проводимой терапии (что имеет место при лечении гиперфосфатемии) при развивающихся побочных эффектах ФСП служит важным фактором снижения приверженности. В связи с этим существует необходимость разъяснения пациентам опасности гиперфосфатемии и необходимости строгого конт-роля сывороточного фосфора в целевых диапазонах. В такой ситуации для пациентов критерием эффективности терапии ФСП следует считать снижение уровня фосфатов в сыворотке крови. Недавно были опубликованы результаты двухлетнего сравнительного анализа базы данных пациентов, в котором оценивалась эффективность фосфат-снижающей терапии в условиях реальной практики в центрах гемодиализа США при переходе на лечение комплексом окигидроксида железа с других ФСП (кальция ацетат, севеламер, лантана карбонат и их комбинации). У 676 (82,6%) пациентов, включенных в анализ, отмечались уровни фосфатов в сыворотке крови > 5,5 мг/дл в начале исследования, несмотря на то что все они получали ФСП [63]. Такая пропорция существенно выше, чем средняя частота гиперфосфатемии (36%), установленная для популяции пациентов на диализе в США [65]. Это свидетельствует о том, что комплекс окигидроксида железа назначали «сложным» пациентам, не достигшим целевых уровней фосфатов в сыворотке крови, что обычно сопровождается снижением приверженности терапии. Доля пациентов в группе, получавшей комплекс окигидроксида железа, достигших целевых уровней фосфатов в сыворотке крови (≤5,5 мг/дл), увеличилась на 120% в течение 2-летнюю периода наблюдения, при снижении лекарственной нагрузки – на 50% [64]. Применение комплекса окигидроксида железа сопровождалось снижением числа госпитализаций пациентов. В фармакоэкономической модели, основанной на уменьшении числа госпитализаций, была рассчитана годовая экономия средств (566 295 долл. на 100 пациентов) для завершивших 2- летнюю терапию комплексом окигидроксида железа [64].
Клиницисты должны быть хорошо осведомлены о возможных побочных эффектах лекарственных препаратов, которые приводят к снижению приверженности, а также быть в курсе современных стратегий, повышающих приверженность в этой особой группе пациентов, в т.ч. снижение лекарственной нагрузки.
Для большинства ФСП характерны побочные эффекты со стороны ЖКТ (тошнота, рвота, диарея, запоры, абдоминальные боли). При назначении севеламера чаще развиваются запоры, в то время как при лечении комплексом оксигидроксида железа может быть появление преходящей диареи в начале лечения [66].
Необходимо также улучшить образование пациентов относительно режима их лечения, а также давать краткие понятные инструкции по применению лекарственных средств во избежание путаницы.
Выводы и перспективы на будущее
Несмотря на многочисленные возможности лечения, до сих пор гиперфосфатемия и связанные с нею минерально-костные нарушения представляют собой трудноразрешимую проблему терапии больных ХБП. Данные, представленные в настоящем обзоре, подчеркивают важность правильного лечения гиперфосфатемии на уровне как клинициста, так и пациента. В табл. 2 представлены общие предложения по улучшению приверженности назначенной терапии. Врачи-клиницисты должны осознавать важность приверженности пациентов адекватным режимам диализа, диеты и лекарственной терапии в комплексе и добиваться осознания этих позиций самими пациентами. При этом они должны четко объяснять пациентам потенциальный вред, связанный с гиперфосфатемией и МКН-ХБП.

При лечении гиперфосфатемии следует учитывать то обстоятельство, что пациенты, которые в большинстве своем страдают от осложнений ХБП, часто не мотивированы к дальнейшему изменению привычного образа жизни или приему большого числа (часто плохо переносимых) таблеток.
По всем этим причинам лечение гиперфосфатемии и МКН-ХБП в целом всегда нуждается в персонализации во всех трех направлениях, рассмотренных в этом обзоре.
В дальнейшем следует проводить терапию гиперфосфатемии комплексно, применяя оптимальные режимы диализной терапии, обучение и контроль диетического потребления фосфатов с использованием ФСП, обладающих наибольшей эффективностью и хорошей общей переносимостью. При этом необходимы усилия по повышению приверженности пациентов к назначенной фосфат-снижающей терапии и активного вовлечения в лечебный процесс.



