Введение
Синегнойная палочка (Pseudomonas aeruginosa) – условно-патогенный микроорганизм, вызывающий гнойно-септические оппортунистические инфекции. Таксономическое положение: царство Bacteria, класс γ-Protobacteria, порядок Pseudomonadales, семейство Pseudomonadaceae. Это аэробная грамотрицательная неспорообразующая палочка рода Pseudomonas. Род включает около 200 видов бактерий. В настоящее время P. aeruginosa рассматривается как один из основных возбудителей нозокомиальных инфекций наряду с P. stutzeri, P. fluorescens, P. putida [1–3].
Свое название возбудитель получил благодаря сине-зеленой окраске, выявляемой при культивировании. Впервые Charles-Emmanuel Sedillot (1850), французский хирург, автор термина «микроб», обратил внимание на изменение цвета хирургических повязок, наложенных на раневую поверхность больного. Повторно к теме сине-зеленой окраски повязок вернулся немецкий ученый A. Lücke (1862). И наконец Carle Gessard (1882) в своем труде «о сине-зеленом окрашивании бинтов» описал данный микроорганизм, выделенный им из кожных ран двух пациентов с голубовато-зеленым гноем [3, 4]. C. Gessard же дал и название новому микроорганизму «Bacillus pyocyaneus». Название роду «Pseudomonas» дал Walter Migula (1894).
P. aeruginosa распространена повсеместно! Комфортными условиями существования синегнойной палочки являются повышенная влажность и устойчивый температурный режим около 37°С (хотя могут размножаться в широком диапазоне температур – от 4° до 42°С), которые как раз создаются в лечебно-профилактических учреждениях. P. aeruginosa выделяют из медицинского оборудования, уретральных катетеров, увлажнителей, физиотерапевтических ванн [3, 5]. В дистиллированной воде P. aeruginosa может жить и размножаться в течение 2,5 месяцев.
Возбудитель участвует в развитии нозокомиальных инфекций, от которых ежегодно страдают более 2 млн пациентов [6]. В первую очередь это больные муковисцидозом, хронической обструктивной болезнью легких, пневмонией, инфекциями мочевыделительной системы, пациенты с нейтропенией, ВИЧ-инфицированные. Данная инфекция может осложнять течение хронических ран кожи, в особенности у инсулинорезистентных пациентов, стать причиной отторжения имплантов при пересадке или эндопротезировании, гнойно-септических осложнений ожоговых ран [1].
Это аэробная грамотрицательная неспорообразующая подвижная палочка рода Pseudomonas. Микроорганизм имеет 1–2 полярных жгутика.
В микробиологическом мазке бактерия располагается одиночно, попарно либо в виде коротких цепочек.
P. aeruginosa синтезирует крахмалоподобную слизистую субстанцию. Это макромолекулярный комплекс, гликолипопротеид, покрывающий поверхность микробной клетки, не формирующий слоя в составе клеточной оболочки, но выделяющийся во внешнюю среду. Он имеет антигенную специфичность, обладает токсическими (и даже летальными) свойствами, вызывает лейкопению и подавляет функцию фагоцитов [1, 3].
Особый интерес к P. aeruginosa обусловлен тяжестью вызываемых инфекцией заболеваний, высокой частотой летальных исходов и устойчивостью микроорганизма к большинству антибактериальных препаратов. Данные свойства реализуются благодаря следующим факторам патогенности: способностью вырабатывать экзотоксины (экзотоксин А, экзоэнзим S, цитотоксин), эндотоксины, коллагеназу, протеазы (подавляют комплемент-зависимые механизмы защиты), лецитиназу, нейраминидазу, эластазу, флагеллин, нитратредуктазу и др. (высокая протеолитическая активность).
Бактерии рода Pseudomonas свободноживущие, не ферментируют глюкозу (низкая сахаролитическая активность), но при этом используют в качестве источника энергии или пластического материала почти все природные органические соединения. Они имеют ограниченную потребность в питательных веществах, хеморганотрофы [1, 3]. P. aeruginosa продуцирует бактериоцины – пептиды, обладающие противомикробной активностью: пиоцины – пептиды, действие которых направлено против представителей своего же рода. Особенно хорошо известны пиоцианин (окрашивает среду и бинты в сине-зеленый цвет) и флюоресцин (светится в лучах лампы Вуда).
Синегнойная палочка умеет защищаться от УФ-лучей, вырабатывая пигмент мелатонин.
P. aeruginosa имеет антигены: соматический – О, жгутиковый – Н, капсульный – К (у мукоидных штаммов).
Факторы патогенности P. aeruginosa: экзотоксин А (нарушает организацию матрицы белкового синтеза), экзоэнзим S (ответствен за гнойные процессы в легких), цитотоксин (вызывает цитолиз), гемолизин, фосфолипаза С, эндотоксин (высвобождается после гибели бактерии), энтеротоксический фактор (причина диареи), нейраминидаза [1]. Ферментные системы микроорганизма обеспечивают ему способность к инвазии, персистенции в тканях, цитотоксичности, стимуляции генерализованной воспалительной реакции.
Экзотоксину А принадлежит ведущая роль в развитии хронической инфекции, вызванной P. aeruginosa. Впервые данный фактор вирулентности описан V.P. Liu (1966) как экстрацеллюлярный белок, обладающий высокой летальной активностью для экспериментальных животных [7]. Считается, что экзотоксин А приводит к ингибированию белкового синтеза и клеточному апоптозу.
Фосфолипаза С лизирует клетки эукариотов путем нарушения функции цитоплазматической клеточной мембраны с образованием в ней дополнительных пор; она способствует также высвобождению интерлейкинов-1 и -6, интерферона-γ из моноцитов. Экзотоксин S, флагеллин, нитратредуктаза, пиоцианин и другие инициируют секрецию провоспалительного медиатора – фактора некроза опухоли-α. Из бактериальной клетки с помощью специальной системы экскреции во внешнюю среду поступают экзоэнзимы, воздействующие непосредственно на мембраны клетки хозяина: это экзотоксины (ExoS; ЕхоТ; ExoY; ExoU) и протеины (PerV; PerB; PerD). В результате достигается эффект, характерный для большинства оппортунистических микроорганизмов: снижение синтеза ДНК и стимуляция апоптоза. Лавинообразное нарастание этого процесса клинически ведет к развитию септического шока [2].
Условия, необходимые для реализации патогенных свойств бактерии, заключаются в нарушении целостности кожных покровов, а также зависят от иммунного статуса макроорганизма. В группу риска входят пожилые люди, пациенты с иммунодефицитом, онкозаболеваниями, сахарным диабетом.
Особое внимание направлено на способность синегнойной палочки образовывать биопленки. Биопленки P. aeruginosa потенциально могут влиять на клинические исходы пациентов с хроническими ранами [8]. В одном из исследований G.A. James et al. проведен микроскопический анализ из образцов хронических ран, который показал наличие плотных колоний микроорганизмов. При этом подобной картины в очагах острых ран не отмечено [9].
P. aeruginosa обладает способностью к неспецифической и специфической адгезии. Путем неспецифической адгезии могут быть инфицированы катетеры, канюли, эндотрахеальные трубки. Механизм специфической адгезии связан с белками плазмы, которые являются адгезинами для этих микроорганизмов. С помощью поверхностных ворсин осуществляется прилипание к эпителию. В дальнейшем здесь образуется биопленка, которая представляет собой несколько слоев микробных клеток, объединенных общим гликокаликсом (полисахарид).
Фактором резистентности биопленки к антибактериальным агентам является низкий метаболизм у значительной части ее участников, которые как бы находятся в состоянии покоя и потому не чувствительны к антибиотикам. Между участниками биопленки возникает межклеточная сигнальная система «чувство кворума» (quorum sensing), посредством которой осуществляется регулирование плотности бактериальной популяции и синтез факторов патогенности. Та же система обеспечивает формирование устойчивости не только к антибиотикам, влияющим на метаболизм клеток, но и к антисептикам и дезинфектантам группы окислителей [1, 2].
В основе регулирования межклеточных взаимодействий отдельных бактериальных клеток – участников биопленки лежит принцип подчинения функционирования генетического аппарата каждой клетки общим интересам популяции [10]. Бактерии как бы продолжают свой путь к «многоклеточности». В частности, у P. aeruginosa имеются системы активации или подавления экспрессии отдельных генов в зависимости от плотности клеток в биопленке – las- и rhl-системы.
В качестве компонентов каждой системы функционируют два гена, из которых один кодирует специальный фермент – синтетазу специфического лактона (аутоиндуктор-ацилированный гомосеринлактон); другой осуществляет информационную поддержку выработки активатора транскрипции.
В дальнейшем активатор транскрипции свяжется со специфическим лактоном и комплекс поступит в межклеточную среду для передачи «дальнейших инструкций» другим бактериальным клеткам. Для выброса сигнальных молекул в межклеточную среду бактерия использует MexEF-OprN-помпу и помпу гомосеринлактона [11].
Las-система контролирует экспрессию генов, кодирующих количество и активность ферментов эластазы А, В и щелочной протеазы, а rhl-система – синтез пиоцианинов [11].
В качестве дополнительной, третьей, сигнальной молекулы P. aeruginosa использует некий гидроксихинолон: повышение концентрации в среде этих молекул ведет к увеличению экспрессии гена эластазы В и повышению активности этого фермента.
Факторы риска по колонизации P. aeruginosa: возраст пациентов, пребывание в блоке интенсивной терапии другого ЛПУ, массивная антибиотикотерапия в течение последних 12 месяцев, одновременное назначение нескольких антибиотиков, в особенности цефалоспоринов, фторхинолонов, имипенема.
Высокий риск развития инфекционного воспаления околоногтевого валика, обусловленного P. aeruginosa, отмечается у лиц, имеющих длительный контакт с водой (рис. 1). Заболевание проявляется в виде напряженного паронихия с полным или практически полным окрашиванием ногтевой пластины в зеленый цвет [12].
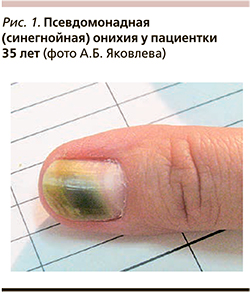
Масса факторов вирулентности, безусловно, является адаптивным механизмом бактерий рода Pseudomonas, способствующим их выживанию. Но вместе с тем синегнойная инфекция редко бывает генерализованной у пациентов с нормальной резистентностью как иммунной, так и неиммунной и целостными анатомическими барьерами, в частности кожным.
Нарушение целостности этих барьеров ведет к активации инфекции вблизи входных ворот, формированию биопленки, массивному проникновению внеклеточного паразита во внутреннюю среду макроорганизма. Системными патофизиологическими явлениями будут в этом случае коагулопатия потребления, гектическая лихорадка, граничащая с гипертермией, септический шок.
P. aeruginosa вместе с другой грамотрицательной (Escherichia coli, Proteus mirabilis, Klebsiella spp.) и грамположительной микрофлорой участвует в развитии гангрены Фурнье. Гангрена Фурнье – тип некротического фасциита промежности, половых органов и перианальной области, имеющий быстропрогрессирующее и потенциально смертельное течение [13]. Заболевание может быть ассоциировано с наличием перианальной, урогенитальной или местной кожной инфекций, а также встречается у людей с колоректальным раком. Заболевают преимущественно люди старше 50 лет с соотношением мужчин и женщин 10:1 [14]. Сахарный диабет и чрезмерное употребление алкоголя служат предрасполагающим фактором развития заболевания и встречаются у 20–70% и 20–50% пациентов соответственно [15]. В ретроспективном исследовании O. Ioanidis et al. (2017) показано, что наиболее частыми изолированными бактериями, вызывающими гангрену Фурнье, были Escherichia coli (45,8%), за которыми следовали Klebsiella pneumoniae (12,5%) и P. aeruginosa (15,5%) [16]. Доля P. mirabilis, тем не менее, приближается к процентной доле P. aerurinosa, и это тоже составляет одну из проблем клиники гнойной хирургии, поскольку известно, что P. mirabilis и P. aerurinosa часто проявляют свойства взаимовыгодного сосуществования – мутуализма.
Клинические проявления заболевания включают боль и отек мошонки, гнойные выделения из промежности. Пораженная область гиперемирована, покрыта мацерированным эпидермисом с резким, гнилостным запахом [17]. Иногда запах бывает своеобразным, напоминающим смесь карамели с аммиаком, неприятным и довольно стойким. Данное состояние часто сопровождается лихорадкой выше 38°C, бледностью кожных покровов, изменением лабораторных параметров.
Влажные участки кожных покровов, складки, а также наружный слуховой проход способствуют росту P. aeruginosa. К основным предикторам развития наружного отита относятся неадекватное применение ватных палочек для гигиены ушей, ношение слухового аппарата, наушников, а также климатические условия с влажной средой. Под термином «наружный отит» понимается воспалительное заболевание ушной раковины и/или наружного слухового прохода [18]. Клинически заболевание проявляется выраженным отеком ушной раковины, сопровождающимся нестерпимой болью, гиперемией, ощущением «пульсации». У ряда больных выявляется регионарный лимфаденит и повышение температуры тела, в особенности при переходе инфекционного процесса с наружных кожных покровов в мягкие ткани. У иммунокомпрометированных пациентов при поздно начатом лечении процесс может перейти на костные структуры и в конечном итоге – к параличу 9 и 11 пар черепномозговых нервов [12].
Еще одним грозным заболеванием, ассоциированным с P. aeruginosa, является гангренозная эктима – первичное или вторичное инфекционное поражение кожи от поверхностных до глубоких слоев (рис. 5), в большинстве случаев протекающее на фоне синегнойного сепсиса [19]. К факторам, влияющим на развитие гангренозной эктимы, относятся детский возраст с иммунодефицитными состояниями, длительная госпитализация, антибиотикотерапия, сопутствующие гнойничковые поражения кожных покровов [20]. Клиническая картина включает стадийность заболевания. В начале формируются эритематозные макулы и папулы, часто окруженные синим ореолом (рис. 2). Вскоре элементы трансформируются в геморрагические буллы, в конечном итоге образующие некротический струп, окруженный эритемой. В общем анализе крови больных гангренозной эктимой выявляются лейкопения или лейкоцитоз, нейтропения, тромбоцитопения, снижение уровня фибриногена.
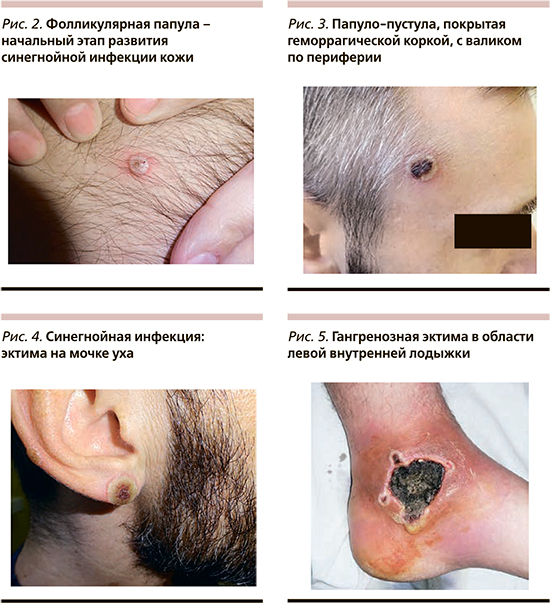
Более легкими поражениями кожи, вызываемыми P. aeruginosa, являются папулезно-пустулезные высыпания со своеобразным течением. В начале на коже образуется фолликулярная папула размером до 5 мм (рис. 2). Затем происходит рост папулы по периферии, и элемент превращается в пустулу размером 10–15 мм. В центре элемента возникает пузырь или эрозия, которая быстро покрывается серозной коркой или корко-чешуйкой, из-под которой при надавливании можно получить скудное отделяемое. Периферия элемента желтовато-зеленая, а центр – темно-коричневый до черного (рис. 3).
Постепенно начинается обратная эволюция высыпного элемента: корочка в центре отпадает, эрозия эпителизируется, но полного заживления не происходит, и в какой-то момент процесс возобновляется, иногда даже до отпадения первой корки. Так, формируется многослойный рупиоидный элемент с тенденцией к распространению в глубину, на подлежащие ткани (рис. 4). Так формируется эктима! Фолликулярные папуло-пустулы быстро распространяются по коже, что приводит к генерализации процесса; последнее представляет угрозу развития сепсиса.
Диагностика синегнойной инфекции начинается на этапе, когда возникает подозрение, основанное на зеленоватом окрашивании перевязочного материала. Насыщенно зеленое окрашивание не характерно даже для зеленящего стрептококка. Начальное исследование необходимо выполнять немедленно, т.к. генерализация инфекции возможна в течение 2–3 часов! Необходимо сразу же исследовать рану и перевязочный материал в лучах лампы Вуда (лучи УФ 340 нм).
При окраске мазка по Граму выявляются грамотрицательные палочки размером 0,5×3 мкм, прямые или слегка изогнутые. P. aeruginosa хорошо окрашивается метиленовой синькой, фуксином, генцианвиолетом [3].
Для выделения и идентификации возбудителя используют культуральный метод с высеванием возбудителя на селективные среды, содержащие антисептики, цетилтриметиламмония бромид, трихлоргидроксифеноловый эфир. Вокруг формирующейся колонии помимо характерного зеленого окрашивания спонтанно развивается феномен «радужного лизиса» [2]. В хирургических, гинекологических, гематологических стационарах при возникновении угрозы синегнойной инфекции проводят генотипирование выделенных штаммов.
Дифференциальный диагноз кожных форм синегнойной инфекции следует проводить с глубокими микозами кожи и подкожной клетчатки (споротрихоз, хромомикоз). Особенно актуален дифференциальный диагноз с мукор-микозом (зигомикоз), который у иммунокомпрометированных пациентов прогрессирует достаточно быстро с формированием черного струпа, но редко дает множественные высыпания [19].
Кожные проявления папуло-пустулезной формы синегнойной инфекции, в особенности эктимы, клинически очень сходны с таковыми при сибирской язве. В этом случае дифференциальной диагностике помогают оценка количества высыпаний (при сибирской язве редко бывают множественными), динамика высыпаний (заживление с последующим возобновлением на том же месте), сине-зеленое свечение в лучах лампы Вуда.
Клинический случай
Пациент Ч. 39 лет поступил в отделение гнойной хирургии с жалобами на множественные высыпания на коже туловища и конечностей.
Болен около 2 с половиной месяцев. Пациент по специальности строитель, руководитель строительной бригады. Во время работ на селе по подготовке цементирования фундамента под сельскохозяйственную постройку левой ногой провалился в яму с нечистотами, в результате чего с ноги соскочил ботинок и пациент получил глубокую ссадину в области внутренней левой лодыжки. В дальнейшем в течение 7–10 дней в области внутренней лодыжки слева образовался черно-зеленый струп округлой формы размером около 5 см (рис. 5). Пациент самостоятельно применял дезинфицирующие средства и какие-то мази с антибиотиком.
Кожный процесс лечению не поддавался, и пациент обратился к хирургу центральной районной больницы. Проводилось стационарное лечение наружными средствами в сочетании с применением больших доз гентамицина внутримышечно – до 240 мг в сутки. По началу процесс удалось стабилизировать, однако через неделю произошла генерализация процесса, появились свежие папуло-пустулы на коже верхних и нижних конечностей, немного на туловище и даже на лице. Пациент был направлен на лечение в Москву.
При осмотре кожный процесс распространенный, симметричный, островоспалительный. Первичный очаг локализуется на коже над левым голеностопным суставом, преимущественно в области внутренней лодыжки. Здесь процесс представлен округлой поверхностной язвой размером около 5 см. Язва покрыта коричневато-черным струпом, а по периферии имеется светло-коричневый валик. На коже носа, подбородка, затылочной области шеи, плеч и предплечий, боковых поверхностей туловища, бедер и голеней имеются множественные папуло-пустулезные и пустулезные элементы размером 1–2 см с очень скудным отделяемым зеленоватого цвета. Все элементы покрыты коричневато-черной корочкой. На бинтах с области язвы на левой голени обнаружено зеленовато-желтое окрашивание.
Результаты лабораторных исследований: в общеклиническом анализе крови лейкоцитоз 12×109/л с нейтрофильном сдвигом в сторону юных форм до 6%, эозинофилия 7%, моноцитоз 12%. В общеклиническом анализе мочи патологии не выявлено.
Биохимическое исследование крови: АЛТ – 34 ЕД/л, АСТ – 30 ЕД/л, холестерин – 5,6 ммоль/л, билирубин общий – 10,4 мкмоль/л, мочевина – 6,0 ммоль/л, глюкоза – 5,27 ммоль/л.
Результат посева патологического материала с язвы на голени и высыпаний: рост P. aeruginosa.
На основании анализа клинических проявлений и результатов посева пациенту выставлен диагноз «синегнойная инфекция кожи, генерализованная папуло-пустулезная форма, эктима левой голени и стопы».
Проводилось лечение: цефоперазон сульбактам внутривенно по 2/2 г 2 раза в день с интервалом 12 часов, 14 дней; офлоксацин по 400 мг в сутки внутрь, 14 дней; амикацин в дозе 7,5 мг/кг 2 раза в сутки внутримышечно, 10 дней.
Наружно проводились смазывания всех высыпаний раствором фукорцина 2 раза в день, 15 дней, с последующим нанесением на области высыпаний гентамициновой мази, 7 дней, мази полимиксина М, 7 дней, мази левомицетина с метилурацилом, 14 дней.
В результате проведенного лечения наблюдалась обратная динамика кожных высыпаний, наступило заживление поверхностной язвы в области левого голеностопного сустава. Полное разрешение высыпаний наступило через 26 дней после начала лечения в гнойно-хирургическом стационаре.
Обсуждение
Лечение заболеваний, вызванных синегнойной инфекцией, остается серьезной проблемой для врачей всего мира. Связано это с высокой устойчивостью P. aeruginosa ко многим антибактериальным препаратам. Многие из классических дезинфектантов оказываются бесполезными в отношении P. aeruginosa – хлоргексидин в 0,05%-ном растворе, глютаральдегид, фенол.
Из обихода практически всех стационаров был изъят фурацилин – антибиотик, который P. aeruginosa использовала в качестве питательного вещества, и применение фурацилина вскоре стало считаться неблагоприятным фактором по синегнойной инфекции.
Особую устойчивость синегнойная инфекция демонстрирует к фторхинолонам, при этом устойчивость к ципрофлоксацину и левофлоксацину колеблется от 20 до 35% [10].
Этиотропная терапия зависит от антибиотикорезистентности конкретного штамма P. aeruginosa. Трудной задачей является эмпирический подбор антибактериальных препаратов. Обычно для эрадикации P. aeruginosa используется антибактериальная полихимиотерапия с применением комбинаций «цефалоспорин+аминогликозид», «карбапенем+аминогликозид». Альтернативными антибиотиками являются антисинегнойные пенициллины: пиперациллин, азлоциллин, пиперациллин+тазобактам.
Против P. aeruginosa возможно применение и фторхинолонов (ципрофлоксацин), но только после получения данных о чувствительности конкретного штамма.
В лечении кожных форм синегнойной инфекции в отсутствие бактериемии возможно применение цефалоспоринов – цефтазидима, цефепима, цефоперазона, цефоперазона сульбактама. При наружном применении до сих пор остается эффективен полимиксин М в виде мази из числа самых старых антибиотиков [3].
Полное заживление трофических язв с подавлением синегнойной инфекции отмечается на фоне терапии нефракционированным гепарином [21], что также улучшает и микроциркуляцию в тканях. А применение бактериофагов оказывает профилактическое действие, подавляя процессы пленкообразования у P. aeruginosa [22].
Хороший клинический эффект в лечении инфекций, вызванных P. aeruginosa, показал метод с использованием гипербарической оксигенотерапии. Данный метод, включая хирургическую обработку и антибиотикотерапию, является важным терапевтическим дополнением к лечению гангрены Фурнье [23] ввиду повышения выживаемости пациентов и улучшения трофики ткани.
Заключение
Таким образом, вопрос подхода к лечению инфекций, вызванных P. aeruginosa, продолжает оставаться серьезной проблемой для врачей различных специализаций. Особое внимание необходимо уделять пациентам, находящимся в группе риска по развитию синегнойной инфекции, дабы избежать осложнений и развития угрозы жизни для больных.



