Ревматоидный артрит (РА) – одно из самых тяжелых хронических заболеваний человека. Сложный многокомпонентный патогенез хронического воспаления, агрессивность воспаленной синовиальной оболочки, развитие деструкции хряща суставных поверхностей и подлежащей кости с утратой функции суставов определяют тяжесть этого заболевания.
 К настоящему времени в лечении РА достигнуты определенные успехи. Появление новых диагностических критериев РА 2010 г. [1], внедрение в практику принципов контролируемого лечения [2] – стратегии лечения РА до достижения цели, появление новых форм ранее применяемых базисных противовоспалительных препаратов (БПВП) и препаратов нового поколения (генно-инженерных биологических препаратов [ГИБП] и таргетного синтетического БПВП – тофацитиниба), дают возможность клиницисту приблизиться к персонифицированной терапии РА и предотвращению неблагоприятных исходов заболевания. Высокая стоимость ГИБП лимитирует их применение со стороны всех больных РА, хотя ряд рандомизированных контролируемых исследований (РКИ) показывает их более высокую эффективность в отношении больных на ранней стадии заболевания и не получавших ранее БПВП [3, 4]. Поэтому перед клиницистами стоит задача добиться максимального эффекта от синтетических БПВП (метотрексата, лефлуномида и др.). В начале 2014 г. были опубликованы последние рекомендации Европейской антиревматической лиги (EULAR – European League Against Rheumatism) по ведению больных РА [5], в которых подтверждена первостепенная роль БПВП в лечении РА. В октябре 2014 г. на Экспертном совете по ревматологии был обсужден Проект рекомендаций по лечению РА Общероссийской общественной организации «Ассоциация ревматологов России» [6]. В этой статье будет продемонстрирована возможность достижения ремиссии РА при лечении больных, согласно последним рекомендациям.
К настоящему времени в лечении РА достигнуты определенные успехи. Появление новых диагностических критериев РА 2010 г. [1], внедрение в практику принципов контролируемого лечения [2] – стратегии лечения РА до достижения цели, появление новых форм ранее применяемых базисных противовоспалительных препаратов (БПВП) и препаратов нового поколения (генно-инженерных биологических препаратов [ГИБП] и таргетного синтетического БПВП – тофацитиниба), дают возможность клиницисту приблизиться к персонифицированной терапии РА и предотвращению неблагоприятных исходов заболевания. Высокая стоимость ГИБП лимитирует их применение со стороны всех больных РА, хотя ряд рандомизированных контролируемых исследований (РКИ) показывает их более высокую эффективность в отношении больных на ранней стадии заболевания и не получавших ранее БПВП [3, 4]. Поэтому перед клиницистами стоит задача добиться максимального эффекта от синтетических БПВП (метотрексата, лефлуномида и др.). В начале 2014 г. были опубликованы последние рекомендации Европейской антиревматической лиги (EULAR – European League Against Rheumatism) по ведению больных РА [5], в которых подтверждена первостепенная роль БПВП в лечении РА. В октябре 2014 г. на Экспертном совете по ревматологии был обсужден Проект рекомендаций по лечению РА Общероссийской общественной организации «Ассоциация ревматологов России» [6]. В этой статье будет продемонстрирована возможность достижения ремиссии РА при лечении больных, согласно последним рекомендациям.
Как известно, лечение РА ориентировано на подавление активности и прогрессирования заболевания, а также сохранение качества жизни больных.
Основные принципы лечения РА должны быть хорошо известны клиницистам:
- Раннее назначение БПВП.
- Длительное контролируемое лечение.
- Предупреждение ятрогении.
Лечение БПВП начинают для всех пациентов с РА сразу после установления диагноза – не позднее чем через 3–6 месяцев от момента появления симптомов поражения суставов (уровень доказательности 1а) [2, 5, 6]. При раннем начале лечения (первые 3–6 месяцев) для большинства больных возможно добиться ремиссии или течения РА с низкой активностью [7–10], что, по современным представлениям, и служит основной целью лечения РА [2, 5, 6]. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. При анализе 14 РКИ была оценена частота развития эффекта для 1435 больных (886 получали различные БПВП и 549 – плацебо) при различной длительности РА, учитывались демографические факторы (пол, возраст), функциональный класс (ФК) по Steinbrocker, клинико-лабораторные параметры активности болезни (боль, число болезненных суставов, число воспаленных суставов, СОЭ, HAQ – Health Assessment Questionnaire и др.) [11]. При любой длительности РА различия в частоте развития эффекта между активным лечением и плацебо были примерно одинаковыми – около 30%. По мере увеличения длительности РА эффективность БПВП снижалась с 52% «ответчиков» (<1 года) до 35% (>10 лет).
Помимо раннего начала лечения РА БПВП необходим и жесткий контроль выраженности достигнутого эффекта, своевременной коррекции терапии. При таком подходе, как это было показано в ряде исследований [12–16], результат лечения лучше, чем при рутинном подходе (рис. 1). Это послужило основанием к формированию концепции современного лечения РА. За последние годы большинство стран Европы, включая и Российскую Федерацию, поддержали инициативу «Лечение РА до достижения цели» (в оригинале – инициатива «Treat to target» – Т2Т) [2]. В соответствии с рекомендациями Т2Т контролируемое лечение означает ежемесячную регистрацию количественных показателей активности РА (числа болезненных, припухших суставов, индекс DAS28 – Disease Activity Score, СОЭ, С-реактивный белок) и коррекцию терапии в отсутствие эффекта или при недостаточном эффекте. По достижении цели (ремиссии или низкой активности РА) регистрация этих параметров может проводиться реже – раз в 3–6 месяцев.

Метотрексат (МТ) – препарат «первой линии» [5, 6], следует назначать всем пациентам с диагнозом РА (уровень доказательности A) и недифференцированным артритом (НДА) при высокой вероятности развития РА (уровень доказательности С) [6]. При недостаточной эффективности (или плохой переносимости) таблетированной формы МТ до смены терапии БПВП и назначения ГИБП следует переводить пациентов на парентеральную (подкожную – п/к) форму препарата (уровень доказательности B); пациентам с РА с высокой активностью, которым показаны высокие дозы МТ (≥15 мг), рекомендуется начинать лечение с формы препарата для подкожного введения (уровень доказательности С) [6].
И терапевтические эффекты, и токсичность МТ определяются фолатзависимыми механизмами. Подавление активности дегидрофолатредуктазы, ведущее к снижению синтеза ДНК, наблюдается главным образом при применении очень высоких доз МТ у онкологических больных и составляет основу антипролиферативного действия препарата. При использовании низких доз МТ в ревматологии ингибиция дегидрофолатредуктазы, вероятно, имеет меньшее значение, а клиническая эффективность связана с действием его полиглутамированных производных. Весьма вероятно, что на фоне лечения низкими дозами МТ именно накопление метаболитов приводит к противовоспалительному и мягкому иммуносупрессивному эффектам. Таким образом, низкие дозы МТ, используемые в лечении РА, способствуют противовоспалительному, а не цитотоксическому эффекту, что имеет место при применении высоких доз МТ при лечении опухолей [17].
 Метотрексат обоснованно считается препаратом, с которого следует начинать лечение РА. Он является высокоэффективным препаратом, контролирующим активность и прогрессирование РА [18–20]. Причем эффект МТ дозозависим [21, 22].
Метотрексат обоснованно считается препаратом, с которого следует начинать лечение РА. Он является высокоэффективным препаратом, контролирующим активность и прогрессирование РА [18–20]. Причем эффект МТ дозозависим [21, 22].
В 2009 г. были опубликованы рекомендации по использованию МТ при РА, разработанные при участии 751 ревматолога (эксперта) из 17 стран [23]. Рекомендации разрабатывались в соответствии с принципами доказательной медицины с использованием систематического обзора литературы и учетом мнения экспертов. Широкое внедрение в клиническую практику п/к формы МТ – Методжекта – послужило основанием к уточнению некоторых аспектов применения МТ больными РА [6] для проведения индивидуализированного лечения.
Рекомендации по использованию МТ [23] включают:
1. Необходимость оценки факторов риска развития нежелательных реакций (НЯ): исследование сывороточных трансаминаз, альбумина, креатинина, клинического анализа крови, проведение рентгенологического исследования органов грудной клетки, тестов на ВИЧ-инфекцию, В/С гепатит и беременность.
2. Рекомендуемые дозы МТ и способ введения. В отсутствие противопоказаний (пожилой возраст, нарушение функции почек, печени, гематологические нарушения и др.) минимальная терапевтическая доза МТ составляет 10 мг в неделю, но при лечении РА она должна быть сразу увеличена в течение первых месяцев лечения до 15 мг в неделю, а далее доза корригируется (по 2,5–5,0 мг каждые 2–4 недели) до 25–30 мг в неделю в зависимости от успеха лечения и переносимости препарата.
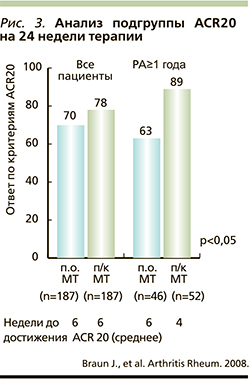
В отечественных рекомендациях [6] имеется существенное дополнение: при недостаточной эффективности (или плохой переносимости) таблетированной (пероральной) формы МТ, до смены терапии или назначения ГИБП целесообразно переводить пациентов на парентеральную (п/к) форму препарата (уровень доказательности B); пациентам с высокой активностью РА, у которых имеются показания к назначению высокой дозы МТ (≥15 мг), рекомендуется начинать лечение с п/к препарата, т.к. увеличение концентрации в сыворотке крови при увеличении дозы п/к формы имеет более линейный вид, чем фармакокинетическая кривая при использовании пероральной формы, кроме того, биодоступность Методжекта достигает 94%, тогда как таблетированной формы – 75% [24]. В двойном слепом РКИ [25] была доказана более высокая эффективность п/к МТ по сравнению с таблетированной формой (рис. 2), что было подтверждено и в последующих наблюдательных исследованиях в различных когортах больных [26–29]. Следует отметить, что, по данным РКИ [25], эффект Методжекта не уменьшается с увеличением длительности РА (рис. 3). Применение п/к МТ позволяет снижать стоимость лечения РА для пациентов с недостаточной эффективностью или плохой переносимостью таблетированного МТ [30].
3. На фоне лечения МТ обязателен прием не менее 5–10 мг фолиевой кислоты в неделю (не ранее чем через 24 часа после приема МТ), что позволяет снижать риск НЯ [31].
Мониторингу переносимости МТ посвящены 4-я и 5-я рекомендации:
- в начале лечения или при увеличении дозы МТ следует проводить определение уровней АЛТ (аланинаминотрансфераза)/АСТ (аспартатаминотрансфераза), креатинина; общий анализ крови необходимо проводить каждые 1,0–1,5 месяца до достижения стабильной дозы МТ, затем – каждые 3 месяца;
- клиническую оценку нежелательных реакций следует проводить во время каждого визита пациентов. Лечение МТ следует прерывать при повышении концентрации АЛТ/АСТ>3 верхних границ нормы (ВГН);
- лечение в более низкой дозе следует возобновлять после нормализации лабораторных показателей. При стойком увеличении уровня АСТ/АЛТ>3 ВГН следует скорректировать дозу МТ; при сохранении уровня АСТ/АЛТ>3 ВГН после отмены МТ следует проводить соответствующие диагностические процедуры.
С учетом благоприятного профиля безопасности МТ 6-я рекомендация касается возможности использовать его длительно. В 6-летнем исследовании было показано, что при использовании МТ (по сравнению с использованием других препаратов) уменьшается риск преждевременной смерти (отношение рисков [ОР]=0,3; 95% доверительный интервал [ДИ] – 0,2–0,7) [32], в 2 РКИ МТ показал отсутствие факторов кардиоваскулярного риска и даже снижение такого риска при лечении больных РА (относительный риск [ОР]=0,11; 95% ДИ – 0,02–0,56) [33, 34]. По данным мета-анализа и систематического обзора исследований по использованию БПВП в разных когортах больных, прослеженных в течение 5–12 лет, МТ реже, чем другие БПВП, отменяется из-за НЯ, исключая гидроксихлорохин [35, 36].
В 7-й рекомендации предлагается начинать лечение РА в дебюте с монотерапии МТ [23], хотя, по последним рекомендациям EULAR по ведению больных РА [5], лечение можно начинать и с комбинации БПВП, но комбинация должна обязательно включать МТ.
При других ревматических болезнях (гигантоклеточный артериит и ревматическая полимиалгия) МТ может оказать стероидсберегающее действие – рекомендация 8 [37–39]. МТ может использоваться в периоперационный период (рекомендация 9), что не оказывает влияния на исход операции и частоту постоперационных, в т.ч. инфекционных, осложнений [40–43]. При планировании беременности МТ должен быть отменен как минимум за 3 месяца – рекомендация 10, в отношении как пациенток с РА, так и мужчин с РА, планирующих отцовство [44, 45].
За 5-летний период использования Методжекта в нашей клинической практике с применением обсужденных выше рекомендаций и использованием принципов Т2Т в нашей когорте больных с ранним РА увеличилась возможность достижения низкой активности или стойкой ремиссии РА.
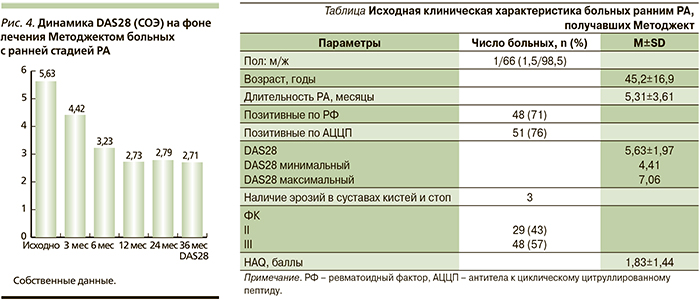
В условиях проспективного наблюдения Методжект на ранней стадии РА был назначен 67 больным. К настоящему моменту в течение 12 месяцев пролечены 65 больных, 24 месяцев – 47 больных и 36 месяцев – 22 пациента. Клиническая характеристика больных к моменту обращения представлена в таблице.
Большинство больных были среднего возраста (42–65 лет), 9 пациенток были старше 65 лет. Длительность РА не превышала 8,5 месяца, в среднем составила 5,30±3,61 месяца. Активность РА по DAS28 у 43 (64%) больных была умеренной и у 24 (36%) – высокой. Хотя функциональный класс не был максимальным ни в одном из случаев. Средний HAQ составил 1,83±1,44. Только у 3 больных были выявлены единичные эрозии в суставах кистей и стоп, у остальных больных имелись сужения суставных щелей (IIa стадия).
Со всеми больными во время первого визита проводили подробную обучающую беседу, в ходе которой объясняли тяжесть заболевания, возможность прогрессирующего варианта течения, необходимость длительного непрерывного лечения, коррекция которого возможна только при участии врача. Разъясняли возможные виды терапии и объясняли, почему именно Методжект рекомендуется в качестве первого препарата, больным выдавали памятку, в которой указывался режим приема Методжекта и фолиевой кислоты, необходимые параметры контроля эффекта и переносимости лечения. Рекомендовалось соблюдение диетического режима с ограничением жирной, острой пищи. Больным также объясняли, что их задача на начальных этапах лечения внимательно следить за возможным возникновением НЯ и обязательно незамедлительно сообщать о них врачу, а также оценить, как изменяются симптомы, есть ли (пусть и небольшое) улучшение.
Всем больным после первой пробной инъекции Методжекта в дозе 10 мг далее препарат назначался в дозе 15 мг в неделю в комбинации с 1–2 мг фолиевой кислоты в сутки. Нестероидные противовоспалительные средства назначали с учетом сопутствующих заболеваний в оптимальных терапевтических дозах. Глюкокортикоиды системно не назначали. Внутрисуставные введения бетаметазона потребовались в ранние сроки лечения только 3 больным. Практически у всех (61) больных первые симптомы улучшения были отмечены через 4–5 недель использования Методжекта в дозе 15 мг в неделю, через 8 недель терапии эффект отмечен у всех больных (за исключением 2 больных, которым Методжект был отменен из-за появления гриппоподобного синдрома). В отсутствие признаков улучшения в первые 4–6 недель дозу Методжекта увеличивали до 20 мг в неделю, что потребовалось 8 больным и привело к развитию эффекта без необходимости дальнейшего увеличения дозы. Через 3 месяца достигнуть цели (низкой активности РА) удалось 16 больным, имевшим исходно умеренную степень активности (24% от общего числа больных и 37% от числа больных с исходно умеренной активностью). Однако, поскольку была отмечена отчетливая тенденция к нарастанию эффекта, доза Методжекта не менялась. Через 6 месяцев терапии высокой степени активности не отмечено, умеренная степень активности имела место у 32 из 65 пациентов, низкая активность – у 33 больных. К 12 месяцам цель лечения была достигнута всеми больными: у 12 больных отмечена ремиссия по DAS28 и по критериям ремиссии ACR (American College of Rheumatology)/EULAR 2010 г.
[46], в остальных случаях регистрировалась низкая активность РА. Динамика DAS28(СОЭ) представлена на рис. 4. Через 2 года лечения ремиссии достигли 43% больных и через 3 года – более половины пациентов (56 больных, из них 18 к этому сроку препарат уже не получали, продолжительность ремиссии у них составила от 12 до 18 месяцев). Две пациентки, достигшие ремиссии через 18 и 20 месяцев лечения, высказали желание забеременеть. Доза Методжекта у них была снижена до 10 мг в неделю в течение 3 месяцев, далее Методжект был отменен и больные находились под наблюдением еще в течение 3 месяцев. Поскольку обострения РА у них отмечено не было, пациенткам была разрешена беременность, обе в срок родили здоровых детей.
За первый год лечения отмечено появление эрозий (максимально 5 у 1 больной) у 18 больных. У 17 пациенток это были единичные небольшие эрозии, им, несмотря на достижение цели, было решено не уменьшать дозу Методжекта, а больной с 5 эрозиями на последующие 6 месяцев доза Методжекта была увеличена до 20 мг в неделю. В дальнейшем появление новых эрозий у больных, пролеченных в течение 24 и 36 месяцев, отмечено в 11 случаях. В данном сообщении мы не приводим сведений по счету сужений в оцениваемых суставах (материал находится в стадии обработки).
Параллельно со снижением активности РА улучшалось и функциональное состояние больных: индекс HAQ через 3, 6, 12, 24 и 36 месяцев составил соответственно 1,78; 1,31; 0,86; 0,63 и 0,67 балла.
Следует отметить хорошую переносимость Методжекта в нашей группе больных. Из-за НЯ препарат был отменен в первые 8 недель у 2 больных (гриппоподобный синдром), через 3 месяца – у 1 больной из-за стойкого повышения концентрации сывороточных трансаминаз. У 12 пациентов отмечены частые простуды, что требовало только временного перерыва в лечении и у 19 (38%) пациентов транзиторное повышение уровня АЛТ и/или АСТ, но только трижды нарастание этих параметров двукратно превышало норму, что не требовало коррекции лечения.
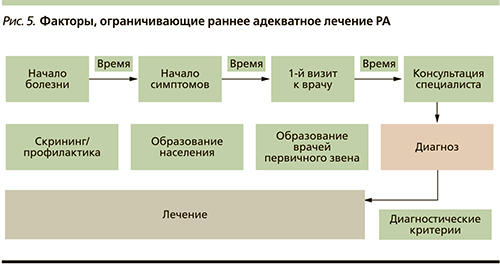
Таким образом, подкожная форма метотрексата (Методжект) обладает высокой эффективностью в отношении активности и прогрессирования при раннем РА, длительной хорошей переносимостью, позволяет при использовании принципов контролируемого лечения достичь цели большинству больных через 6–12 месяцев терапии. Особенностью нашей группы больных было начало терапии Методжектом в большинстве случаев в первые 6 месяцев болезни, в этом случае удается достичь ремиссии, в т.ч. и безлекарственной, более чем половине больных. При этом было отмечено минимальное прогрессирование эрозивного артрита у 18 (27%) пациентов, что не вызвало стойкого снижения функциональной способности больных. Появление в РФ новых форм Методжекта (десять различных дозировок от 7,5 до 30,0 мг с шагом в 2,5 мг и концентрацией 50 мг/мл) позволит более рационально корригировать дозу каждому больному в сочетании с более удобным введением препарата ввиду малого объема более концентрированной формы. Раннее выявление больных РА затруднено из-за ряда объективных и субъективных причин (рис. 5). Представляется, что привлечение врачей первичного звена к раннему выявлению симптомов артрита и направлению больных на консультацию к ревматологу позволят добиться существенного снижения инвалидизации больных РА.



