Введение
Рак яичников (РЯ) – лидирующая причина смертности от онкогинекологических заболеваний в России. В 2016 г. РЯ был выявлен у 16 тыс. женщин, 7645 женщин умерли от РЯ, при этом тенденции к снижению смертности от РЯ не наблюдается [1]. Для сравнения: заболеваемость и смертность от рака тела матки составили 25 096 и 6 731 случай соответственно [1]. Значительное влияние на высокую смертность от РЯ оказывает поздняя диагностика заболевания: в 70% случаев оно выявляется на поздних стадиях [2].
Хорошо известно существование наследственной предрасположенности к развитию РЯ: наличие хотя бы 1 родственника 1-й степени родства с диагнозом РЯ повышает риск заболеть в 3 раза по сравнению с общей популяцией [3]. Во многих случаях наличие такой предрасположенности связано с носительством мутаций в генах BRCA1/2:й риск развития РЯ в течение жизни достигает 44 и 17% для мутаций в генах BRCA1 и BRCA2 соответственно [4]. Истинная распространенность мутаций в генах BRCA1/2 при РЯ неизвестна, различные авторы оценивают частоту их встречаемости в 6–43% [5–9].
Наибольшая частота встречаемости мутаций отмечена в исследованиях с массой пациентов с известными факторами риска носительства мутаций в указанных генах (молодой возраст, евреи-ашкенази). В сочетании с использованием различных методов диагностики это резко затрудняет корректную оценку превалентности BRCA-ассоциированного РЯ. Тем не менее в соответствии с данными современных исследований на долю носителей мутаций в указанных генах приходится около 15% всех случаев развития РЯ [7, 10, 11].
Гены BRCA1/2 играют важную роль в поддержании стабильности генетического материала в клетках. Хотя точные механизмы до конца не изучены, известно, что оба гена участвуют в процессах гомологичной рекомбинации ДНК, необходимых для устранения двунитевых разрывов [12, 13]. Данные многочисленных исследований показывают, что BRCA-ассоциированный РЯ отличается рядом особенностей течения, которые могут значимо влиять на тактику лечения пациенток. Данная статья посвящена обзору современных тенденций в лечении BRCA-ассоциированного РЯ.
Ингибиторы PARP: история создания, механизм действия и роль в лечении РЯ
Ферменты семейства PARP (поли [АДФ-рибоза] полимераза) вовлечены в различные внутриклеточные процессы, включая восстановление ДНК после однонитевых разрывов. На фоне подавления активности PARP происходит накопление и персистирование однонитевых разрывов в ДНК клеток, что ведет к постепенному возникновению двунитевых разрывов. Вследствие функционирования других ферментов системы репарации само по себе подавление активности PARP не приводит к гибели клеток, т.к. повреждения устраняются благодаря работе системы гомологичной рекомбинации ДНК [14].
Ситуация меняется в случае одновременного нарушения функционировании гомологичной рекомбинации, что отмечается, в частности, при мутациях в генах BRCA1/2. На этом фоне двунитевые разрывы становятся неустранимыми, что в конечном итоге приводит к гибели клеток. Это легло в основу концепции синтетической летальности.
Результаты современных исследований показывают, что механизм противоопухолевого действия ингибиторов PARP реализуется благодаря нескольким основным механизмам [15]:
- Непосредственное подавление активности ферментов PARP, что приводит к накоплению в клетках одно- и двунитевых разрывов ДНК, неустранимость которых на фоне нарушенного функционирования гомологичной рекомбинации ведет к гибели опухолевых клеток.
- Блокирование PARP на нити ДНК («PARP trapping») – после воздействия ингибиторов PARP данный белок остается связанным с поврежденной ДНК, что делает невозможным последующую репарацию. Дополнительно это приводит к нарушению синтеза поли [АДФ-рибозы].
- Подавление присоединения комплекса BRCA1 и белка BARD1 (BRCA1-associated RING domain protein) к ДНК, что может быть особенно важно в условиях нарушенного функционирования BRCA1.
- Активизация процесса негомологичного соединения концов ДНК (non-homologous end joining, NHEJ) – менее точного варианта восстановления целостности ДНК после двунитевых разрывов, приводящего к появлению хромосомных перестроек, нестабильности структуры ДНК и последующей активации апоптоза клеток.
Первым ингибитором PARP, появившимся в клинической практике и одобренным для лечения РЯ, стал олапариб. Препарат был одобрен в Европе и в США в декабре 2014 г. Примечательно, что первоначально препарат получил одобрение регуляторных органов по разным показаниям. В Европе (и несколько позднее в России) препарат был одобрен в качестве поддерживающей терапии при рецидивах РЯ. Решение было основано на результатах исследования Study 19 (n=265), чьи результаты были впервые представлены в 2012 г. Включались пациентки с платиночувствительными рецидивами серозного РЯ высокой степени злокачественности (G3), получившие ≥2 линий платиносодержащей химиотерапии (ХТ). Обязательным условием включения было достижение объективного ответа после последней линии ХТ с использованием платинового агента [11].
Пациентки рандомизировались в соотношении 1:1 в группу олапариба (400 мг×2 раза в сутки) или в группу плацебо. Медиана выживаемости без прогрессирования (ВБП) составила 8,4 месяца в группе олапариба по сравнению с 4,8 – в группе плацебо (отношение рисков [ОР] – 0,35; p<0,00001).
В то же время достоверных различий в общей выживаемости (ОВ) пациенток выявлено не было – данный показатель составил 29,7 и 29,9 месяца соответственно (ОР – 0,94; p=0,75).
Позднее был проведен ретроспективный подгрупповой анализ, в ходе которого было выявлено, что наибольшее преимущество от применения олапариба получают пациентки с наличием мутаций в генах BRCA1/2 [16]. В этой подгруппе пациенток медиана ВБП составила 11,2 месяца в группе олапариба по сравнению с 4,3 – в группе плацебо (ОР – 0,18; p<0,0001), хотя различий в ОВ выявлено не было (ОР – 0,73; p=19). Регуляторные органы РФ и Европы одобрили применение олапариба для поддерживающей терапии РЯ на основании результатов исследования Study 19 [17].
С другой стороны, FDA (регулятор фармацевтического рынка США) отказал препарату в регистрации. В США препарат был зарегистрирован в декабре 2014 г. на основании результатов нерандомизированного исследования II фазы (n=193), в которое включались пациентки с платино-резистентными рецидивами BRCA-ассоциированного РЯ. Медиана возраста участниц составила 57 лет, среднее количество линий ранее проведенной терапии – 4. По результатам исследования показатель частоты объективного ответа (ЧОО) составил 31%, еще у 33% пациенток была отмечена стабилизация заболевания ≥8 недель. На основании результатов этого исследований FDA одобрило олапариб для лечения пациенток с BRCA-ассоциированного РЯ, ранее получавших ≥3 линий платиносодержащей ХТ [19].
Успех олапариба вызвал волну интереса к изучению других ингибиторов PARP. В течение последних нескольких лет были опубликованы результаты трех крупных рандомизированных исследований III фазы, посвященных изучению эффективности различных препаратов данного класса: нирапариба (ENGOT-OV16/NOVA), олапариба (SOLO-2) и рукапариба (ARIEL-3). Результаты этих исследований легли в основу одобрения перечисленных препаратов в странах Европы и США (табл. 1).

Все указанные исследования характеризуются схожим дизайном: в них включались пациентки с серозным и эндометриоидным РЯ высокой степени злокачественности, ранее получавшие ≥2 линий платиносодержащей ХТ и у которых был отмечен частичный или полный регресс опухолевого процесса на фоне последней из них. Рандомизация во всех работах осуществлена в соотношении 2:1 в группу терапии ингибитором PARP (олапариб в таблетках 150 мг 2 раза в сутки, нирапариб 300 мг 1 раз в сутки или рукапариб 600 мг 2 раза в сутки) или в группу соответствующих им плацебо [26–28].
Ключевым отличием дизайна исследования SOLO-2 служило следующее: в исследовании принимали участие только пациентки с подтвержденным наличием герминальных или соматических мутаций в генах BRCA1/2, в то время как дизайн двух других исследований не предусматривал подобных ограничений, хотя был предусмотрен отдельный анализ эффективности терапии в подгруппах BRCA-ассоциированного РЯ. Основные результаты данных работ в лечении BRCA-ассоциированного РЯ суммированы в табл. 2.
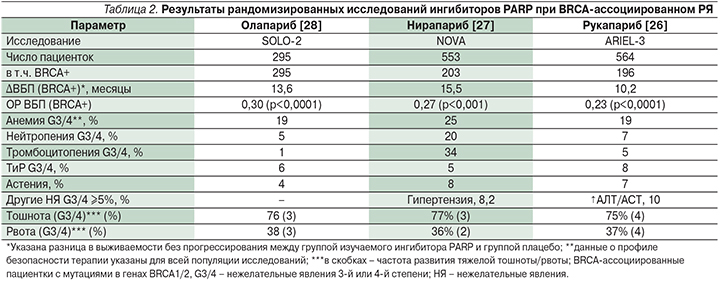
Как следует из табл. 2, все препараты класса ингибиторов PARP продемонстрировали схожую эффективность в лечении BRCA-ассоциированного РЯ. На фоне их применения было зарегистрировано клинически и статистически значимое снижение относительного риска прогрессирования заболевания на 70–77%. Рукапариб и нирапариб также продемонстрировали улучшение ВБП пациенток с «диким» типом генов BRCA1/2, хотя эффект был менее выраженным, чем среди BRCA-ассоциированных пациенток [26–28].
Вместе с тем профиль безопасности препаратов различался. Наиболее частым тяжелым (степени ≥3) нежелательным явлением, отмечающимся при применении ингибиторов PARP, является анемия, отмеченная у 19–25% пациентов. На фоне использования нирапариба был также отмечен существенный рост частоты развития других явлений гематологической токсичности, тромбоцитопении и нейтропении. Его применение также повышало частоту тяжелой артериальной гипертензии. Рукапариб в свою очередь приводил к развитию тяжелой гепатотоксичности у 10% пациентов [26–28].
На фоне применения всех ингибиторов PARP отмечено выраженное повышение частоты развития тошноты (75–77%) и рвоты (36–38%), хотя тяжелая тошнота и рвота развивались у небольшого числа больных. Исходя из этого, ингибиторы PARP следует относить к умеренно- или высокоэметогенным пероральным препаратам (развитие рвоты у ≥30% пациентов). В соответствии с современными рекомендациями для профилактики тошноты и рвоты (ТиР) на фоне применения таких препаратов целесообразно использование ингибиторов 5-HT3-рецепторов, например ондансетрона или гранисетрона, особенно пациентами, с факторами риска развития ТиР (молодой возраст, рвота на фоне ранее проведенной ХТ и т.д.) [29].
В то же время с учетом необходимости длительного применения ингибиторов PARP каждодневное использование антиэметиков повышает риск нежелательных явлений. Оптимальный подход к профилактике тошноты и рвоты у таких пациенток не изучен [30]. Отметим, что, несмотря на увеличение частоты развития вышеперечисленных нежелательных явлений, в соответствии с результатами оценок исследований NOVA и SOLO-2, ингибиторы PARP не оказывают значимого негативного влияния на качество жизни пациенток [31, 32].
Влияние ингибиторов PARP на ОВ пациенток с рецидивами РЯ остается неизвестным. Последние результаты исследования Study 19 не показали улучшения ОВ при применении олапариба пациентками с BRCA-ассоциированным РЯ. Медиана ОВ составила 34,9 месяца в группе исследуемого препарата по сравнению с 30,2 – в группе плацебо (ОР – 0,62; nominal, p=0,025) при пороговом уровне значимости результатов p<0,0095 [33]. Результаты другого подгруппового анализа показали, что при исключении из изучаемой выборки пациенток, получавших ингибиторы PARP после прогрессирования заболевания, отмечается значимое увеличение ОВ в группе олапариба (ОР – 0,52 (95% ДИ – 0,28–0,97). Ретроспективный характер исследования ограничивает значимость этих данных [34]. Результаты по ОВ в исследованиях SOLO-2, NOVA и ARIEL-3 на данный момент не опубликованы.
Примечательно, что, несмотря на отсутствие выраженного влияния на ОВ, результаты Study 19 показали, что у части пациенток применение олапариба позволяет достигать длительного контроля заболевания – у 11 (15%) пациенток в группе олапариба по сравнению с 1 (2%) – в группе плацебо срок проведения поддерживающей составил ≥5 лет, что является крайне высоким показателем для больных с рецидивами РЯ [33].
Таким образом, ингибиторы PARP являются эффективными препаратами для поддерживающей терапии и лечения рецидивов РЯ, которые позволяют достигать длительной ремиссии заболевания у многих пациенток. Необходимо проведение дальнейших исследований, направленных на уточнение их роли в терапии данного заболевания. Кроме того, неясными остаются оптимальные методы поддерживающей терапии, необходимой на фоне применения препаратов этого класса.
Внутрибрюшинная ХТ при BRCA-ассоциированном РЯ
Стандарт современного лечения диссеминированных стадий РЯ – проведение хирургического лечения с последующей лекарственной терапией на основе препаратов платины и таксанов. В ряде рандомизированных исследований показано, что использование внутрибрюшинной ХТ с теми же препаратами позволяет существенно улучшить отдаленные результаты лечения пациенток. В исследовании GOG-172 было продемонстрировано значимое увеличение ОВ пациенток с III стадией РЯ после оптимальной циторедукции – с 49,7 месяца в группе внутривенной ХТ до 65,6 – в группе внутрибрюшинной ХТ (p=0,03) [35].
Одновременно с ростом эффективности лечения внутрибрюшинная ХТ приводила к значительному увеличению количества осложнений. Это стало препятствием для ее широкого использования в рутинной клинической практике и подчеркнуло важность определения критериев отбора пациенток для этого вида лечения. Основное преимущество внутрибрюшинного введения цитостатиков – создание высокой концентрации противоопухолевых препаратов в брюшной полости. В частности, при внутрибрюшинном введении концентрация цисплатина повышается в 12–18 раз по сравнению с назначением препарата внутривенно в аналогичных дозах [36], карбоплатина – в 18, паклитаксела – в 1000 раз [37]. При этом платиновые агенты в дальнейшем практически полностью абсорбируются из брюшной полости и попадают в системный кровоток.
Носители BRCA-мутаций могут быть особенно чувствительными к воздействию высокой концентрации платиновых агентов. Lesnock et al. провели подгрупповой анализ результатов исследования GOG-172, в рамках которого была оценена эффективность внутрибрюшинной ХТ в зависимости от наличия BRCA1-дисфункции. Был использован иммуногистохимический (ИГХ) метод оценки экспрессии белка BRCA1. При экспрессии BRCA1 ≤10% опухолевых клеток считалось, что в опухоли нарушена экспрессия BRCA1 (аберрантная экспрессия), при больших значениях констатировалась нормальная экспрессия BRCA1. Были проанализированы результаты лечения 393 пациенток. У 189 (48%) выявлено нарушение экспрессии BRCA1 [38].
По результатам проведенного анализа было отмечено, что внутрибрюшинная ХТ позволяет значительно улучшить результаты лечения пациенток с аберрантной экспрессией BRCA1.
В данной подгруппе пациенток медиана ОВ составила 84,1 месяца в группе внутрибрюшинной ХТ по сравнению с 47,7 в группе внутривенной терапии (p=0,014). При этом различий в результатах лечения среди пациенток с нормальной экспрессией BRCA1 выявлено не было [38].
Полученные данные свидетельствуют, что внутрибрюшинная ХТ высокоэффективна для пациенток с нарушенной экспрессией BRCA1, в то же время при нормальной экспрессии этого белка ее проведение не улучшает отдаленных результатов лечения. Отметим, что существенным ограничением данного исследования является использование ИГХ-метода определения экспрессии белка BRCA1, а не стандартного молекулярно-генетического тестирования, направленного на выявление герминальных или соматических мутаций в данном гене. Тем не менее с учетом приведенных результатов пациентки с мутациями в генах BRCA1/2 могут рассматриваться как первоочередные кандидаты для проведения внутрибрюшинной ХТ.
Лечение рецидивов РЯ при BRCA-мутациях
Несмотря на первоначально высокую чувствительность к ХТ, у большинства пациенток с поздними стадиями РЯ отмечаются рецидивы заболевания. Современные рекомендации указывают на целесообразность определения лечебной тактики при рецидивирующем РЯ в зависимости от бесплатинового интервала – временного промежутка, прошедшего между последним введением платинового агента и развитием рецидива. Если этот период составляет >6 месяцев, рецидив считается платиночувствительным и для его лечения повторно назначается платиновый агент в сочетании с одним из неплатиновых препаратов (гемцитабин, доксорубицин, этопозид и т.д.). В тех случаях, когда длительность бесплатинового интервала составляет <6 месяцев, назначается монотерапия одним из неплатинововых агентов [39, 40].
Тем не менее имеются данные, показывающие, что данная парадигма требует пересмотра. Alsop et al. провели ретроспективное исследование (n=835), посвященное изучению эффективности различных вариантов ХТ пациенток с первым рецидивом РЯ в зависимости от наличия или отсутствия мутации в генах BRCA1/2 и сроками развития рецидива. Оценивалось наличие герминальных мутаций в указанных генах. Патогенные мутации были выявлены у 134 пациенток. Из них у 17 и 65 развились платинорезистентные и платиночувствительные рецидивы РЯ соответственно [7].
По результатам исследования, у 8 (80%) пациенток с платинорезистентными рецидивами РЯ с наличием мутаций в генах BRCA1/2 отмечен объективный ответ на проводимую терапию при повторном назначении платиновых агентов по сравнению с 43,6% среди пациенток, которым проводилась терапия неплатиновыми агентами. Примечательно, что среди пациенток с «диким» типом генов BRCA1/2 частота объективного ответа также была значительно выше при повторном использовании платиновых препаратов (табл. 3) [7].

Развитие платинорезистентных рецидивов отмечено у небольшого числа пациенток с BRCA1/2-мутацияями, что ограничивает значимость полученных данных. Тем не менее это свидетельствует, что повторное назначение платиновых агентов может быть наиболее эффективным подходом к лечению рецидивов BRCA-ассоциированного РЯ. Другие авторы также сообщали о более высокой эффективности платиносодержащей ХТ при рецидивах BRCA-ассоциированного РЯ. В исследовании Tan DS et al. частота объективного ответа на платиносодержащую и бесплатиновую ХТ во второй и третьей линиях терапии составила 92 и 20%, 100 и 29% соответственно. Одновременно выявлено значимое увеличение ВБП при повторном назначении платиновых агентов [41].
Таким образом, несмотря на немногочисленность данных и отсутствие проспективных исследований, уже сейчас можно сделать вывод, согласно которому платиновые агенты относятся к наиболее эффективным препаратам при BRCA-ассоциированном РЯ. Все пациентки с отсутствием противопоказаний к назначению платиновых агентов должны рассматриваться как кандидаты для платиносодержащей ХТ.
Иммунотерапия при рецидивирующем раке яичников
Перспективным направлением в развитии лечения BRCA-ассоциированного РЯ является иммунотерапия: во многих случаях в опухоли обнаруживается выраженная лимфоцитарная инфильтрация, имеющая важное прогностическое значение [42, 43]. Современные иммунотерапевтические препараты, к которым относятся ингибиторы контрольных точек иммунного ответа, продемонстрировали эффективность при различных солидных опухолях. Рандомизированные исследования, проведенные среди пациенток
с BRCA-ассоциированым РЯ, на данный момент отсутствуют, тем не менее некоторые данные свидетельствуют о ее потенциальной эффективности.
Впервые об эффективности иммунотерапии при диссеминированном РЯ сообщили Hamanishi et al. в 2015 г.
Были опубликованы результаты исследования Ib-фазы, посвященного изучению эффективности ниволумаба при платинорезистентных рецидивах РЯ. В исследовании приняли участие 20 пациенток. Медиана линий ранее проведенной терапии составила 4. Ниволумаб назначался в дозе 1–3 мг/кг.
Показатель ЧОО составил 15,0%, в т.ч. у 2 (10%) пациенток был отмечен полный регресс опухолевого процесса. Медиана ВБП и ОВ составила 3,5 и 20,0 месяцев соответственно [44].
К сожалению, авторы вышеприведенного исследования не оценивали эффективность терапии в зависимости от мутационного статуса генов BRCA1/2 и/или наличия других дефектов в системе репарации, хотя теоретические данные говорят об эффективности иммунотерапии именно в этой категории больных. BRCA-ассоциированный РЯ характеризуется высокой мутационной нагрузкой и лимфоцитарной инфильтрацией. Неоантигены опухолевых клеток могут распознаваться иммунной системой и играть роль своеобразной противоопухолевой «вакцины» [45].
Matsuo et al. в 2018 г. опубликовали собственный опыт применения ниволумаба при рецидивах BRCA-ассоциированного РЯ. В анализ вошли результаты лечения 6 пациенток, у 4 из них были платинорезистентные рецидивы заболевания. Медиана линий ранее проведенного лечения составила 3 (2–6) линии. Всем больным проведена терапия ниволумабом в дозе 3 мг/кг 1 раз в 2 недели. На фоне лечения у 3 (50%) пациенток был отмечен полный регресс опухолевого процесса, у 1 (17%) – частичный [46].
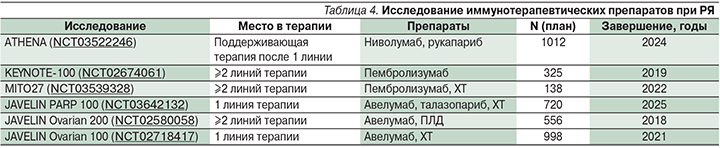
В настоящее время эффективность иммунотерапевтических агентов при РЯ изучается в ряде крупных рандомизированных клинических исследованиях (табл. 4). Дизайн многих исследований подразумевает отдельную оценку эффективности терапии при BRCA-ассоциированном РЯ.
Обсуждение
К наиболее значительным клиническим особенностям BRCA-ассоциированного РЯ можно отнести высокую чувствительность к платиновым и другим ДНК-повреждающим агентам, а также более длительную ВБП и ОВ по сравнению с больными РЯ с «диким» типом генов BRCA1/2.
В соответствии с современными данными мутации в указанных генах обнаруживаются у значительного числа пациенток с РЯ. Это нашло свое отражение в клинических рекомендациях – всем пациенткам с серозным или эндометриоидным РЯ высокой степени злокачественности рекомендуется определять мутационный статус BRCA [39, 40].
Самым значительным изменением в лечении BRCA-ассоциированного РЯ стало внедрение в клиническую практику ингибиторов PARP. Их применение позволяет добиваться значительного снижения относительного риска прогрессирования заболевания и увеличивать «светлый промежуток» – время, когда пациентка живет, зная, что ее болезнь находится под контролем. Это может оказывать выраженное благоприятное влияние на качество жизни – результаты клинических исследований свидетельствуют, что, несмотря на значительное повышение риска нежелательных явлений на фоне использования ингибиторов PARP, это не приводит к значимому снижению качества жизни по сравнению с плацебо [31, 32].
Отметим, что многие исследования показали, что пациенты с «диким» типом генов BRCA1/2 также могут получать преимущество от повторного назначения платиновых агентов, а также от применения ингибиторов PARP. Вероятная причина кроется в том, что в процессах репарации ДНК в клетках принимает участие множество белков. Следовательно, помимо мутаций в генах BRCA1/2 существует ряд других молекулярно-генетических нарушений, приводящих к нарушению функционирования репаративных систем и повышенной чувствительности к ДНК-повреждающим агентам. Результаты некоторых работ показывают, что до 50% пациенток с РЯ имеют различные нарушения гомологичной рекомбинации [47]. Тем не менее наиболее выраженные преимущества от ингибиторов PARP и платиновых агентов получают именно пациентки с BRCA-ассоциированным РЯ [7, 41].
Заключение
Таким образом, информация о наличии мутации в генах BRCA1/2 может оказать значимое влияние на лечение больных поздними стадиями РЯ на всех этапах лечения пациенток. Проведение дальнейших исследований в этой области, в т.ч. с использованием современных таргетных и иммунотерапевтических агентов, должно способствовать улучшению результатов лечения больных.



