Представлен диагностический алгоритм, подразумевающий использование компьютерной и магнитно-резонансной терапии пациентов с подозрением на острое нарушение мозгового кровообращения (НМК). Изложены принципы базисной и специфической терапии НМК. Особое внимание уделено первичной и вторичной нейропротекции. Выбор нейропротекторных препаратов зависит от уровня поражения (стволового, подкоркового и полушарного) и учета дефицита нейротрансмиттеров на конкретном этапе развития процесса (острый, подострый, восстановительный). Комплексный подход к решению вопроса о терапии ишемических НМК с учетом стадии развития заболевания и преимущественных эффектов различных препаратов позволяет индивидуализировать нейропротекторную терапию и, соответственно, улучшить прогноз жизни и реабилитации пациентов.
Цереброваскулярные заболевания относятся к одной из самых распространенных патологий человека. Разделяют на острые (инсульты и преходящие нарушения мозгового кровообращения – транзиторные ишемические атаки), а также хронические формы нарушения мозгового кровообращения (дисциркуляторная энцефалопатия). Это наиболее часто встречающиеся формы нарушения мозгового кровообращения (НМК), приводящие к инвалидизации с нарастанием когнитивных нарушений вплоть до деменции.
Инсульт является исходом многих различных по характеру патологических состояний системы кровообращения. Важнейшим достижением ангионеврологии последних лет явилась концепция гетерогенности инсульта, обозначившая исключительное многообразие этиологических и патогенетических подтипов НМК (Верещагин Н.В., 2001; Гусев Е.И., 1996). Особенности сосудистого повреждения мозга определяются характером ишемического инсульта, механизмом и темпом его развития, локализацией очага поражения, структурными изменениями магистральных артерий головы, состоянием коллатерального кровообращения, общей и церебральной гемодинамики, а также реологическими свойствами крови и активностью системы гемостаза.
Дисциркуляторная энцефалопатия (ДЭ) – хроническое НМК, однако последствия этого заболевания
не менее значимы, чем последствия инсультов. В зависимости от степени недостаточности мозгового кровообращения и выраженности неврологического дефицита выделяют три стадии заболевания. При I стадии ДЭ жалобы и диагностические критерии аналогичны таковым при начальных проявлениях недостаточности мозгового кровообращения. Дополнением является наличие диффузной микроочаговой неврологической симптоматики в виде анизорефлексии, недостаточности конвергенции, негрубых рефлексов орального автоматизма. ДЭ II стадии характеризуется нарастанием неврологической симптоматики с формированием доминирующего синдрома, а
также признаками снижения профессиональной и социальной адаптации. ДЭ III стадии определяется наличием одного или нескольких неврологических синдромов; снижением критики к своему состоянию; нарастанием социальной, профессиональной, возможно и бытовой дезадаптации.
В последнее время при обследовании пациентов все чаще обращают внимание на диагностику не только структурных, но и функциональных нарушений тканей. Дополнительная информация позволяет более полноценно оценивать состояние органов, в т. ч. до появления первых клинических симптомов, что может быть особенно важно для своевременной профилактики развития заболевания. Что касается методов нейровизуализации, современное оборудование позволяет выявлять изменения уже в первые часы появления неврологической симптоматики.
Изучение физиологии и метаболических потребностей ткани головного мозга в норме и нормальных показателей мозгового кровотока ведется с середины XX в. Появление компьютерной томографии и ее развитие во второй половине прошлого столетия произвели революцию в диагностике острых НМК. Теоретическое обоснование возможности проведения и методика перфузионной компьютерной томографии (ПКТ) впервые были описаны L. Axel в 1980 г. [8]. Однако использование ПКТ в клинической практике стало возможным только в 1990-е гг. с появлением мультиспиральных КТ с высокой скоростью
получения изображения и усовершенствованным программным обеспечением. Совершенствование технологий сканирования и обработки информации способствовало широкому распространению методики ПКТ.
Параллельно КТ шло активное развитие магнитно-резонансной томографии (МРТ). Годом основания МРТ принято считать 1973 г., когда профессор химии и радиологии из Нью-Йоркского университета Пол Лотербур опубликовал в журнале Nature статью “Создание изображения с помощью индуцированного локального взаимодействия”. В настоящее время существует возможность выполнять как перфузионную, так и диффузионновзвешенную МРТ. К очевидным достоинствам МРТ относят отсутствие лучевой нагрузки, возможность получения изображения в любых плоскостях и их
высочайшее качество, отсутствие артефактов от костных структур, возможность получения бесконтрастного изображения от движущихся жидкостей, а также то, что МРТ более чувствительна
при выявлении мелких глубоких очагов и инфарктов в структурах задней черепной ямки. Однако этот метод исследования менее чувствителен по сравнению с КТ при выявлении кровоизлияний в первые часы развития инсульта, что принципиально влияет на тактику ведения пациента [6]. Вместе с тем для применения МРТ есть противопоказания – наличие металлических инородных тел, наружного водителя ритма, выраженной клаустрофобии, а также у тяжелых больных, находящихся на искусственной
вентиляции легких, что требует специального парамагнитного оборудования. Осложняет применение МРТ-исследования его длительность (30–60 минут), в течение этого времени пациент должен находиться в неподвижном состоянии.
Диффузионно-взвешенная МРТ является достаточно распространенным методом диагностики ишемического инсульта. По результатам исследований (Urbach, 2000; Gonzalez, 1999; Saur, 2003; Chalela, 2007), при диагностике острого ишемического инсульта диффузионно-взвешенная МРТ показала себя более чувствительным методом по сравнению с КТ, но не более специфичным – для диагностики ранних стадий острой ишемии головного мозга. Диффузионная МРТ позволяет определять диффузию молекул воды, характерную для цитотоксического отека тканей. Было показано, что этот метод позволяет диагностировать ишемию головного мозга раньше, чем обычная МРТ (Lutsep H.L. и соавт., 1997).
В настоящее время разрабатываются такие диагностические алгоритмы, которые могли бы использо-
вать достоинства каждой из методик. Компьютерная томография головного мозга выполняется всем пациентам при подозрении на острое НМК, т. к. этот метод быстр в исполнении и не имеет абсолютных противопоказаний, при этом имеет достаточно высокую информативность. Нативная КТ прежде всего используется для экстренной диагностики субарахноидальных и внутримозговых кровоизлияний,
т. к. зона повышенной плотности на КТ, соответствующей кровоизлиянию, выявляется тотчас. В острой
стадии кровоизлияния точность КТ-диагностики достигает 99 %, тогда как при постановке диагноза инфаркта мозга – 78 % [5]. При исключении кровоизлияния внутривенно вводят йодистое контрастное вещество и проводят перфузионную КТ головного мозга, а при выявлении очага гипоперфузии – КТ-ангиографию (см. рисунок).
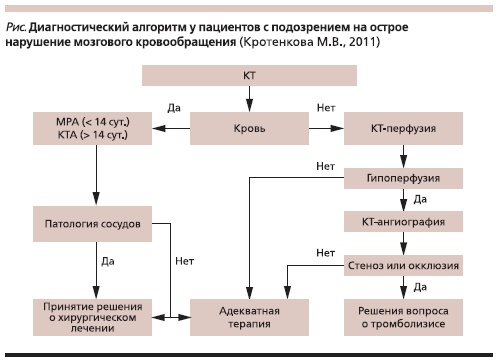
Лечение инсультов складывается из базисной и специфической терапии. Базисная терапия направлена
на поддержание всех жизненно важных функций организма. Она включает контроль дыхательных функций, сердечно-сосудистой деятельности, профилактику вторичных соматических осложнений, купирование пароксизмальных состояний, поддержание кислотно-основного и осмолярного гомеостаза, водно-электролитного баланса, профилактику и лечение внутричерепной гипертензии и отека мозга, вегетативно-трофических расстройств [4].
Основным направлением специфической терапии при ишемическом инсульте является реперфузия – восстановление кровотока по сосудам вповрежденной области. Теоретическим фундаментом являются данные об отсроченности необратимого повреждения головного мозга при острой ишемии, формировании зоны обратимого повреждения (“ишемической полутени”), которая может сохраняться
вплоть до нескольких часов после дебюта инсульта. Восстановление кровотока в окклюзированной артерии в этот временнóй интервал (период “терапевтического окна”) может позволить сохранить жизнеспособность обратимо поврежденной мозговой ткани и, таким образом, способствовать сохранению жизни и дееспособности пациента. Реперфузия пораженного бассейна может быть достигнута за счет растворения, разрушения или удаления тромба (тромбоэмбола), обтурирующего
просвет церебральной артерии. В этих случаях наиболее современным методом лечения является тромболизис. В зависимости от пути введения тромболитика различают внутривенный и внутриартериальный тромболизис.
Патогенетическая терапия НМК направлена на разнообразные механизмы ишемического повреждения
ткани мозга. В настоящее время описано два основных пути клеточной смерти: активный и пассивный. Некроз – это процесс, который может быть вызван почти всеми патологическими воздействиями (включая физические, химические и биологические). Последовательность патологических событий при некрозе всегда сходна: осмолизис, вызванный клеточным отеком, приводит к пассивной смерти поврежденной клетки. Некроз поражает не только нервную клетку. Одним из вторичных его эффектов является воспаление, которое вызывается высвобождаемым клеточным содержимым и сопровождается выработкой цитокинов. Другим механизмом клеточной смерти является апоптоз, в который вовлечена АТФ в отличие от некроза.
Повреждение мозга, вызванное инсультом, запускает воспалительный каскад, что увеличивает тканевое поражение. Вовлеченные микроглия, макрофаги и лейкоциты совместно с нейронами и астроцитами выделяют медиаторы воспаления, такие как синтаза оксида азота, циклооксигеназа-2, интерлейкин-1 и моноцитарный хемоаттрактантный белок-1. Активация микроглии является важной особенностью в области пенумбры. Вследствие бивалентной природы микроглиальных продуктов – деструктивных (свободные радикалы) и протективных (факторы роста) – участие микроглии в цере-бральной ишемии носит комплексный характер.
Первичная нейропротекция направлена на прерывание быстрых реакций глутамат-кальциевого каскада, свободнорадикальных механизмов. Этот вид нейропротекции необходимо начинать с первых минут ишемии и продолжать на протяжении первых 3 дней инсульта, особенно активно в первые 12
часов. К препаратам этого ряда относятся антагонисты потенциалзависимых кальциевых каналов (дигидропиридины – например, нимодипин), антагонисты глутаматных рецепторов (например, широко применяемая магнезия является неконкурентным антагонистом NMDA-рецепторов), ингибиторы синтеза и пресинаптического высвобождения глутамата (производные гамма-аминомасляной кислоты –
ГАМК, глицин) и др.
Вторичная нейропротекция направлена на уменьшение выраженностиотдаленных последствий ишемии: на блокаду противовоспалительных цитокинов, молекул клеточной адгезии, торможение прооксидантных ферментов,усиление трофического обеспечения, прерывание апоптоза. Она может быть начата спустя 3–6 часов после развития инсульта и должна продолжаться по меньшей мере 7 дней. В группу вторичных нейропротекторов входят антиоксиданты, антитела к молекулам межклеточной адгезии, статины, эстрогены, нейротрофические факторы, нейропептиды, ганглиозиды, ноотропы и т. д.
Существуют и другие подходы к классификации нейропротекторных препаратов, основанные на учете уровня поражения головного мозга. В экс-периментах на животных показано, что в остром периоде церебральной катастрофы наблюдается повышенная продукция большинства медиаторов. По мере стихания остроты патологического процесса эта нейротрансмиттерная буря сменяется медиаторным истощением. Именно поэтому клинические признаки угнетения стволового уровня, как правило, проявляются на фоне ослабления всех медиаторных систем, в первую очередь холинергических.
В процессе выздоровления отмечается постепенное и зачастую неравномерное восстановление нейромедиаторных систем. Эти процессы определяют клиническую картину подкоркового уровня.
Приниципиально можно обнаружить преимущественное нарушение двух систем: чаще – дофаминергической и реже – холинергической. На полушарном уровне восстанавливается межполушарная асимметрия, детали клинической симптоматики зависят от стороны поражения.
При преимущественном угнетении функции левого полушария симптомы чаще всего связаны с относительной холинергической недостаточностью, при угнетении правого полушария механизмы нарушений менее специфичны, иногда их можно объяснить ГАМКергической недостаточностью [1].
Одним из перспективных направлений нейропротекции является воздействие на холиновый обмен в центральной нервной системе как за счет препаратов-донаторов (при поступлении которых увеличивается содержание холина), так и препаратов, обладающих антихолинэстеразным действием [2, 13]. Препараты, содержащие глицерилфосфорилхолин, восполняют уровень холина в нейронах.
Глицерилфосфорилхолин содержит 40 % холина и трансформируется в организме в активный метаболит фосфорил-холин, активирующий биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов [3].
Цитидин дифосфохолин (CDP-холин или цитиколин) Цераксон® –мононуклеотид, содержащий в своей
химической структуре рибозу, цитозин, пирофосфат и холин; его формула –2-окси-4-аминопиримидин. CDP-холин – необходимое промежуточное вещество в синтезе структурных фосфолипидов клеточных мембран. Основной компонент цитиколина холин хорошо всасывается в кишечнике и проникает через гематоэнцефалический барьер. Являясь предшественником ацетилхолина, цитиколин обеспечивает усиление синтеза и высвобождение ацетилхолина с повышением активности холинэргической
системы. Согласно экспериментальным данным, препарат оказывает мультимодальное нейропротективное действие: восстанавливает активность Na+/K+-АТФазы клеточной мембраны, снижает активность фосфолипазы A2 и участвует в синтезе фосфатидилхолина, т. е. оказывает
антиоксидантный и мембраностабилизирующий эффекты. Кроме того, цитиколин ингибирует глутаматиндуцированный апоптоз и усиливает механизмы нейропластичности. Таким образом, в целом цитиколин обеспечивает защиту и восстановление поврежденных клеточных мембран. Безопасность препарата была продемонстрирована в исследованиях на животных [15]. Эффективность цитиколина была доказана экспериментально: в исследовании транзиторной ишемии у крыс отмечалось уменьшение размера инфаркта, тенденция к уменьшению выраженности отека мозга и смертности [14]. Кроме того, в эксперименте цитиколин оказывал благоприятный эффект при реперфузионном повреждении мозговой ткани, что было показано с помощью уменьшения размера инфаркта у крыс при применении цитиколина в комбинации с тромболитической терапией [7].
Цитиколин является одним из немногих нейропротекторных препаратов с доказанной клинической
эффективностью. Уже в первых контролируемых исследованиях, проведенных в конце 1990-х гг., у пациентов с острым ишемическим инсультом была продемонстрирована эффективность цитиколина в широком диапазоне доз (500–2000 мг в сутки) как при пероральном приеме так и при внутривенном введении [9–11]. Подтверждение эффективности препарата было получено и при анализе данных нейровизуализации: отмечено уменьшение размера инфаркта по результатам МРТ в режиме диффузионно-взвешенного изображения в группе цитиколина [16]. Результаты, полученные в разных клинических исследованиях, были проанализорованы и представлены медицинской общественности в 2002 г. [13]. Анализ проводился на выборке из 1372 пациентов, удовлетворявших установленным
критериям: тяжесть инсульта (исходно по шкале NIH ≥ 8), предшествующий функциональный статус (модифицированная шкала Рэнкина ≤ 1), терапевтическое окно не более 24 часов и применение соответствующих методов нейровизуализации. В качестве критерия эффективности была выбрана
частота общего восстановления через 3 месяца по трем анализируемым шкалам (шкала Рэнкина ≤ 1 + шкала NIH ≤ 1 + индекс Бартеля ≥ 95), с помощью описанного ранее метода общих оценочных уравнений (GEE). В этой группе из 1372 пациентов 583 получали плацебо и 789 – цитиколин (264 пациента получали 500 мг, 40 – 1000 мг и 485 пациентов – 2000 мг препарата в сутки). Общее восстановление через 3 месяца было достигнуто у 25,2 % пациентов, получавших цитиколин, и 20,2 % пациентов в группе плацебо (ОР: 1,33; 95 % ДИ: 1,10–1,62; p = 0,003); наиболее эффективная доза
составила 2000 мг в сутки. Эта доза привела к полному восстановлению через 3 месяца 27,9 % пациентов, получавших препарат (ОР: 1,38; 95 % ДИ: 1,10–1,72; p = 0,004). В дополнение к этому безопасность цитиколина была такой же, как и в группе плацебо [13].
Авторы сделали также вывод, что мета-анализ исследований с цитиколином при остром и подостром инсульте свидетельствует о благоприятном и выраженном влиянии препарата с абсолютным снижением отдаленной инвалидизации и смертности на 10–12 % (т. е. число пациентов с индексом ≥ 3
по модифицированнои шкале Рэнкина значительно снизилось). Эти результаты согласуются с результатами ранее описанного мета-анализа [16]. Что касается безопасности, в 2009 г. в Южной Корее было проведено исследование, которое включило 4191 пациента с острым инсультом, получавшего цитиколин. При перральном приеме цитиколин улучшил неврологический, функциональный и глобальный статус пациентов с острым ишемическим инсультом и не вызывал серьезных проблем с безопасностью [17].
Проведенные исследования позволили внести цитиколин в Европейские рекомендации по лечению инсульта. Для лечения инсульта в острый период рекомендуется назначать цитиколин в дозе 2000 мг/сут в первые часы от момента развития инсульта, а в восстановительном периоде ишемического и геморрагического инсультов доза может варьироваться от 500 до 2000 мг в сутки [18].
Таким образом, начиная с первых дней заболевания после формирования морфологически инфарктных изменений в веществе мозга все большее значение приобретает репаративная терапия, направленная на улучшение пластичности здоровой ткани, окружающей инфаркт, активацию образования полисинаптических связей, увеличение плотности рецепторов. Вторичные нейропротекторы, обладающие трофическими и модуляторными свойствами, а также ноотропы усиливают регенераторнорепаративные процессы, способствуя восстановлению нарушенных функций. Комплексный подход к решению вопроса о терапии ишемических НМК с учетом стадии развития заболевания и преимущественных эффектов различных препаратов позволяет индивидуализировать нейропротекторную терапию и, соответственно, улучшать прогноз жизни и реабилитации
пациентов.
Шмырев Владимир Иванович – доктор медицинских наук, профессор, заведующий кафедрой неврологии ФГБУ
“Учебно-научный медицинский центр” Управления делами Президента РФ.
Крыжановский Сергей Михайлович – кандидат медицинских наук, невролог ФГБУ “ЦКБ с поликлиникой” Управления делами Президента РФ. e-mail:
Управления делами Президента РФ. E-mail:




