Втечение последних 20 лет в мире сложилась неблагоприятная эпидемическая обстановка по вирусным гепатитам В и С. По данным Всемирной организации здравоохранения (ВОЗ), 400 млн человек инфицированы вирусом гепатита В, ежегодно заболевают вирусным гепатитом В (ВГВ) около 50 млн человек. Вирусом гепатита С инфицированы около 3 % населения, 3–4 млн человек заражаются гепатитом С ежегодно, и у 70 % из них развивается хронический вирусный гепатит С (ВГС) [6, 7, 9].
В России в 2001 г. число больных ВГВ составляло 16 случаев на 100 тыс. населения, в 2010 г. – 13,3 на 100 тыс. Число больных хроническим ВГС в 2001 г. составляло 22,5 случая на 100 тыс., в 2010 г. – 40,2 на 100 тыс. населения (C.M. Chu, Y.F. Liaw, 2009). Внедрение вакцинации против НВV- (Hepatitis B virus)-инфекции изменило соотношение между двумя наиболее частыми формами вирусной патологии печени с выходом на передний план в структуре заболеваемости хронического ВГС (D.F. Stroup, J.A. Berlin, S.C. Morton et al. Meta-analysis 2008–2011) [5, 6].
ВОЗ предложены критерии оценки распространенности ВГВ и ВГС в разных странах и регионах. Россию относят к территориям со средней интенсивностью заболеваемости ВГВ и высокой распространенностью ВГС. Кроме того, по данным ряда авторов, количество недиагностируемых бессимптомных форм ВГ минимум в 5–6 раз превышает таковое клинически выраженных случаев [9].
Значителен экономический ущерб от гепатитов; например, в США он ежегодно превышает 300 млн долл.
В сведениях об экономических затратах по России сообщается, что экономические потери, связанные с ВГВ, в Москве в 2000 г. составили 115,6 млн руб., что больше, чем при всех других болезнях инфекционной природы. Следует отметить, что ВГВ обходится государству дороже, чем другие инфекции, стоимость одного острого случая заболевания уступает только полиомиелиту и столбняку [5].
 Важной особенностью эпидемического процесса является затруднение в постановке диагноза, в связи с наличием т. н. внепеченочных проявлений ВГ. Научные исследования последних лет показали, что вирусы гепатитов В и С помимо острых и хронических гепатитов, а также их осложнений (цирроза, гепатоцеллюлярной карциномы) способны вызывать поражения других органов и систем, причем в ряде случаев спустя 5–10 лет после инфицирования они могут быть единственным проявлением вирусной инфекции [6, 10–12]. Внепеченочные проявления могут выступать в качестве самостоятельного заболевания, однако этиология их в течение многих лет остается нерасшифрованной, что, естественно, затрудняет правильное лечение. Согласно литературным данным, внепеченочные проявления при хроническом ВГВ имеют место в 22–35 %, при ВГС – в 40–74 % случаев от общего количества обследованных пациентов с данной патологией [7, 9, 11, 13].
Важной особенностью эпидемического процесса является затруднение в постановке диагноза, в связи с наличием т. н. внепеченочных проявлений ВГ. Научные исследования последних лет показали, что вирусы гепатитов В и С помимо острых и хронических гепатитов, а также их осложнений (цирроза, гепатоцеллюлярной карциномы) способны вызывать поражения других органов и систем, причем в ряде случаев спустя 5–10 лет после инфицирования они могут быть единственным проявлением вирусной инфекции [6, 10–12]. Внепеченочные проявления могут выступать в качестве самостоятельного заболевания, однако этиология их в течение многих лет остается нерасшифрованной, что, естественно, затрудняет правильное лечение. Согласно литературным данным, внепеченочные проявления при хроническом ВГВ имеют место в 22–35 %, при ВГС – в 40–74 % случаев от общего количества обследованных пациентов с данной патологией [7, 9, 11, 13].
Трудности в диагностике хронического вирусного гепатита (ХВГ) могут быть обусловлены длительным (до 25 лет) бессимптомным течением заболевания. Например, по данным Д.Т. Абду-рахманова, в 53 % случаев ХВГ манифестными являются признаки цирроза печени (кровотечение из варикозно расширенных вен пищевода, желтуха, асцит), в 20,5 % первыми признаками являются внепеченочные проявления (кожный васкулит, артриты, миалгии, нефротический синдром, цитопения) и в 26,5 % заболевание выявляется при случайном обследовании, при полном отсутствии жалоб [4, 7, 9].
Диагностику вирусных гепатитов (ВГ) условно можно разделить на две группы: общую, при которой используются классические методы постановки диагноза, и специальную для подтверждения или исключения вирусной этиологии гепатитов (иммуноферментный анализ – ИФА, молекулярно-биологические исследования и иммуногистохимический метод) [9, 10].
Общая постановка диагноза ВГ основывается на сборе анамнеза, клиническом осмотре пациента, использовании дополнительных методов исследования. Оценивается комплекс лабораторных биохимических печеночных тестов, отражающих белковый, углеводный, пигментный, липидный обмены, позволяющий уточнить наличие цитолиза, холестаза, иммунных нарушений и др. Общими для всех больных ВГ являются ультразвуковое исследование (УЗИ), эндоскопические методы, по показаниям – компьютерная и магнитно-резонансная томография. В ряде случаев при дифференциальной диагностике используется позитронно-эмиссионная томография и проводится гистоморфологическое исследование печени. В последние годы в медицинскую практику входят новые биопрогностические неинвазивные технологии, которые скоро могут стать альтернативой биопсии печени, – эластография и Фибротест [1, 2, 9, 10].
 В основе специальной современной диагностики хронического ВГВ лежит выявление в сыворотке крови антигенов вируса гепатита В и антител к ним, а также выявление ДНК-маркера репликативной активности вируса. Маркеры вируса гепатита В представлены HBsAg (поверхностным антигеном), HBcAg (ядерным антигеном), HBeAg (промежуточным антигеном) и соответствующими антителами, анти-HBs, или HBsab , анти-HBc-IgM и -IgG, или HBc-ab, анти-HBe, или HBeab [3, 4, 14, 16]. Все специальные методы исследования для определения специфических маркеров ХГВ можно разделить на два этапа.
В основе специальной современной диагностики хронического ВГВ лежит выявление в сыворотке крови антигенов вируса гепатита В и антител к ним, а также выявление ДНК-маркера репликативной активности вируса. Маркеры вируса гепатита В представлены HBsAg (поверхностным антигеном), HBcAg (ядерным антигеном), HBeAg (промежуточным антигеном) и соответствующими антителами, анти-HBs, или HBsab , анти-HBc-IgM и -IgG, или HBc-ab, анти-HBe, или HBeab [3, 4, 14, 16]. Все специальные методы исследования для определения специфических маркеров ХГВ можно разделить на два этапа.
Метод ИФА и подтверждающий рекомбинантный иммуноблот-анализ (RIBA – recombinant immunoblot assay), применяющиеся для определения основных маркеров HBV-инфекции:
- HBsAg, который появляется в сыворотке крови спустя 1–10 недель от момента инфицирования и сохраняется в течение всего периода болезни: антитела к HBsAg выявляются после исчезновения HBsAg, указывают на выздоровление и сохраняются в течение всей жизни;
- НВеAg обнаруживается практически одновременно с HBsAg и свидетельствует об уровне виремии и высокой контагиозности процесса; сохраняется в течение многих лет и исчезает после появления антител к нему – анти-НВе, которые остаются пожизненно [2–4, 9];
- НВсAg, являясь ядерным антигеном вируса, определяется в клетках печени с помощью иммуногистохимического метода исследования, основанного на использовании специфической окраски морфологических срезов печени с помощью меченых антител;
- Анти-HBc-IgM и -IgG циркулируют в крови и определяются в сыворотке крови методом ИФА; анти-HB-IgM сохраняются в течение всей болезни, анти-HBc-IgG – в течение всей жизни.
2. Молекулярно-биологический метод – полимеразная цепная реакция (ПЦР) – позволяет выявлять наличие ДНК-HBV в сыворотке крови с помощью определения вирусоспецифического фермента – ДНК-полимеразы. В настоящее время появилась возможность определять ДНК ВГВ в качественном и количественном вариантах. Для прямого выявления ДНК ВГВ используют FISH-(Fluorescence in situ hybridization)-метод. Новые технологические разработки с применением флуоресцентных меток значительно расширяют диагностические возможности [8, 10]. Кроме ПЦР ДНК-HBV определяют в крови методом разветвленной ДНК, основанным на амплификации (увеличении) сигналов гибридизации [9]. Низкий уровень виремии возможно выявить с помощью высокочувствительного метода ПЦР – «гнездной ПЦР» [4, 9].
Для характеристики течения и прогноза ХВГ в настоящее время разработано иммуногистохимическое исследование ткани печени – TUNEL-test, позволяющий количественно определять Fas-R и TGF-β1 (Transforming growth factor β1) и выявлять клетки, вступившие в апоптоз (гибель).
Выраженность экспрессии в ткани печени Fas-R и TGF- β1 может использоваться наряду с уровнем аминотрансфераз, индексом активности и фиброза для характеристики течения и прогноза заболевания, а также эффективности противовирусной терапии [4]. Однако этот метод используется преимущественно в научных целях.
В современной диагностике хронического ВГС основная роль отводится выявлению анти-HCV методом ИФА и HCV РНК – методом ПЦР. Наличие анти-HCV является признаком как текущей, так и перенесенной инфекции. У больных хроническим ВГС анти-HCV обнаруживаются не только в свободной форме, но и в составе циркулирующих иммунных комплексов, отвечающих за многие внепеченочные проявления [2, 7–9].
 Существует несколько поколений диагностических систем для выявления анти-HCV, отличающихся чувствительностью и специфичностью [8]. Первая диагностическая система ИФА, использующая рекомбинантный антиген С-100, была разработана в 1989 г. в лаборатории М. Houghton и быстро получила повсеместное распространение. Она позволяет улавливать антитела в зоне, характеризующей наличием всего 12 % вирусного белка. Тест-системы 2-го поколения, созданные в 1991 г., определяют антитела к белкам в разных зонах генома не только неструктурной, но и структурной области. При использовании диагностических систем 1-го и 2-го поколений не исключены ложноотрицательные результаты, в частности, у больных с необычными для данного региона генотипами HCV. Наиболее совершенные диагностические системы 3-го и 4-го поколений, которые используются в клинической практике начиная с 1998 г., позволяют выявлять анти-HCV в 99,7 % случаев. В некоторых исследованиях антитела к HCV могут не обнаруживаться, например, при запаздывании иммунного ответа, применении иммуносупрессивной терапии или при угнетении иммунитета на фоне онкологического заболевания, приема наркотических веществ и т. д. В подобных случаях антитела к HCV определяют с помощью RIBA [8–10].
Существует несколько поколений диагностических систем для выявления анти-HCV, отличающихся чувствительностью и специфичностью [8]. Первая диагностическая система ИФА, использующая рекомбинантный антиген С-100, была разработана в 1989 г. в лаборатории М. Houghton и быстро получила повсеместное распространение. Она позволяет улавливать антитела в зоне, характеризующей наличием всего 12 % вирусного белка. Тест-системы 2-го поколения, созданные в 1991 г., определяют антитела к белкам в разных зонах генома не только неструктурной, но и структурной области. При использовании диагностических систем 1-го и 2-го поколений не исключены ложноотрицательные результаты, в частности, у больных с необычными для данного региона генотипами HCV. Наиболее совершенные диагностические системы 3-го и 4-го поколений, которые используются в клинической практике начиная с 1998 г., позволяют выявлять анти-HCV в 99,7 % случаев. В некоторых исследованиях антитела к HCV могут не обнаруживаться, например, при запаздывании иммунного ответа, применении иммуносупрессивной терапии или при угнетении иммунитета на фоне онкологического заболевания, приема наркотических веществ и т. д. В подобных случаях антитела к HCV определяют с помощью RIBA [8–10].
Для подтверждения HCV-инфекции у анти-HCV положительных пациентов с помощью метода ПЦР проводится определение РНК HCV. При этом оценивается репликативная активность вируса в сыворотке крови и тканях, устанавливается генотип вируса и осуществляется наблюдение за изменчивостью HCV [3, 9, 10]. Используется также метод разветвленной ДНК [8].
В настоящее время находят применение новые биопрогностические технологии (эластография и Фибротест), которые могут быть использованы при современной диагностике вирусных заболеваний печени [10, 15, 18]. Эластография – это новейший метод неинвазивной диагностики, позволяющий с помощью ультразвукового аппарата «Фиброскан» определять степень фиброза печени (оценка фиброза проводится на основании определения эластичности тканей печени). При эластографии объем ткани печени, подвергающейся исследованию, составляет около 6 см3, что значительно превосходит таковой при биопсии печени (оценивается в килопаскалях и по таблице сопоставляется со шкалой METAVIR). Исследование проводится в течение 5 минут и не сопровождается неприятными ощущениями у пациента, что позволяет использовать данный метод значительно чаще биопсии печени. Эластография дает возможность динамически оценить течение хронических вирусных заболеваний печени и эффективность проводимого лечения [15]. Экономические затраты на проведение эластографии значительно ниже, чем при проведении биопсии печени.
В 7 исследованиях, в которых приведены данные больных ХВГ с фиброзом печени II–IV стадий, суммарная чувствительность составила 70 % (95 % доверительный интервал [ДИ] – 67–73 %), специфичность – 84 % (95 % ДИ – 80–88 %). Клиническое использование ультразвуковой эластографии, по данным этих исследований, для диагностики цирроза печени представляется оправданным [19].
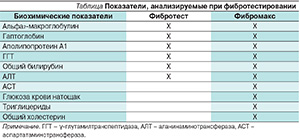
Фибротест и Фибромакс (расширенный тест) – это методы исследования, основанные на использовании математического анализа биохимических показателей венозной крови, позволяют получать точную количественную и качественную оценку фиброза и некровоспалительных изменений в печени (см. таблицу).
Помимо параметров, указанных в таблице, исследование Фибротест включает сведения о поле, возрасте, массе тела и росте. Указанный тест исключает возможность ошибок, встречающихся при локальном исследовании материала печени, полученного методом пункционной биопсии. Фибротест выявляет стадии фиброза (F0, F1, F2, F3, F4) и степень некровоспалительного процесса (А0, A1, A2, А3) по общепринятой международной системе METAVIR, позволяющей легкодоступную универсальную интерпретацию результатов. Диагностическая ценность Фибротеста подтверждается при определении как промежуточных, так и крайних стадий фиброза [18].
 На сегодняшний день биопрогностические исследования, эластрография и Фибротест не включены в стандарты диагностики ХВГ по системе обязательного медицинского страхования, поэтому их использование может осуществляться только в рамках добровольного медицинского страхования, а чаще – за счет собственных средств пациентов.
На сегодняшний день биопрогностические исследования, эластрография и Фибротест не включены в стандарты диагностики ХВГ по системе обязательного медицинского страхования, поэтому их использование может осуществляться только в рамках добровольного медицинского страхования, а чаще – за счет собственных средств пациентов.
Современная концепция модернизации отечественного здравоохранения предусматривает необходимость получения полной и обновляемой в режиме «реального времени» информации о качестве медицинской помощи пациентам, в первую очередь страдающим социально значимыми заболеваниями, поэтому особую актуальность приобретает оценка диагностики и тактики ведения больных ХВГ.
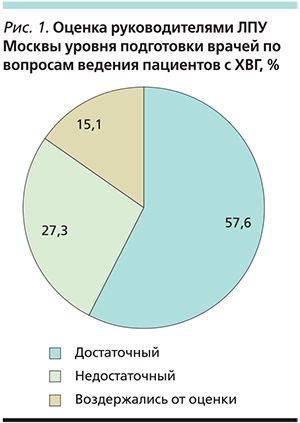
В связи с вышеизложенным нами было проведено анкетирование главных врачей 105 лечебно-профилактических учреждений (ЛПУ) общетерапевтического профиля Москвы. Анкетирование руководителей учреждений осуществлялось по вопросам организации обследования и лечения больных ХВГ. Анкета включала 20 вопросов, в т. ч. вопросы по диагностике ХВГ. В первую очередь был проведен анализ оценки руководителями ЛПУ уровня подготовки терапевтов, гастроэнтерологов, инфекционистов по вопросам ВГ (рис. 1).
Согласно представленной диаграмме, по мнению главврачей, только в 57,6 % ЛПУ Москвы специалисты способны обеспечивать полноценную медицинскую помощь больным ХВГ, при этом однозначно положительно высказались 35 % руководителей ЛПУ, оценка 22,6 % была неопределенной – ближе к положительному ответу (35 % ответов – да, 22,6 % – скорее да, чем нет). В 15,1 % случаев респонденты воздержались от ответа. Из 27,3 % главврачей, признавших уровень подготовки специалистов недостаточным, в 10 % ответ был отрицательным, в 17,3 % – скорее нет, чем да.
Вместе с тем 51,5 % руководителей ЛПУ сообщили, что, по их мнению, вопросы диагностики и лечения больных ХВГ В и С приоритетны: 63,6 % отметили, что данные вопросы они считают важными, требующими дальнейшего изучения; 9 % высказали мнение, что есть более важные проблемы (следует уточнить, что каждому из анкетируемых была предоставлена возможность давать несколько вариантов ответа).
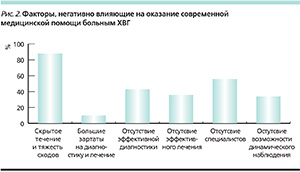
Обсуждая причины, лежащие в основе затруднения оказания адекватной и своевременной медицинской помощи больным ХВГ, 88 % главных врачей ответили, что основной причиной является скрытое течение болезни и тяжесть исходов, 43 % отметили отсутствие эффективной технологии диагностики и наблюдения за больными, 38 % респондентов отметили, что трудности ведения больных связаны с отсутствием эффективных технологий лечения, 55% – с нехваткой специалистов, 10 % – с большими экономическими затратами на диагностику и лечение.
Оценивая вышеперечисленные результаты анкетирования можно отметить, что, по всей видимости, повышение уровня знаний специалистов может оказать положительные результаты в решении вопросов диагностики ХВГ (рис. 2).
 В приказе № 415 от 02.06.10 об утверждении порядка оказания медицинской помощи населению при заболеваниях гастроэнтерологического профиля определено, что оказание консультативной, диагностической и лечебной помощи больным ХВГ, циррозами печени осуществляет гастроэнтеролог, а направляются эти больные участковыми врачами-терапевтами или врачами общей практики (семейными врачами).
В приказе № 415 от 02.06.10 об утверждении порядка оказания медицинской помощи населению при заболеваниях гастроэнтерологического профиля определено, что оказание консультативной, диагностической и лечебной помощи больным ХВГ, циррозами печени осуществляет гастроэнтеролог, а направляются эти больные участковыми врачами-терапевтами или врачами общей практики (семейными врачами).
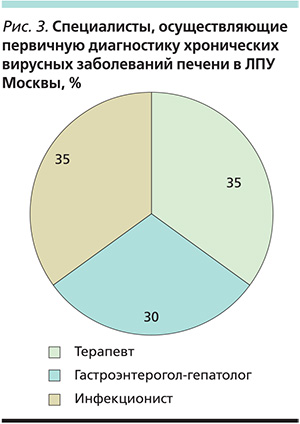
По данным анкетирования главных врачей выявлено, что в 35 % ЛПУ первичную диагностику ХВГ проводят терапевты; в 35 % ЛПУ – инфекционисты и в 30 % – гастроэнтеролог-гепатолог (рис. 3); 75 % главных врачей считают, что больные ХВГ после установки диагноза должны наблюдаться амбулаторно, что, несомненно, правильно и с экономической точки зрения, и с точки зрения модернизации всей медицинской службы в пользу амбулаторной помощи.
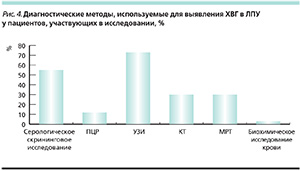
При анализе используемых методов диагностики главврачи указывают, что только в 55 % ЛПУ проводится серологическое скрининговое исследование и лишь в 10 % ЛПУ используется ПЦР-диагностика, чего недостаточно для ранней постановки диагноза и начала лечения больных ХВГ. Общепринятые, обязательные лабораторные биохимические исследования и УЗИ-диагностика в целом проводятся в 70 % (рис. 4). Проведенное исследование позволяет заключить, что диагностические стандарты ХВГ в ЛПУ общетерапевтического профиля выполняются недостаточно. Вместе с тем именно в этих учреждениях отмечается наибольшая обращаемость больных, страдающих социально значимыми заболеваниями, в т. ч. ВГ.
Таким образом, вышеизложенное позволяет сделать вывод о необходимости дополнительной подготовки медицинских кадров для рациональной организации медицинской помощи больным ХВГ. При этом знания, полученные из современных источников, использование стандартов диагностики по ИФА и ПЦР, применение новых биопрогностических неинвазивных технологий будут способствовать своевременной диагностике, рациональному лечению и профилактике тяжелых осложнений, улучшению качества жизни пациентов, а также минимизации экономических расходов.



