Исторически учение о кардиалгии своими корнями уходит к древнегреческой медицине, которая, несмотря на сильно выраженный духовный компонент в своей концепции, в значительной мере опиралась на естественные причины болезней и рациональные методы их лечения. В соответствии с древнегреческими представлениями о природе боли врачи того времени для описания болевых ощущений, исходящих, по их мнению, из верхнего отдела желудка, стали применять термины καρδιαλγια и καρδιγμοσ. В дальнейшем эти термины были заимствованы древнеримскими врачами, однако в зависимости от контекста они стали обозначать как боль, исходящую из верхнего отдела желудка, так и боль, исходящую из сердца (cardialgia и cardiogmos Галена, а также cardiaca passia Аретия и cardimona Сорания), с учетом анатомической близости и господствовавших тогда представлений о происхождении боли. В древнеримской медицинской школе под термином cardia подразумевалась часть желудка, прилегающая к пищеводу, а термин cordial обозначал относящийся как к области кардии, так и прилегающих органов, включая сердце. Такая терминологическая неопределенность сохранилась и в Новое время, когда термин “кардиалгия“ получил второе рождение в классической работе К.Ф. Рихтера (1671) [1].
К настоящему времени термин “кардиалгия” практически исчез из современной западной медицинской лите-ратуры, уступив место такому поня тию, как “боль в грудной клетке“ (chest pain, Thoraxschmerz, douleur thoracique). В отечественной медицинской литературе термин “торакалгия” в основном применяется в неврологической практике, в то время как терапевты и кардиологи продолжают активно использовать термин “кардиалгия”, подчеркивая особенность локализации болевого синдрома (БС). С точки зрения неврологии в зависимости от локализации выделяют локальную, отраженную и иррадиирущую боль в грудной клетке. Локальная боль может быть связанной с любым патологическим процессом, который воздействует на болевые рецепторы кожи, мышц, сухожилий, связок, суставов, костей и других тканей и ощущается непосредственно в области тканевого повреждения. Отраженная боль распространяется в пределах дерматомов, связанных с иннервацией поврежденных структур, и обычно обусловлена патологией внутренних органов. Иррадиирущая боль, связанная с растяжением, раздражением, сдавлением корешка или соматического нерва, характеризуется бóльшей интенсивностью и дистальным распространением в зону соответствующего дерматома, а также обычно усиливается при кашле, чихании или физической нагрузке. В зависимости от причины в неврологической практике выделяют вертеброгенные (патогенетически обусловленные изменениями в позвоночнике) и невертеброгенные торакалгии. Для кардиологов и терапевтов более важным является наличие или отсутствие ишемического генеза боли в грудной клетке, поэтому клиническая классификация болей в грудной клетке предполагает их разделение на типичную стенокардию, атипичную стенокардию и боль в грудной клетке внесердечного происхождения (табл. 1). Таким образом, в настоящее время целесообразно использовать термин “кардиалгия” в качестве эквивалента боли или чувства дискомфорта в грудной клетке, не связанных с острой или хронической ишемией миокарда (non-cardiac chest pain) [2–4].
Таблица 1. Клиническая классификация боли в грудной клетке [5].
Надо сказать, что истинное число людей, испытывающих боль в грудной клетке по типу кардиалгии, оценить не представляетcя возможным, т. к. не все они обращаются за медицинской помощью. На основании данных популяционных исследований, распространенность кардиалгий в популяции составляет 13–24 %. Из числа обращений к врачу общей практики с жалобами на боль в грудной клетке, на кардиалгии приходится 70–80 %, в то время как частота кардиалгий в структуре БС в области грудной клетки при обращении в отделения неотложной помощи уменьшается до 30 %, составляя 2–5 % всех диагнозов. По данным отечественных авторов, боль в грудной клетке по типу кардиалгии испытывают почти четверть пациентов, обратившихся за медицинской помощью к врачу общей практики. В связи с большой распространенностью кардиалгии, полиморфизмом ее клинических проявлений, отсутствием единых надежных алгоритмов диагностики и стандартов оказания медицинской помощи данной категории пациентов, проблема БС в грудной клетке приобретает еще и существенное экономическое значение для бюджета здравоохранения [6–10].
Рисунок 1. Характерная локализация боли в грудной клетке при различных заболеваниях.
Пациенты с жалобами на боль в области грудной клетки представляют собой одну из наиболее сложных для диагностики категорий. Сам феномен боли, будучи на какой-то период ведущим в клинической картине, одновременно находится в структуре различных аффективных и вегетативных нарушений, патогенетически связанных с болями в сердце. При этом нередко различные ощущения (например, парестезии, чувство давления, сжатия и т. д.) обобщенно воспринимаются больными как “боль”, а левая половина грудной клетки или грудины обозначается ими как “сердце” [11, 12]. Дифференциальный диагноз при наличии данных клинических проявлений включает очень широкий спектр нозологических форм и в первую очередь требует исключения заболеваний, представляющих непосредственную угрозу для жизни пациента. Таким образом, подход к дифференциальной диагностике БС в грудной клетке основан, с одной стороны, на презумпции потенциально угрожающего жизни состояния, с другой – на анатомической модели, предполагающей последовательное рассмотрение вероятности поражения анатомических образований, расположенных в грудной клетке, начиная от кожи и заканчивая внутренними органами [13].
При обращении за медицинской помощью пациентов с впервые возникшим БС в области грудной клетки врачу в первую очередь необходимо оценить следующие аспекты [14, 15]:
• клиническую стабильность – нуждается ли пациент в проведении неотложной терапии в связи с наличием признаков состояний, угрожающих жизни (гемодинамические расстройства, дыхательная недостаточность и т. д.);
• ближайший прогноз – при клинической стабильности выявление риска угрожающих жизни состояний (острый коронарный синдром – ОКС, острый аортальный синдром, эмболия легочной артерии и т. д.);
• определение порядка и условий оказания медицинской помощи – объем и очередность необходимых
диагностических методов, ведение пациента в амбулаторных условиях, необходимость госпитализации
(экстренная или плановая).
Если пациент не нуждается в оказании экстренной медицинской помощи, у врача есть запас времени, чтобы провести достаточное обследование, направленное на уточнение генеза БС. Краеугольным камнем дифференциальной диагностики по-прежнему остается целенаправленный и тщательный сбор жалоб и анамнеза, включающий детализацию характеристик БС (табл. 2).
Таблица 2. Оценка характеристик болевого синдрома [16].
Следует отметить, что, хотя некоторые характеристики БС в грудной клетке и обладают определенным прогностическим значением в отношении позитивной или негативной диагностики ИБС, ни одна из них как в отдельности, так и в комбинации не позволяет безопасно отпустить пациента без проведения дополнительного обследования [17, 18]. Кроме того, в ряде работ показано, что неспецифическая боль в области грудной клетки пациентов с факторами риска развития сердечно-сосудистых заболеваний обладает неблагоприятным прогнозом в плане развития фатальных коронарных осложнений [19].
Как правило, дообследование пациентов показано в следующих случаях [20–22]:
• боль в грудной клетке давящего, сжимающего характера или ощущение тяжести;
• боль в грудной клетке, иррадиирущая в шею, нижнюю челюсть, плечи, спину или руки;
• диспепсия или изжога, тошнота и/или рвота, связанные с дискомфортом в грудной клетке;
• постоянная одышка;
• слабость, головокружение, эпизоды потери сознания или предобморочных состояний.
Аортальная боль
Острый аортальный синдром – общее понятие для описания состояний, вызванных острым прогрессирующим нарушением целостности стенки аорты. К этой группе относят расслоение аорты, интрамуральную гематому и пенетрирующую атеросклеротическую язву аорты. Появление термина “острый аортальный синдром” связано с практической необходимостью выбора лечебной тактики до установления окончательной этиологии расслоения аорты. Классический клинический признак
расслоения аорты (почти 90 % случаев) – внезапно возникшая резкая боль за грудиной, в спине или эпигастральной области. Особенность БС – его интенсивность, отсутствие купирующего эффекта наркотических анальгетиков и мигрирующий волнообразный характер (начинаясь в большинстве
случаев за грудиной, эпицентр боли постепенно перемещается в область спины, межлопаточное пространство и в эпигастральную область). Миграция боли соответствует распростран
расслоения стенки аорты. Основные диагностические признаки – асимметрия пульса (одностороннее исчезновение пульсации на периферических артериях выявляют в 5–30 % случаев) и артериального давления (при измерении на плечевых артериях разность давления превышает 20 мм рт. ст.), а также признаки аортальной регургитации (шум аортальной регургитации выслушивают в 10–30 % случаев). Для исключения острой ишемии миокарда записывают электрокардиограмму (ЭКГ), также выполняют рентгенографию грудной клетки. Подозрение на наличие острого аортального синдрома является показанием к экстренной госпитализации в профильное лечебно-профилактическое учреждение. Для диагностики расслоения грудного отдела аорты и внутристеночной гематомы применяют трансторакальную и чреспищеводную эхокардиографию, мультиспиральную компьютерную томографию с внутривенным контрастированием или магнитно-резонансную ангиографию. Выбор диагностического метода определяется возможностью лечебного учреждения провести то или иное
исследование в экстренных случаях, а также опыт персонала отделения диагностики [23].
Плевральная боль
Плевральная боль является вариантом ноцицептивной соматической боли, связанной с раздражением париетального листка плевры. Как правило, плевральная боль носит острый характер, достаточно четко локализована и усиливается при глубоком дыхании, кашле или чихании. Причины плевральной боли включают широкий спектр заболеваний как самой плевры, так и прилегающих органов (табл. 3).
Таблица 3. Основные причины плевральной боли.
При подозрении на плевральный характер боли следует оценить наличие и выраженность сопутствующих симптомов (одышка, кашель, кровохарканье, лихорадка), а при непосредственном исследовании больного обратить особое внимание на наличие следующих признаков:
• повышение венозного давления в яремных венах;
• парадоксальный пульс;
• смещение трахеи;
• болезненность при пальпации грудной клетки;
• изменение перкуторного звука;
• шум трения перикарда;
• ослабление дыхания;
• крепитация или влажные мелкопузырчатые хрипы;
• признаки тромбоза глубоких вен голеней.
Обязательными лабораторно-инструментальными исследованиями при наличии плевральной боли
являются общий анализ крови, ЭКГ (синусовая тахикардия, уменьшение амплитуды комплекса QRS, изменения со стороны правых отделов сердца, элевация сегмента ST или депрессия интервала PQ), а также рентгенография органов грудной клетки в двух проекциях (пневмоторакс, инфильтративные или очаговые изменения в легких, плевральный выпот, перелом ребер) [24, 25].
Боль в грудной клетке наблюдается почти у 50 % пациентов с эмболией легочной артерии. Диагноз острой массивной тромбоэмболии легочной артерии (ТЭЛА) обычно бывает очевидным (в отсутствие других заболеваний и наличия факторов риска). В то же время малосимптомные эпизоды ТЭЛА часто оказываются своевременно не замеченными. Наиболее типичными клиническими проявлениями являются одышка, тахипноэ, тахикардия, реже – кашель и кровохаркание, а также клинические признаки тромбоза глубоких вен нижних конечностей. У 80–90 % больных ТЭЛА можно выявить один или несколько предрасполагающих факторов, присутствие которых помогает клиницисту в установлении правильного диагноза. Факторы риска также облегчают принятие решения при “сомнительных” результатах проведенных исследований.
Основные фактора риска развития эмболии легочной артерии:
• неподвижность больного вследствие разных причин: послеоперационный период, сердечная недостаточность, терная томография с контрастным усилением. Подозрение на наличие
эмболии легочной артерии является показанием к экстренной госпитализации [26].
Перикардиальная боль клинически бывает трудноотличимой от боли плеврального характера. При непосредственном исследовании пациента возможно выявить усиление боли в положении лежа на спине и ее облегчение в вертикальном положении, а также шум трения перикарда. Однако информации, полученной при клиническом обследовании, обычно бывает недостаточно. В этом случае опорными диагностическими признаками оказываются выявленные характерные изменения на ЭКГ (рис. 2) и данные эхокардиографии [27].
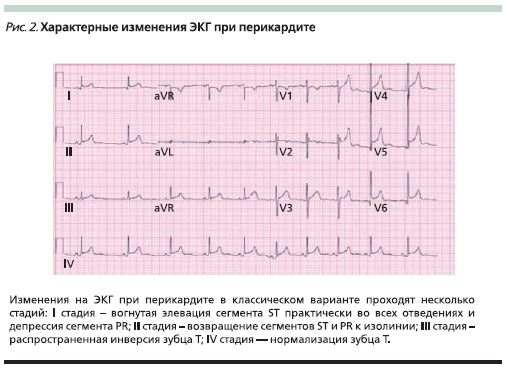
Основу симптоматической терапии при БС в грудной клетке плеврального или перикардиального характера составляют НПВС.
Пищеводная боль
Одной из наиболее частых причин БС в грудной клетке являются различные заболевания пищевода, среди которых наибольшее значение имеют гастроэзофагеальная рефлюксная болезнь (ГЭРБ), заболевания, сопровождающиеся нарушением моторики пищевода, и функциональные расстройства пищевода, которые в соответствии с Римскими критериями III пересмотра обозначаются как функциональные боли в груди, предположительно пищеводного происхождения. На долю ГЭРБ приходится более половины всех случаев пищеводной боли, хотя детальный механизм ГЭРБ-обусловленных кардиалгий неизвестен. В частности, непонятно, почему воздействие кислоты на слизистую оболочку пищевода ощущается одними пациентами как изжога, другими – как боль в грудной клетке, тем более что часть больных предъявляют жалобы на изжогу и ретростернальные боли. Можно предполагать, что ряд пациентов отвечают на раздражение слизистой оболочки пищевода рефлекторным спазмом его гладкой мускулатуры, однако убедительных доказательств, подтверждающих данную гипотезу, пока не представлено. У некоторых пациентов, страдающих
ГЭРБ, выявляется эзофагеальнокардиальный рефлекс – рефлекторный спазм коронарных артерий в ответ на какое-либо стрессовое раздражение. Данный спазм возникает, несмотря на хорошую проходимость сосудов по данным ангиографии, и приводит к снижению коронарного кровотока с
развитием типичного БС в грудной клетке, появлением электрокардиографических изменений, характерных для ишемии миокарда. В отсутствие достаточных оснований для установления диагноза ГЭРБ в качестве вероятного патогенетического механизма часто предполагают нарушение моторики пищевода. Считается, что патологические сокращения стенки пищевода способны раздражать специфические механорецепторы, вызывая боль. Если же рассматривать причины кардиалгии на фоне нарушений моторики пищевода, не связанных с ГЭРБ, чаще выявляется пищевод “щелкунчика” (48 %), за которым следуют неспецифическое расстройство моторики пищевода (36 %), диффузный эзофагоспазм (10 %), повышенный тонус нижнего пищеводного сфинктера (4 %) и ахалазия пищевода (2 %). В то же время единственным видом нарушения моторно-тонической функции пищевода, роль которого четко доказана в возникновении “пищеводной” боли, является ахалазия пищевода (ахалазия кардии, кардиоспазм). Ведущим патогенетическим механизмом, лежащим в основе функциональной боли в груди, предположительно пищеводного происхождения, является т. н. висцеральная гиперчувствительность. Предполагается, что повышенная чувствительность периферических сенсорных окончаний афферентных нервных волокон может быть причиной гиперреактивности слизистой оболочки пищевода в ответ на различные физиологические или патологические стимулы. Кроме того, могут иметь место нарушения центрального генеза в процессе обработки сенсорной информации, поступающей в мозг из пищевода, с локализацией усиленного восприятия афферентных стимулов на уровне головного или задних рогов спинного мозга.
В типичных случаях пищеводная кардиалгия описывается как загрудинная боль, иногда с иррадиацией в область средней части спины, нижнюю челюсть и левую руку, что клинически может быть неотличимо от стенокардии. В связи с этим первый этап диагностического поиска направлен на исключение коронарной болезни сердца как причины БС в грудной клетке. Наличие сопутствующих симптомов, таких как изжога, руминация и регургитация, не должно вводить врача в заблуждение, т. к. в связи с высокой распространенностью в популяции как ИБС, так и
заболеваний пищевода, существует высокая вероятность их сочетания. Только после тщательного исключения сердечно-сосудистой патологии с обязательным участием врачакардиолога следует подумать о возможной патологии пищевода (включая ГЭРБ, моторную дисфункцию и висцеральную гиперчувствительность). Эзофагогастродуоденоскопия является “золотым стандартом” для выявления эрозивного эзофагита и таких осложнений ГЭРБ, как стриктура, изъязвление или пищевод Барретта. При выявлении “симптомов тревоги” (потеря массы тела, дисфагия, одинофагия, анорексия, кровотечение из верхних отделов пищеварительного тракта, анемия) именно с эндоскопического исследования следует начинать обследование пациента, страдающего “пищеводной” болью.
Следует отметить, что у 30–60 % пациентов с выраженными симптомами при эндоскопическом исследовании видимые изменения слизистой оболочки не выявляются, поэтому не потеряло практического значения рентгенологическое исследование пищевода. За последние несколько
лет подходы к диагностике эзофагеальных нарушений претерпели определенные изменения. Это связано с началом широкого использования диагностических тестов с ингибиторами протонной помпы (ИПП) и выявлением низкой чувствительности ряда ранее достаточно популярных исследований.
В соответствии с принципом общемедицинской практики “лечение предшествует диагностике” у пациентов без настораживающих симптомов для диагностики ex juvantibus рекомендуется проведение курсовой терапии ИПП в двойных дозировках (обычно омепразол в суточной дозировке 60–80 мг, рабепразол – по 40 мг/сут или лансопразол по 60–90 мг/сут). Длительность пробного лечебного курса зависит от частоты возникновения боли в грудной клетке у пациента и может составлять от 1 до 28 дней. В частности, при регистрации эпизодов некардиальных болей в грудной клетке 1–2 раза в
неделю длительность диагностического теста с ИПП должна составлять не менее 2 недель. В отсутствие эффекта рекомендуется направление в специализированное гастроэнтерологическое отделение для проведения дополнительного обследования (пищеводная рН-метрия и манометрия). При установлении моторной дисфункции спастического типа (пищевод “щелкунчика”, диффузный эзофагоспазм) рекомендуется назначение теофиллина, при функциональных расстройствах –
модуляторов болевых ощущений (трициклические антидепрессанты, ингибиторы обратного захвата серотонина) [28–30].
Скелетно-мышечная боль
В случаях кардиалгии скелетномышечной природы причиной “отраженной” боли наиболее часто являюся патология дугоотростчатых суставов шейного отдела позвоночника, миофасциальный болевой синдром (МФБС) лестничных, трапециевидных, подостных мышц или мышцы, поднимающей лопатку. Локальная боль наблюдается при синдроме Титце и костохондрите. Иррадиирующая боль в грудной клетке может быть связана с поражением грудного отдела спинного мозга, грудных корешков, межреберных нервов. В отличие от шейного и поясничного отделов грудной отдел позвоночника относительно малоподвижен, что в значительно меньшей степени предрасполагает к развитию грудных компрессионных радикулопатий, связанных с грыжами межпозвонковых дисков или сужением позвоночного канала вследствие дегенеративных изменений. Основные характеристики, позволяющие отличить данный вид боли от стенокардии, включают субъективное описание боли (сжимающая или давящая), четкая локализация боли в области левой половины грудной клетки, отсутствие связи с физической нагрузкой, провокация боли при движении или изменении положения тела, возникновение боли при пальпации.
МФБС – хронический БС, при котором в различных областях тела возникает локальная или сегментарная боль. Патогномоничным признаком МФБС являются миофасциальные триггерные точки, представляющие собой зоны локальной болезненности в вовлеченной в МФБС мышце, при пальпации которой выявляется область местного уплотнения, расположенная вдоль направления мышечных волокон. Обычно размер триггерных точек составляет от 2 до 5 мм. Механическое давление на триггерную точку вызывает не только интенсивную локальную, но и отраженную боль, при этом для каждой из этих точек характерна своя строго определенная зона отраженной боли и парестезий. Когда при надавливании на триггерную точку пациент непроизвольно пытается устранить вызвавший боль раздражитель, данный феномен описывается как “симптом прыжка”, являющийся характерным
признаком МФБС. Выделяют активные триггерные точки, ассоциирующиеся со спонтанной болью, и латентные триггерные точки, при наличии которых спонтанная боль не возникает. Наиболее часто локальная боль описывается пациентами как интенсивная и острая, а отраженная – как глубокая и ноющая. Активным триггерным точкам нередко сопутствуют снижение силы в соответствующей мышце, повышенная ее утомляемость и ограничение объема движений.
В случаях, когда между двумя триггерными точками или между триггерной точкой и костной структурой располагается сосудисто-нервный пучок или нерв, создаются условия для нейроваскулярной компрессии.
Факторы, способствующие формированию МФБС:
• острое перерастяжение мышцы, наблюдаемое при выполнении “неподготовленного” движения;
• длительное неправильное положение тела (антифизиологические позы);
• воздействие высокой или, чаще, низкой температуры;
• врожденная асимметрия длины ног, тазового кольца, аномалии стопы;
• нарушения питания или обмена веществ;
• сопутствующие психологические расстройства (тревога, депрессия, нарушения сна).
Синдром Титце впервые описан Tietze в 1921 г. и является относительно редким состоянием, которое характеризуется наличием неспецифического доброкачественного обратимого болезненного отека в области II (в 60 % случаев) или III реберных хрящей. В 80 % случаев имеется одностороннее
поражение, ограничивающееся одним реберным хрящом. Боль обычно хорошо локализована, однако может иррадиировать по всей передней поверхности грудной стенке, а также в надплечье и шею. Покраснение, повышение температуры и другие изменения кожи над областью поражения отсутствуют. Боль обычно регрессирует спонтанно через 2–3 недели, однако нередко беспокоит в течение нескольких месяцев, а резидуальный отек может сохраняться до нескольких лет. Обычно заболевание развивается в молодом или детском возрасте. Причины его неизвестны, однако у большинства пациентов в анамнезе выявляются предшествующие эпизоды респираторных инфекций, сильного кашля, тяжелой физической нагрузки, а также недостаточное питание. Синдром Титце часто путают со значительно более распространенным реберно-грудинным синдромом (“синдром передней грудной стенки”, “костохондрит”, “реберно-грудинная хондродиния”), котоый является одной из наиболее частых причин болей в грудной клетке. В отличие от синдрома Титце при реберно-грудинном синдроме пальпация в 90 % случаев выявляет множественные зоны болезненности: в
левой парастернальной области, ниже левой молочной железы, в проекции грудных мышц и грудины. Локальный отек отсутствует. Наиболее часто поражаются хрящи II и V ребер. При поражении верхних реберных хрящей нередко отмечается иррадиация боли в область сердца. Боль обычно усиливается при движениях грудной клетки. Заболевание чаще встречается среди женщин после 40 лет, его патогенез остается неизвестным. С целью дифференциальной диагностики с коронарной недостаточностью кроме особенностей болей, которые обычно носят “атипичный” для ИБС характер, также применяются блокады межреберных нервов с введением местных анестетиков по задней подмышечной линии, приносящие пациентам выраженное облегчение.
Поражение грудино-ключичных уставов отмечается при деформирующем остеоартрозе, ревматоидном
артрите, анкилозирующем спондилите, псориатическом и инфекционных артритах. Боль при этих состояниях, как правило, локальная, однако в ряде случаев может проецироваться на переднюю поверхность грудной клетки и в таких случаях требует проведения дифференциального диагноза с заболеваниями легких и сердца. Боль усиливается при поднимании надплечий и пальпации грудино-ключичного сустава. В ряде случаев отмечаются отек и крепитация в проекции пораженного сустава.
Грудино-ключичный гиперостоз – относительно недавно описанное заболевание, проявляющееся двусторонним хроническим болезненным отеком ключиц, грудины и I ребра. Причина развития данного состояния неизвестна, обсуждается возможная связь с псориатическим артритом. Диагноз
основывается на выявлении характерных рентгенологических изменений – гиперостоза, утолщения и увеличения костной плотности ключиц и грудины, оссификации хрящевой части I ребра и формировании грудино-ключичного синостоза. Реже отмечается ускорение СОЭ и гипергаммаглобулинемия. Заболевание имеет рецидивирующее течение. Увеличение костных структур и распространение воспалительного процесса в отдельных случаях приводят к окклюзии подключичной вены или развитию синдрома верхней апертуры.
В основе лечения скелетно-мышечной боли лежит применение НПВС, миорелаксантов, блокад, а
также физиотерапия и реабилитация [31–33].
Психогенная боль
Болевой синдром в грудной клетке психогенного характера является одной из наиболее частых причин
обращения за медицинской помощью. К сожалению, до настоящего времени отсутствует единая систематика функциональных расстройств сердечно-сосудистой системы в отличие, например, от гастроэнтерологической практики, что препятствует выделению их дифференцированных вариантов в зависимости от преобладающих клинических проявлений, структуры фоновых психопатологических расстройств, показателей прогноза, а также потребности в психотропных лекарственных средствах и других лечебных воздействиях. Психогенные кардиалгии рассматриваются в рамках
кардионевроза, для описания которого в разное время использовались различные термины – “мышечное утомление сердца”, “синдром раздраженного сердца”, “синдром солдатского сердца”, “синдром DaCosta”, “синдром усилия”, “нейроциркуляторная/вегетососудистая астения/дистония”,
“конверсионное расстройство сердца”, “невроз сердца”, “тревожный невроз” и т. д. В диагностике психогенных кардиалгий целесообразно использовать критерии психогенной боли, предложенные в классификации DSM-IV (Diagnostic and Statistical Mental Disorders-4). В соответствии с данной классификацией выделяют два основных и три дополнительных критерия.
К основным критериям относятся:
1. Преобладание множественных и пролонгированных болей.
2. Отсутствие органической причины для боли или несоответствие жалоб выраженности органических нарушений при их наличии.
Дополнительные критерии включают:
1. Существование временной связи между психогенной проблемой и появлением или нарастанием выраженности боли.
2. Наличие боли позволяет избегать нежелательной деятельности пациенту.
3. Наличие боли предоставляет пациенту право получения определенной социальной поддержки, которая не может быть достигнута другим путем.
При расспросе пациента необходимо уяснить причины его обращения за медицинской помощью, которые могут быть следующими:
1. Новые факторы, которые привели к обострению заболевания (диетические изменения, конкурентные заболевания, побочные эффекты новых препаратов)
2. Изменение отношения к заболеванию (например, из-за недавней утраты).
3. Внешний стресс.
4. Психические изменения (депрессия, тревога).
5. Появившаяся неспособность выполнять обычную работу, усталость или проблемы отношений.
6. “Тайные намерения”, такие как зависимость от наркотических или слабительных препаратов, надвигающийся судебный процесс или необходимость удостоверения нетрудоспособности.
Среди отличительных особенностей психогенных кардиалгий – пролонгированный характер боли в отсутствие связи с физической нагрузкой, преимущественная проекция в области верхушки сердца. Однако в любом случае психогенные кардиалгии являются диагнозом исключения. Для позитивной диагностики данного вида боли в грудной клетке большое значение имеет выявление панических атак, тревожных и депрессивных расстройств, а также гипервентиляционного синдрома. Лечение заключается в медикаментозной коррекции психоэмоциональных нарушений и медико-социальной
реабилитации [34–35].
Таким образом, несмотря на достижения последних десятилетий в области патофизиологии, диагностики и лечения боли, проблема кардиалгии сохраняет свою актуальность с позиций экономической, медицинской и социальной значимости в современной медицине. Подход к пациентам с кардиалгией должен быть мультидисциплинарным, при этом все бóльшее значение приобретает то, на каком этапе оказания медицинской помощи (скорая, первичная медико-санитарная или специализированная медицинская помощь) происходит встреча пациента с врачом. Крайняя индивидуальность как восприятия боли в грудной клетке, так и ее описания, а также сопутствующие
заболевания делают упрощенный подход к дифференциальной диагностике кардиалгии малопригодным и отводят любым алгоритмам лишь вспомогательную роль, сохраняя приоритет клинического мышления и врачебной интуиции [2–4, 11].



