Основной задачей антиангинальной и антиишемической терапии больных со стабильным характером течения ишемической болезни сердца (ИБС) является устранение клинического симптома – стенокардии. Однако при анализе пациентов с ИБС необходимо иметь в виду, что классическая картина симптома стенокардии – боли за грудиной, возникающие при определенной физической нагрузке, иррадиирующие наиболее часто в левое плечо, лопатку, челюсть и проходящие при прекращении физической нагрузки или приеме нитроглицерина, наблюдаются далеко не у всех больных. К наиболее частым вариантам «эквивалентов» стенокардии относятся болевой синдром в местах наиболее частой иррадиации, появление «чувства нехватки воздуха», одышки. Кроме этого в клинической практике мы сталкиваемся еще с одной «западней». Чаще всего это касается пожилых больных, которые сознательно значительно ограничивают себя в физических нагрузках – «не выходят из дому», чтобы не провоцировать приступы стенокардии. Причем в данном случае проблема бывает обусловлена не критическим стенозирующим атеросклерозом коронарных артерий, а недостаточностью и неадекватностью антиангинальной терапии (ААТ). Поэтому, хотя формально такие пациенты не жалуются на ангинальные приступы, они имеют очень низкое качество жизни, которое вполне можно улучшать, расширив диапазон их физических нагрузок.
Современная концепция антиангинальной и антиишемической терапии сформулирована в Европейских рекомендациях по лечению больных ИБС стабильного течения [1]. Для купирования приступа стенокардии используются короткодействующие нитраты. Постоянная же терапии стенокардии предполагает применение двух линий лекарственных средств.
Первая линия препаратов, т.е. лекарственные средства, с назначения которых начинает формироваться ААТ, включает пульсурежающие лекарственные препараты: β-адреноблокаторы (БАБ) и недигидропиридиновые антагонисты (НДАК). Снижение частоты сердечных сокращений (ЧСС) как важнейший механизм уменьшения потребности миокарда в кислороде ни у кого не вызывает сомнений. Однако результаты исследований, закончившихся в последние годы, внесли коррективы в наше понимание необходимой степени урежения ЧСС. С учетом результатов исследования SYGNIFY мы можем сегодня утверждать, что ЧСС у больного ИБС стабильного течения в покое должна быть ниже 70 в минуту [2]. При этом вопрос, должны ли мы снижать ЧСС до 55–60 в минуту, остается предметом дискуссии. Создается впечатление, будто при выборе степени урежения ЧСС основным критерием должна быть клиническая целесообразность. Если ЧСС в покое составляет у больного 65 в минуту и у него нет приступов стенокардии, то, вероятно, добиваться более выраженного эффекта нет смысла. В то же время, если у пациента при подобной ЧСС сохраняются приступы, целесообразно продолжать титрование пульсурежающих препаратов и, возможно, применять их комбинацию. Однако в этом случае особое внимание стоит уделить безопасности терапии, используя в качестве контроля ЭКГ-мониторирование.
БАБ как средство терапии первой линии в лечении больных ИБС давно стали золотым стандартом ведения таких пациентов. Однако применение их возможно лишь в отсутствие противопоказаний (низкая ЧСС или нарушения проводимости, кардиогенный шок, бронхиальная астма, тяжелое заболевание периферических сосудов, декомпенсация сердечной недостаточности, вазоспастическая стенокардия). Для БАБ доказано 30%-ное снижение риска сердечно-сосудистой смерти и инфаркта миокарда (ИМ) у пациентов, перенесших инфаркт [3]. Что касается контроля стенокардии, то эффекты БАБ и НДАК сопоставимы. К БАБ, рекомендованных к применению больными ИБС, относятся кардиоселективные метопролол, бисопролол, атенолол или небиволол, а также неселективный карведилол [4]. Комбинация БАБ с верапамилом или дилтиаземом противопоказана в связи с риском развития брадикардии или AV-блокады. Поэтому единственная возможная комбинация пульсурежающих препаратов – это БАБ+ивабрадин, т.к. сочетать НДАК с ивабрадином также не рекомендуется.
Дигидропиридиновые АК (ДАК) применяются в качестве препаратов первой линии больными ИБС, если у них имеется либо исходная склонность к брадикардии, либо наличие непереносимости БАБ и НДАК или противопоказаний к их назначению.
В качестве возможного лечебного подхода может обсуждаться сочетание БАБ и ДАК.
Вторая линия антиангинальных препаратов включает длительно действующие нитраты, ивабрадин, никорандил и раналазин (класс доказательности IIa), а также триметазидин (класс доказательности IIb; см. рисунок).
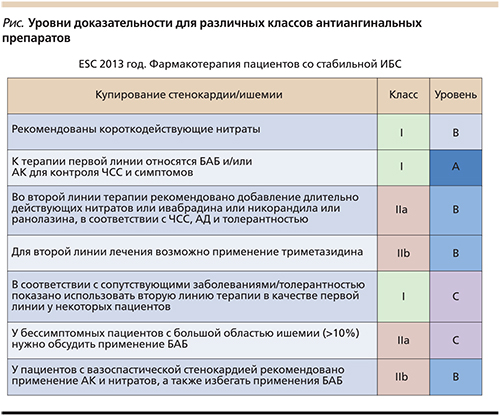
Использование пролонгированных нитратов может быть приемлемым для контроля приступов стенокардии в качестве терапии второй линии. Однако в настоящее время появилось много свидетельств того, что развитие толерантности является не единственной проблемой при их применении. Так, показано, что длительный прием нитратов приводит к образованию свободных радикалов, следствием чего становятся прогрессирование дисфункции эндотелия, изменение баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы в регуляции ЧСС, повышение чувствительности сосудистой стенки к сосудосуживающим веществам [5–7]. Вероятно, все вышеперечисленное может создавать определенные ограничения в отношении частоты и длительности назначения этого класса препаратов.
Уже упомянутый выше ингибитор if-каналов синусового узла ивабрадин обеспечивает селективное ингибирование ионного тока в указанных каналах без какого-либо влияния на инотропную функцию сердца. Ивабрадин может использоваться больными, страдающими стабильной стенокардией, при ЧСС≥70 в минуту в качестве ААТ второй линии при непереносимости БАБ (или противопоказаниях к их применению). Однако в клинической практике чаще всего используется комбинация ивабрадина с оптимальными дозами БАБ. Именно в подобной комбинации была доказана его антиангинальная и антиишемическая эффективность в исследованиях BEUTIFUL, ASSOCIATE, SYGNIFY [8, 9]. Начальная доза ивабрадина составляет 5 мг 2 раза в сутки с последующим увеличением (через 2 недели) до 7,5 мг 2 раза в сутки.
Активатор калиевых каналов никорандил служит препаратом с двойным антиангинальным механизмом действия (активация АТФ-зависимых калиевых каналов и органических нитратов). Он расширяет коронарные артериолы и вены, воспроизводит защитный эффект ишемического прекондиционирования, а также уменьшает агрегацию тромбоцитов. При этом никорандил в отличие от нитратов не вызывает развития толерантности, не влияет на уровень артериального давления (АД), ЧСС, проводимость и сократимость миокарда. Для никорандила возможно применение как для купирования приступа стенокардии (20 мг под язык, эффект в течение 5 минут), так и для профилактики приступов стенокардии (10–20 мг 3 раза в сутки). В проспективном исследовании IONA (5126 больных стабильной стенокардией, в т. ч. 66% с перенесенным ИМ) было показано, что добавление никорандила к стандартной терапии снижало частоту коронарных событий (смерть от ИБС, нефатальный ИМ, внеплановая госпитализация из-за болей в груди) на 17% (р=0,014), риск развития острого коронарного синдрома – на 21% (р=0,028), а всех сердечно-сосудистых событий – на 15% (р=0,021) [10].
Недавно в арсенале препаратов второй линии ААТ появилось новое лекарственное средство – раналазин. Этот препарат является ингибитором позднего тока ионов натрия в клетки миокарда. Снижение внутриклеточного накопления натрия ведет к уменьшению избытка внутриклеточных ионов кальция. Это в свою очередь способствует расслаблению миокарда и таким образом снижает диастолическое напряжение стенки желудочков, улучшая коронарный кровоток, а также оказывает антиаритмическое действие. Хотя в Европе и России раналазин появился не так давно, он на протяжении многих лет исследовался в США и имеет хорошую доказательную базу в отношении антиангинальной и антиишемической эффективности (MARISA, CARISA, ERICA, ROLE, MERLIN-TIMI 36) [11–15]. Терапия ранолазином не влияет на основные параметры гемодинамики (ЧСС, АД), а при вторичном анализе результатов исследования MERLIN-TIMI 36 было показано значимое снижение количества эпизодов желудочковой тахикардии у больных, принимавших этот препарат. Начальная доза ранолазина составляет 500 мг 2 раза в день, максимальная рекомендованная в России доза – 1000 мг 2 раза в день.
Метаболический миокардиальный цитопротектор триметазидин (пролонгированного высвобождения) ингибирует 3-кетоацил-КоА-тиолазу в митохондриях, что приводит к переключению основного пути образования энергии в клетках миокарда с β-окисления жирных кислот на более эффективное аэробное окисление глюкозы. В исследованиях было показано, что триметазидин способен устранять ишемию миокарда на ранних стадиях развития и тем самым предотвращать возникновение ее более поздних проявлений – стенокардии и снижения сократительной способности миокарда [16–18]. Триметазидин (35 мг 2 раза в сутки) назначается в качестве препарата второй линии контроля стенокардии. В качестве оптимальной рассматривается комбинация триметазидина с БАБ. При этом выраженность положительного эффекта триметазидина возрастает по мере увеличения продолжительности лечения. Имеются данные о положительном влиянии триметазидина пролонгированного высвобождения после перенесенного ИМ на риск смертности, развития сердечно-сосудистых событий (в т.ч. повторного ИМ, реваскуляризации и внеплановой госпитализации) и качество жизни.
В заключение необходимо упомянуть, что если у больного имеются какие-то противопоказания к назначению препаратов первой линии ААТ или их непереносимость, терапия может начинаться с применения лекарственных средств второй линии.
Также при выборе оптимальной ААТ следует помнить, что потребность миокарда в кислороде определяет двойное произведение ЧСС×АД. Поэтому, с одной стороны, наличие сопутствующей артериальной гипертензии требует коррекции уровня АД, с другой – обязательном компонентом ААТ должно быть адекватное снижение ЧСС. В настоящее время хорошо изучены и широко применяются комбинации антиангинальных препаратов. Оптимальными для достижения оптимального урежения ЧСС служат следующие сочетания: БАБ+ивабрадин, БАБ+ранолазин и БАБ+триметазидин. Адекватной заменой нитратов может стать никорандил. Комбинированная терапия больного ИБС при необходимости может дополняться препаратами, не влияющими на показатели гемодинамики, такими как раналазин и триметазидин. Причем комбинирование препаратов второй линии практически не имеет противопоказаний и запрета сочетаний. Однако включение каждого следующего препарата должно проводиться после оценки эффективности уже назначенной терапии и здесь применим принцип «разумного минимализма». Имея в своем арсенале столь разные по механизму действия классы антиангинальных препаратов, используя их рациональные комбинации, врач может значительно повышать толерантность пациентов к физическим нагрузкам, качество их жизни, а значит, вернуть больных к активной семейной и социальной жизни.



