Ишемическая болезнь сердца (ИБС) в течение многих десятилетий ХХ и начала XXI столетий занимает ведущее место в структуре летальности среди населения в ведущих экономически развитых странах. Смертность от болезней системы кровообращения в Российской Федерации, по данным медицинской статистики за 2010 г., составила 56,5 % от общей летальности; из них более половины приходится на ИБС как причины летального исхода. Частота встречаемости ИБС резко увеличивается с возрастом населения: в большинстве европейских стран распространенность ИБС составляет 20–40 тыс. на 1 млн населения. По данным ГНИЦ ПМ, в РФ около «…10 млн трудоспособного населения страдают ИБС, более трети из них имеют стабильную стенокардию». Все вышеперечисленное определяет актуальность дальнейшего изучения патофизиологических механизмов развития и лечения сосудистой патологии, лежащей в основе ишемических синдромов.
Современная кардиология – наука, занимающаяся фундаментальными исследованиями механизмов функционирования сердца как насоса в обеспечении органной перфузии в норме и патологии. Она использует в своем развитии достижения молекулярной кинетики биологических процессов на уровне клеточных и субклеточных структур, в частности, позволяющих моделировать в нашем сознании процессы сопряжения возбуждения–сокращения–расслабления миокарда и энергетику, их обеспечивающую.
В настоящее время невозможно решать практические вопросы: определение рациональных путей профилактики и методов эффективного лечения ишемических эпизодов, лежащих в основе патогенеза сердечно-сосудистых заболеваний (ССЗ), без четкого представления механизмов внутриклеточных энергетических процессов, обеспечивающих жизнедеятельность сократительных элементов сердца и сосудов.
Сердце млекопитающих, в т. ч. человека, – это не только насос, совершающий огромную механическую работу по перекачиванию крови адекватно метаболическим нуждам организма. Одновременно оно – «биологический реактор», в котором происходят «сгорание» энергетических субстратов в присутствии кислорода (окислительное фосфорилирование), трансформация выделяющейся энергии в высокоэнергоемкую химическую связь конечной фосфатной группы в молекуле аденозин трифосфата (АТФ). За сутки в сердце 40-летнего мужчины, имеющего массу тела 80 кг, образуется и используется более 30 кг АТФ. Адекватность процессов синтеза АТФ обеспечивается сопряженностью нескольких этапов: непрерывное поступление в клетки энергетических субстратов, бесперебойная доставка кислорода, эффективная «работа фабрики АТФ» (митохондрий через окислительное фосфорилирование) и транспортировка энергии криатинфосфатом к исполнительным внутриклеточным структурам (ионные насосы, рецепторы, сократительные элементы).
 ИБС – результат несоответствия уровня потребления миокардом кислорода (основной компонент окислительного фосфорилирования углеводов, жиров, белков для образования АТФ) и объема его доставки коронарным кровотоком. Для энергообеспечения своей насосной деятельности от состояния покоя до максимальной нагрузки сердце утилизируeт различные субстраты: жирные кислоты, углеводы (глюкоза, гликоген, лактат), белки. В норме большая часть энергии АТФ миокард получает за счет β-окисления жирных кислот (ЖК) в митохондриях кардиомиоцитов.
ИБС – результат несоответствия уровня потребления миокардом кислорода (основной компонент окислительного фосфорилирования углеводов, жиров, белков для образования АТФ) и объема его доставки коронарным кровотоком. Для энергообеспечения своей насосной деятельности от состояния покоя до максимальной нагрузки сердце утилизируeт различные субстраты: жирные кислоты, углеводы (глюкоза, гликоген, лактат), белки. В норме большая часть энергии АТФ миокард получает за счет β-окисления жирных кислот (ЖК) в митохондриях кардиомиоцитов.
В физиологических условиях 10 % АТФ образуется при окислительном фосфорилировании в митохондриях за счет аэробного гликолиза (расщепление глюкозы и лактата до пирувата). Этого количества АТФ, образующегося в результате аэробного гликолиза, не хватает для обеспечения работы ионных кальциевых, натриевых и калиевых каналов сарколеммы, в частности кальциевого насоса саркоплазматического ретикулума. Восполнение остального количества энергии для функционирования кардиомиоцита при нормальной доставке кислорода происходит за счет окисления свободных жирных кислот (СЖК), метаболизм которых при окислительном фосфорилировании обеспечивает созидание до 80 % АТФ. Однако СЖК по сравнению с глюкозой – менее эффективный источник АТФ-«топлива» для сердца, т. к. при их окислении на выработку одного и того же количества АТФ требуется примерно на 10–12 % больше кислорода.
В условиях ишемии (снижение доставки О2) процесс образования АТФ нарушается с накоплением в митохондриях недоокисленных продуктов – ацилкарнитина, ацетилкоэнзима А (ацетил-КоА). Выраженный дисбаланс между потребностью кислорода при окислении глюкозы и СЖК в сторону последних приводит к тому, что при ишемии (резкое падение доставки кислорода) в митохондриях кардиомиоцитов накапливается множество недоокисленных активных форм ЖК, что еще больше усугубляет разобщение окислительного фосфорилирования. Недоокисленные активные формы ЖК, в частности ацилкарнитин, ацетил-КоА, как метаболиты блокируют транспорт АТФ от места синтеза в митохондриях к месту их потребления внутри клетки. Кроме того, повышенная концентрация этих двух метаболитов в митохондриях оказывает разрушительное действие на мембрану последней, что еще больше ведет к дефициту энергии, необходимой для жизнедеятельности кардиомиоцита. Параллельно в клетке на фоне анаэробного обмена происходит накопление избыточного количества протонов (Na+, Н+), т. е. происходит ее «закисление». Далее Na+, Н+ обмениваются на другие катионы (преимущественно на Са++), следствием чего является перегрузка миоцитов Са++, участвующего в формировании «контрактуры» миокарда – незавершенной диастолы, которая, предшествуя систоле, формирует малое по амплитуде сокращение кардиомиоцита.
Хроническая сердечная недостаточность (ХСН) как следствие сердечно-сосудистых заболеваний (артериальная гипертензия, ИБС) – это неспособность сердца перекачивать объемы крови, адекватные метаболическим нуждам организма, – широко распространенное заболевание сердечно-сосудистой системы с неблагоприятным течением и прогнозом. ХСН, как это ни парадоксально звучит, в большинстве случаев является следствием успешного лечения других сердечно-сосудистых заболеваний: ИБС, АГ, миокардитов, миокардиопатий и т. д. По данным многочисленных исследований, распространенность ХСН в странах Северной Америки и Европы колеблется от 2,0 до 3,5 % среди взрослого населения. В России, по данным эпидемиологического исследования ЭПОХА-ХСН, включившего 17 тыс. больных ХСН, частота встречаемости этой патологии составляет 5,5 % среди социально значимой популяции населения. В 70 % случаев причиной ХСН остается ИБС [1, 5–7].
В настоящее время в патогенезе ХСН ведущая роль отводится гиперактивации нейрогормональных систем (симпатико-адреналовая, ренин-ангиотензин-альдостероновая), блокада и ингибирование активности которых оказались настолько клинически эффективными, что препараты группы иАПФ и бета-адреноблокаторов стали стандартом лечения больных ХСН. Однако современные исследования показали, что при ХСН в условиях хронической тканевой гипоксии помимо нейрогуморальных расстройств существуют и другие адаптационно-дезадаптационные процессы, оказывающие существенное влияние на кардиомиоциты и миокард в целом, тем самым способствуя изменениям структуры и функции сердца как насоса и прогрессированию заболевания [10, 14].
В 1990-е гг. возник интерес к препаратам, способным поддерживать энергетику миокарда на уровне, обеспечивающем насосную деятельность сердца. Начиная с 1961 г. в клинической практике врачи начали использовать цитопротекторы – лекарственные препараты с эффектом парциального ингибирования β-окисления жирных кислот. Подобные ингибиторы внутрикле-точного метаболизма, способные замедлять скорость β-окисления жирных кислот в митохондриях, ограничивают транспорт ЖК через клеточные мембраны и минимизируют метаболический ацидоз, развившийся в результате активации анаэробного гликолиза и накопления молочной кислоты. В частности, к такой группе лекарственных средств относится триметазидин. Многочисленные исследования эффективности медицинской реабилитации пациентов ИБС и ХСН показали, что комбинация триметазидина с дозированными физическими нагрузками способствует более эффективному восстановлению насосной деятельности сердца, улучшению качества и прогноза жизни. В связи с чем триметазидин был рекомендован Европейским обществом кардиологов (ЕОК) в 1997 г. в качестве препарата для метаболической терапии при стабильной стенокардии напряжения, эти рекомендации ЕОК и в 2006 г. подтверждены для лечения ХСН [1–7, 9].
В настоящее время на ряду с одним из наиболее широко используемых при лечении ишемических синдромов аналогов триметазидина – Тримекталом МВ, в клиническую практику активно внедрены парциальные ингибиторы β-окисления жирных кислот – Милдронат, Кардионат (мельдоний – триметилгидразиний пропионата дигидрат). Механизмы действия триметазидина и Милдроната практически идентичны – они переключают внутриклеточный метаболизм β-окисления жирных кислот в митохондриях на более экономный аэробный гликолиз, через блокаду γ-бутиробетаингидроксилазы (фермент превращающий γ-бутиробетаин в карнитин) [4, 7, 8, 12, 16].
Лечение ИБС включает модификацию образа жизни с использованием комплекса лекарственных препаратов с антиангинальной эффективностью, которые дополняются препаратами с метаболической направленностью, например триметазидином. Препарат обладает цитопротекторным действием, направленным непосредственно на ишемизированные кардиомиоциты, чем и объясняется его высокая эффективность в лечении ИБС. Нитраты, β-блокаторы и антагонисты кальция оказывают антиангинальное действие через изменение гемодинамических параметров (уменьшение силы и частоты сердечных сокращений, увеличение коронарного кровотока, снижение пред- и постнагрузки) Возможностей этих препаратов нередко оказывается недостаточно для предупреждения ишемических эпизодов и их исходов. В ряде контролируемых исследований показано, что триметазидин как в монотерапии, так и в комбинации с любым классом антиангинальных средств не только уменьшает количество приступов стенокардии и потребность в приеме нитроглицерина, но и достоверно увеличивает продолжительность физической нагрузки на тредмиле и велоэргометре, время до появления депрессии сегмента ST на ЭКГ [1, 11, 13, 16].
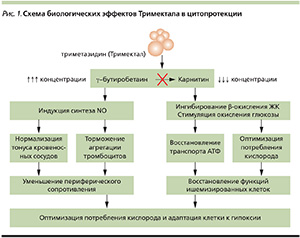
 Механизм действия триметазидина обусловлен ингибированием β-окисления СЖК. Под действием триметазидина в условиях дефицита кислорода восстанавливается сопряжение гликолиза и окислительного декарбоксилирования, уменьшается внутриклеточный ацидоз, увеличивается количество пирувата, трансформирующегося в ацетил-КоА, что в конечном итоге приводит к возрастанию продукции АТФ (рис. 1).
Механизм действия триметазидина обусловлен ингибированием β-окисления СЖК. Под действием триметазидина в условиях дефицита кислорода восстанавливается сопряжение гликолиза и окислительного декарбоксилирования, уменьшается внутриклеточный ацидоз, увеличивается количество пирувата, трансформирующегося в ацетил-КоА, что в конечном итоге приводит к возрастанию продукции АТФ (рис. 1).
Триметазидин путем селективного ингибирования митохондриальной 3-кетоацилКоА-тиолазы и, возможно, карнитин-пальмитол-трансферазы-1 уменьшает окисление ЖК и стимулирует использование глюкозы. При окислении глюкозы в митохондриях продуцируется больше, чем при использовании ЖК, энергетических субстратов в расчете на 1 моль кислорода. Следовательно, триметазидин способствуя синтезу большего количества молекул АТФ на одну потребляемую молекулу кислорода, улучшает баланс между потребностью миокарда в кислороде и его поступлением. Устранение дефицита внутриклеточного уровня АТФ, возникающего в условиях ишемии миокарда, составляет основу антиишемического кардиопротективного действия препарата. Кроме того, триметазидин активно участвует в утилизации сохраняющихся ЖК, стимулируя обмен фосфолипидов в сарколемме. Следствием этого является уменьшение содержания СЖК и создание благоприятных условий для восстановления структурной целостности клеточных мембран. Важным следствием действия триметазидина является устранение ацидоза и высокой концентрации внутриклеточного кальция, что способствует устранению «контрактуры» кардиомиоцитов, наблюдающейся при стенокардии и сердечной недостаточности. Протективное действие триметазидина в отношении кардиомиоцитов и эндотелиальных клеток выражается в устранении механической (сократительной) и эндотелиальной дисфункций, которые имеют место при ишемии и сердечной недостаточности, тем самым обеспечивая защиту миокарда от некроза и апоптоза [2, 8, 11, 13, 16].
В экспериментальных исследованиях также показано антиоксидантное действие триметазидина через ингибирование перекисного окисления липидов, уменьшение повреждения мембраны – сакролеммы, вызываемое свободными радикалами, с ограничением накопления неорганического фосфата, Na+ и Са++ внутри клетки с сохранением нормальной концентрации К+. Одновременно триметазидин понижает уровень миграции и инфильтрации полинуклеарных нейтрофилов (ингибиция хемотаксиса) в ишемизированных и реперфузируемых тканях сердца, что уменьшает аутоиммунное повреждение миокарда. Триметазидин, не оказывая влияния на центральную гемодинамику, в отличие от традиционных антиангинальных препаратов не создает риска артериальной гипотензии, брадикардии, нарушений проводимости, что может способствовать усугублению сердечной недостаточности [2, 8, 9, 13].
Клиническая эффективность триметазидина при стабильной стенокардии подтверждена исследованиями в России и Европе [1, 6, 7, 12, 13].
В клинических исследованиях было показано, что у пациентов с ИБС триметазидин увеличивает коронарный резерв начиная с 15-го дня терапии. Восстановление коронарного резерва способствует предупреждению последствий ишемии, вызванной физической или эмоциональной нагрузкой: снижает частоту приступов стенокардии, существенно улучшает сократительную функцию миокарда у больных с ишемической дисфункцией, повышает толерантность к физической нагрузке, ограничивает резкие колебания АД (опосредованно через ЦНС и изменение реологических свойств крови) без видимых нарушений сердечного ритма. Применение препарата достоверно приводило к снижению частоты приступов стенокардии, увеличению времени нагрузки до достижения депрессии сегмента ST на 1 мм, общее время работы, продолжительность пиковой нагрузки как при монотерапии, так и в комбинации с другими антиангинальными средствами [2–4, 7, 11, 12].
В ряде работ доказано – триметазидин улучшает сократимость миокарда, находящегося в стадии гибернации или оглушения, за счет улучшения диастолы. Одновременно показано: физические тренировки обладают способностью улучшать эндотелиальную дилатационную реакцию коронарных артерий и вызывать рост малых сосудов (формирование коллатералей), способствуя увеличению коллатерального кровотока по коронарным артериям, что суммарно клинически проявляется в виде уменьшения приступов стенокардии [2, 4, 10, 13, 16].
Антиоксидантное действие триметазидина в клинике было проверено в исследовании EMIP-FR (European Myocardial Infarction Project – Free Radicals) в ранние сроки острого инфаркта миокарда без и с проведением артифициального тромболизиса с целью выявления профилактического действия на «синдром реперфузии». При анализе полученных данных по подгруппам выявлено достоверное благоприятное действие триметазидина в профилактике «синдрома реперфузии» (уменьшение распространения зоны инфаркта, снижение частоты фатальных аритмий, купирование сердечной недостаточности) [2, 4, 10, 13].
В недавно законченной работе показана положительная роль триметазидина в предотвращении выхода МВ-фракции креатинфосфокиназы и Т-тропонина при проведении аортокоронарного шунтирования больным с III–IV ФК стенокардии напряжения, с одновременным восстановлением локальной функции миокарда с увеличением сегментарной и общей фракции выброса на 17,3 % [1, 2, 4, 10].
Триметазидин обладает антитромбоцитарным действием: ингибирует агрегацию и адгезивную активность тромбоцитов, препятствует росту внутрикоронарного тромбоцитарного тромба, при этом не действует на факторы внутренних и наружных каскадов системы коагуляции, что выгодно отличает его от аспирина. Триметазидин ингибирует вход кальция в тромбоциты и подавляет высвобождение серотонина из тромбоцитов, частично принимает участие в ингибировании образования из каскада арахидоновой кислоты тромбоксана (мощного вазоконстриктора), изменяет текучесть мембраны эритроцитов и тромбоцитов. Улучшение реологических свойств крови за счет подвижности эритроцитов и тромбоцитов способствует нормализации микроциркуляции, более эффективной доставке и экстракции О2 в сердечной мышце [3, 11–13].
В клинических исследованиях также представлены данные о том, что у пациентов с ишемической кардиомиопатией триметазидин улучшает функциональный потенциал сердца как насоса за счет увеличения сократительной способности миокарда в ответ на введение добутамина. Одновременно показано, что применение триметазидина в течение суток на фоне стандартной медикаментозной терапии в течение 2 месяцев улучшало пиковое потребление миокардом О2 на 18 % и, соответственно, фракцию выброса левого желудочка на 16 % [1, 2, 4, 10].
По данным ряда исследований, оптимизируя метаболизм кардиомиоцитов, триметазидин не только обладает антиангинальным действием, но и способствует сохранению жизнеспособности и функциональной активности хронически ишемизированного миокарда. Продемонстрировано положительное влияние триметазидина при нарушении локальной сократимости миокарда по данным стресс-эхокардиографии с добутамином. Результаты эхокардиографического исследования (на основании оценки увеличения индекса подвижности стенок левого желудочка) свидетельствуют, что в отличие от плацебо триметазидин достоверно уменьшал ишемию миокарда во время фармакологической пробы. Более того, на фоне приема препарата значительно увеличивались время инфузии (р < 0,019) и доза добутамина (р < 0,003). Это позволило предположить, что триметазидин защищает миокард от повреждений во время ишемии и при физических перегрузках [3, 4, 11–13].
В другом плацебо-контролируемом исследовании изучено влияние триметазидина на сократительную функцию миокарда 38 больных с постинфарктной дисфункцией левого желудочка (ЛЖ) (фракция выброса ЛЖ в среднем 33 %), рандомизированных на прием триметазидина или плацебо. Перед началом и через 2 месяца лечения всем пациентам проводили стресс-эхокардиографию с введением малой дозы добутамина и нагрузочный тест. Среди пациентов, получавших триметазидин, наблюдалось значительное снижение индекса нарушения сегментарной сократимости в покое и при нагрузке (р < 0,001), увеличение фракции выброса (р < 0,001) без изменения ЧСС и АД [16].
P. Vitale и соавт. показали, что добавление триметазидина к традиционной терапии улучшает систолическую и диастолическую функции ЛЖ, а также повышает качество жизни пожилых пациентов, страдающих ишемической кардиомиопатией [9, 11–13].
В российских исследованиях ПРЕМЬЕРА и ТРИУМФ, включивших 846 пациентов со стабильной стенокардией напряжения, недостаточно контролируемой антиангинальными препаратами гемодинамического действия, 3-месячная терапия триметазидином 70 мг/сут достоверно улучшала оценку качества жизни пациентами. Эти данные подтверждают, что триметазидин может быть назначен на любом этапе терапии стабильной стенокардии для усиления антиангинальной эффективности β-адреноблокаторов, антагонистов кальция и нитратов [1, 2, 5–7, 9].
В настоящее время на отечественном фармацевтическом рынке зарегистрирован Тримектал МВ (активное вещество – триметазидин, Вертекс) – антигипоксический препарат с метаболическим цитопротективным действием, который назначают по 1 таблетке (35 мг) 2 раза в сутки во время приема пищи утром и вечером. Продолжительность терапии устанавливается индивидуально. Препарат легко проникает через клеточные мембраны, т. к. находится в неионизированном состоянии при физиологических значениях рН. Биодоступность – 90 %, после приема внутрь он практически полностью абсорбируется из желудочно-кишечного тракта, легко проникает через гистогематические барьеры, связь с белками плазмы крови – 16 %, период полувыведения – около 6 часов, выводится почками (около 60 % в неизмененном виде). Непосредственно влияя на кардиомиоциты и нейроны головного мозга, Тримектал оптимизирует их метаболизм и функцию. Цитопротекторный эффект обусловлен повышением энергетического потенциала, активацией окислительного декарбоксилирования и рационализацией потребления кислорода (за счет усиления аэробного гликолиза и блокады окисления ЖК). Поддерживает сократимость миокарда, предотвращает снижение внутриклеточного содержания АТФ и фосфокреатина. В условиях ацидоза нормализует функционирование мембранных ионных каналов, препятствует накоплению кальция и натрия в кардиомиоцитах, нормализует внутриклеточное содержание ионов калия. Уменьшает внутриклеточный ацидоз и повышенное содержание фосфатов, обусловленные ишемией миокарда и реперфузией. Препятствует повреждающему действию свободных радикалов, сохраняет целостность клеточных мембран, предотвращает активацию нейтрофилов в зоне ишемии, увеличивает продолжительность электрического потенциала, уменьшает выход креатинфосфокиназы из клеток и выраженность ишемических повреждений миокарда. Улучшает слух и результаты вестибулярных проб у пациентов с патологией лор-органов, уменьшает головокружение и шум в ушах. При сосудистой патологии глаз восстанавливает функциональную активность сетчатки.
Показания к применению Тримектала МВ: ИБС – профилактика приступов стенокардии (в составе комплексной терапии); кохлеовестибулярные нарушения ишемической природы, такие как головокружение, шум в ушах, нарушение слуха; хориоретинальные сосудистые нарушения с ишемическими компонентами.
Тримектал при стенокардии сокращает частоту приступов, через 2 недели лечения повышается толерантность к физической нагрузке, снижаются перепады артериального давления, сокращается частота приступов стенокардии, уменьшается потребность в приеме нитратов.
В нашем исследовании в группе больных стабильной стенокардией III ФК (49 пациентов) в результате применения Тримектала МВ 70 мг в сутки в течение 2 недель отмечено увеличение времени нагрузки на 33 с (р < 0,01), времени нагрузки до появления депрессии сегмента ST на 1 мм от изолинии на 51 с (р < 0,001), времени нагрузки до развития болевого приступа на 67 с (р < 0,001) и общей выполненной работы на 330 кГм (р < 0,001), при этом параметры нагрузочных тестов статистически не различались (рис. 2) Результаты многочисленных клинических исследований подтверждают, что триметазидин (Тримектал МВ), улучшая внутриклеточный энергетический метаболизм, снижает тяжесть и длительность периодов ишемии, повышает сократимость «спящего» миокарда, улучшает систолическую и диастолическую функции ЛЖ, способствует профилактике «синдрома реперфузии» у больных с острым коронарным синдромом. Препарат способен усиливать лечебное действие традиционных антиангинальных препаратов, не влияя на параметры гемодинамики. Эти данные позволяют назначать Тримектал МВ в комбинации с препаратами с гемодинамическим механизмом действия при недостаточной эффективности последних, плохой переносимости, включая пациентов старших возрастных групп с ишемической кардиомиопатией и сердечной недостаточностью, страдающих сахарным диабетом.
Следует особо выделить, что назначение препаратов с метаболической цитопротекцией триметазидинового ряда, в частности Тримектала МВ, в качестве лечения ХСН оправданно с патофизиологической точки зрения. Поскольку именно метаболические изменения лежат в основе прогрессирования ХСН, которые можно зарегистрировать с помощью различных лабораторных (маркеры некроза миокарда) и инструментальных (ЭКГ, ЭхоКГ, радиоизотопное сканирование и др.) методов.



