Ежегодно частота кесарева сечения (КС) увеличивается во всех странах, достигая в некоторых регионах мира 40,5% [1, 2]. В России этот показатель составляет 30,3% [3].
В связи с увеличением частоты КС получила широкое распространение новая проблема – формирование дефекта рубца на матке (ДРМ) после КС. В большинстве своем дефекты рубца не вызывают клинических проявлений и являются случайной находкой при ультразвуковом исследовании (УЗИ), однако в ряде случаев они могут быть причиной нарушений менструального цикла (НМЦ) и болевого синдрома, снижающих качество жизни пациенток, а также осложнений во время последующей беременности и в родах [4]. В связи с этим в настоящее время отмечается повышенный интерес как к изучению факторов риска формирования ДРМ, так и к возможности их коррекции.
Консервативное лечение применяется только у пациенток, которые не заинтересованы в планировании беременности. Заинтересованным в беременности пациенткам со значительными ДРМ рекомендовано хирургическое лечение.
Наиболее распространенным хирургическим методом лечения при значительных ДРМ является метропластика, основными этапами которой являются иссечение истонченной фиброзной ткани в области ДРМ, наложение de novo швов на матку и перитонизация за счет брюшины пузырно-маточной складки.
Однако независимо от доступа частота неудовлетворительных результатов метропластики даже у высококвалифицированных хирургов составляет по данным литературы около 10% [5–8]. В связи с этим продолжается поиск новых методов хирургического лечения женщин с ДРМ после КС, позволяющий сократить процент неудовлетворительных исходов.
Целью нашей работы стало повышение эффективности хирургического лечения пациенток со значительным ДРМ после КС.
Материалы и методы
Это проспективное обсервационное сравнительное исследование проводилось на базе ФГБУ НМИЦ АГиП им. В.И. Кулакова Минздрава России. В исследование были включены 113 пациенток со значительным ДРМ после КС в нижнем маточном сегменте (минимальная толщина рубца (мТР) < 2,5 мм по данным эхогистеросальпингографии (ЭхоГСГ) или мТР <3 мм по данным магнитно-резонансной томографии (МРТ) [9, 10]), заинтересованных в повторной беременности; при этом после последнего КС прошло более 1 года.
Критериями включения являлись: возраст пациенток – от 18 до 45 лет; планирование беременности; ДРМ после операции КС в нижнем маточном сегменте; расположение рубца в проекции внутреннего зева или в нижней трети тела матки по данным гистероскопии; подписанное информированное согласие на участие в исследовании.
Критериями исключения являлись: возраст до 18 лет и старше 45 лет; острые воспалительные заболевания органов малого таза; тяжелые сопутствующие соматические заболевания; злокачественные новообразования; расположение рубца в области шейки матки (ниже внутреннего зева) по данным гистероскопии.
Все пациентки до включения в исследование были обследованы в соответствии с принятым в отделении алгоритмом обследования, им были выполнены экспертное УЗИ (эУЗИ) и ЭхоГСГ или МРТ, и подтвержден ДРМ (мТР<2,5 мм по данным ЭхоГСГ или мТР<3 мм по данным МРТ), что требовало проведения хирургической коррекции [9, 10].
На первом этапе в предоперационном периоде всем 113 пациенткам была проведена оценка клинико-анамнестических данных, признаков недифференцированной дисплазии соединительной ткани (нДСТ), расчет диагностического коэффициента нДСТ (ДК нДСТ) [11] и оценка состояния рубца по данным эУЗИ, ЭхоГСГ или МРТ [9, 10].
На втором этапе всем 113 пациенткам была выполнена метропластика: 1-я группа – 61 пациентка, которым была выполнена метропластика лапароскопическим доступом по стандартной методике; 2-я группа – 52 пациентки, которым была выполнена метропластика лапароскопическим доступом с дополнительным этапом – укорочением и пликацией круглых связок матки.
Техника операции
Операция проводилась в условиях эндотрахеального наркоза. Первоначально выполнялась жидкостная гистероскопия, во время которой проводилось исследование состояния полости матки и ревизия зоны рубца. Использовался жесткий гистероскоп фирмы Karl Storz с наружным диаметром 5 мм. Расширение цервикального канала не требовалось. В качестве среды для расширения полости матки использовался стерильный 0,9% раствор хлорида натрия. Сначала проводился осмотр полости матки, определялась ее форма, наличие патологических образований, состояние устьев маточных труб, тщательно оценивалась зона рубца: локализация дефекта относительно внутреннего зева; наличие ниши и ее размеры (поперечный, продольный, глубина); ответвления и карманы; форма краев ниши (сглаженный или подрытый) и ее дно (наличие расширенных сосудов, очагов эндометриоза, кист эндоцервикса). После гистероскопии расширителями Гегара производили расширение цервикального канала до 10 мм, расширитель №10 не извлекали, используя его далее в качестве манипулятора.
Далее выполнялась лапароскопия, ревизия органов малого таза и брюшной полости. Оценивалось положение, контуры, размеры матки; состояние придатков матки, наличие спаечного процесса в зоне рубца на матке после КС.
Метропластика состояла из нескольких основных этапов:
- I этап – разделение спаек острым и тупым путем (при наличии спаечного процесса) (рис. 1а).
- II этап – вскрытие пузырно-маточной складки и низведение мочевого пузыря до средней трети шейки матки или ниже (на 10–15 мм отступая от нижнего края дефекта), выделение зоны рубца (рис. 1б–в).
- III этап – иссечение истонченного миометрия и фиброзной ткани в области рубца с помощью монополярного крючка в режиме резки (мощность не более 80 Вт, что обеспечивает низкое коагулирующее воздействие на ткани). Для лучшей визуализации краев дефекта, маточный манипулятор частично извлекали из полости матки, оставляя верхний полюс на уровне иссеченного рубца, и отклоняли его вперед или назад, открывая доступ к верхнему и нижнему краям разреза (рис. 1г–д). Иссечение истонченного рубца в нижней части (ближе к шейке матки) производили под углом около 60 градусов к продольной оси матки, в верхней части (ближе к телу матки) – под углом около 120 градусов к продольной оси матки с целью увеличения площади соприкосновения сопоставляемых в последующем поверхностей (рис. 2а) [12]. После удаления иссеченной ткани при необходимости выполняли селективный биполярный гемостаз.
- IV этап – ушивание матки выполняли послойно в 2 ряда. Первый ряд – отдельные узловые экстракорпоральные мышечно-слизисто-мышечные швы нитью «викрил 2-0» на расстоянии 5 мм друг от друга (рис. 1е). Вкол и выкол иглы осуществляли посередине толщи сопоставляемых краев миометрия с обеих сторон, проводя ее с захватом слизистого слоя. При этом с помощью внутриматочного расширителя Гегара предупреждался захват в шов задней стенки шейки и тела матки. Второй ряд отдельных узловых мышечно-мышечно-серозных швов накладывали экстракорпорально нитью «викрил 0» в шахматном порядке по отношению к швам первого ряда (рис. 1ж). Вкол и выкол иглы осуществляли, отступая 4 мм от краев разреза с обеих сторон, проводя ее посередине толщи сопоставляемых краев миометрия (рис. 2б).
- V этап – перитонизация линии швов брюшиной пузырно-маточной складки с помощью нити «монокрил 2-0» (рис. 1з).


52 пациенткам (2-я группа) дополнительно была выполнена пликация и укорочение круглых связок матки с использованием монофиламентной нити с длительным периодом рассасывания «PDS*II 0». Эндоскопически выполнялось прошивание круглых связок матки по всей длине «сборивающими» непрерывными швами, начиная от места их вхождения во внутреннее отверстие пахового канала, по направлению к матке с захватом миометрия и обратно, игла срезалась. Извлечение из брюшной полости свободных концов нитей «PDS*II 0» осуществлялось следующим образом: в точке на 1 см выше проекции внутреннего кольца пахового канала скальпелем производился надрез кожи длиной 3 мм, через него в брюшную полость проводилась скорняжная игла, захватывался один из концов нити и выводился наружу. Второй вкол скорняжной иглы производился, отступив 3 мм от первого, с оставлением между вколами апоневротического мостика; аналогично выводился второй конец нити. Манипуляция повторялась с противоположной стороны. Концы нитей с обеих сторон завязывались над апоневрозом под контролем лапароскопии до достижения маткой положения anteflexio (рис. 1и).
В послеоперационном периоде всем пациенткам проводились неспецифические мероприятия по профилактике тромботических осложнений: ранняя активизация, эластическая компрессия нижних конечностей. Больным группы риска возникновения тромбоэмболических осложнений под контролем гемостазиограммы назначались препараты низкомолекулярного гепарина. Всем пациенткам проводили антибактериальную терапию в течение 5 дней (антибиотики широкого спектра действия: полусинтетические пенициллины или цефалоспорины); по показаниям проводили симптоматическую и инфузионную терапию.
Контроль эффективности метропластики проводился через 6 месяцев после операции с помощью анкетирования для оценки жалоб, а также с помощью эУЗИ для оценки параметров нового рубца ввиду неинвазивного характера исследования. Полученные значения параметров нового рубца сравнивались с аналогичными параметрами эУЗИ, полученными до операции. Во время измерений при контрольном эУЗИ использовалась стандартизованная методика, принятая в исследовании Delphi [13]. УЗ-критерием неэффективности проведенной метропластики считали значение мТР<3 мм.
После получения удовлетворительных результатов по данным контрольного эУЗИ через 6 месяцев после операции начинали подготовку к беременности.
Статистический анализ
Статистическая обработка и анализ данных были выполнены с помощью программного обеспечения Microsoft Excel 2010 и STATISTICA 10. Для оценки нормальности распределения данных использовался критерий Колмогорова–Смирнова и Шапиро–Уилка. Данные с нормальным распределением представлены как среднее (стандартное отклонение). Для сравнения полученных данных использовался критерий Стьюдента. Проведено сравнение групп по качественным характеристикам с помощью непараметрического теста Манна–Уитни. При проверке статистических гипотез значимым считался уровень значимости р<0,05. Оценка влияния отдельных качественных факторов на успех операции реализована с использованием инструментария таблиц сопряженности, с расчетом критерия хи-квадрат, позволяющего выявить, является ли связь между значениями фактора и успехом операции статистически значимой, и показателя относительного риска с построением 95% доверительного интервала (ДИ). Для компенсации небольшого числа наблюдений в отдельных случаях при расчете показателей по таблицам сопряженности применялась процедура бутстреп-оценивания на основе 1000 и 2000 выборок.
Результаты
Средний возраст пациенток с ДРМ составил 34,1 (3,9) года (1-я группа – 33,9 (3,5) лет, 2-я группа – 34,6 (4,2) лет, р=0,379). На момент исследования у всех женщин после последнего КС прошло более 1 года. При оценке данных эУЗИ у пациенток 1-й группы мТР составила 2,3 (0,9) мм, а у пациенток 2-й группы – 2,1 (0,6) мм.
Наиболее частыми клиническими проявлениями ДРМ являлись НМЦ: кровяные выделения до менструации были отмечены у 2/61 (3,3%) пациенток в 1-й группе, после менструации – у 80/113 (70,8%) пациенток (41/61 (67,2%) – в 1-й группе, 39/52 (75%) – во 2-й группе), межменструальные кровяные выделения – у 14/113 (12,4%) пациенток (8/61 (13,1%) – в 1-й группе, 6/52 (11,5%) – во 2-й группе), обильные менструации – у 4/113 (3,5%) пациенток (у 2/61 (3,3%) – в 1-й группе, у 2/52 (3,8%) – во 2-й группе), р=0,897. Периодические тянущие боли внизу живота, возникновение которых отмечено после выполнения последнего КС (болевой синдром), отмечали 19/113 (16,8%) пациенток (13/61 (21,3%) – в 1-й группе и 6/52 (11,5%) – во 2-й группе, р=0,169). Болезненные менструации были выявлены у 9/113 (8%) пациенток (7/61 (11,5%) – из 1-й группы и 2/52 (3,8%) – из 2-й группы, р=0,139).
Вторичное бесплодие встречалось у 35/113 (31%) пациенток, при этом в 1-й группе отмечалось реже, чем во 2-й: 13/61 (21,2%) и 22/52 (42,3%) пациенток, соответственно, р=0,017. Длительность бесплодия в группах в среднем составила 4,8 (2,9) и 4,0 (1,9) года, соответственно, р=0,334.
При оценке сопутствующей соматической патологии у пациенток с ДРМ чаще встречались такие заболевания, как:
- заболевания опорно-двигательного аппарата (сколиоз, плоскостопие, гипермобильность суставов) – 54/113 (47,8%): в 1-й группе – 25/61 (41%), во 2-й группе – 29/52 (55,8%) пациенток, р=0,139;
- варикозное расширение вен нижних конечностей – 52/113 (46%): в 1-й группе – 24/61 (39,3%), во 2-й группе – 28/52 (53,8%) пациенток, р=0,184;
- заболевания органов зрения (миопия, астигматизм) – 42/113 (37,2%): в 1-й группе – 23/61 (37,7%), во 2-й группе – 19/52 (36,5%) пациенток, р=0,821.
При оценке признаков нДСТ в группах, согласно клиническим рекомендациям [11], диагноз устанавливался при достижении ДК нДСТ значения 17 и более. Было выявлено, что в 1-й группе диагноз нДСТ имел место у 27/61 (44,3%) пациенток (ДК=19,2 (1,6)), во 2-й группе – у 25/52 (48,1%) пациенток (ДК=19,0 (1,7)), р=0,917 (рис. 3).

При анализе другой сопутствующей соматической патологии различий выявлено не было.
Из перенесенных экстрагенитальных оперативных вмешательств чаще встречалась аппендэктомия: 1-я группа – 11/61 (18%), 2-я группа – 11/52 (21,1%) женщин. У нескольких пациенток отмечались операции, связанные с проявлениями ДСТ: в 1-й группе – 1 операция по поводу пупочной грыжи и 1 пластика передней брюшной стенки в связи с расхождением прямых мышц живота, во 2-й группе – 1 операция по поводу паховой грыжи.
Важно отметить, что только 31/113 (27,4%) пациентка смогла предоставить выписной эпикриз после родов; при этом лишь у 9/113 (8%) пациенток в выписном эпикризе были отображены особенности выполнения КС, что затруднило проведение оценки влияния техники и длительности операции, шовного материала, интраоперационной кровопотери, уровня разреза во время КС, а также раскрытия шейки матки в момент выполнения КС на формирование ДРМ.
При оценке акушерского анамнеза было выявлено, что общее число беременностей на одну пациентку в 1-й группе составило 2,1 (1,3), во 2-й группе – 2,0 (1,1), а общее число КС на одну пациентку составило 1,5 (0,6) и 1,4 (0,6), соответственно, при этом 2 и более КС в 1-й группе были у 26/61 (42,3%) женщин, во 2-й группе – у 15/52 (28,8%), соответственно. Проведенный анализ особенностей течения последней беременности, окончившейся КС, выявил значимое преобладание экстренного КС в обеих группах – у 77/113 (68,1%) пациенток.
У 11/113 (9,7%) пациенток встречалась истмико-цервикальная недостаточность: в 1-й группе – у 6/61 (9,8%), во 2-й группе – у 5/52 (9,6%) пациенток (р=0,973).
При анализе послеродового периода после последнего КС в 1-й группе была диагностирована гематометра у 3/61 (4,9%) пациенток, что потребовало во всех случаях вакуум-аспирации и опорожнения гематометры; во 2-й группе – у 6 (11,5%) пациенток (р=0,218), что потребовало в 3 случаях проведения медикаментозного лечения, а в 3 случаях – гистероскопии и опорожнения гематометры. Также 1 пациентке из 1-й группы была выполнена релапаротомия, опорожнение гематомы в области шва на матке после КС на 10-е сутки после родов.
Результаты хирургического лечения
При сравнительной оценке двух методов метропластики не было выявлено статистически значимых различий в интраоперационной кровопотере (1-я группа – 57,0 (26,3) мл, 2-я группа – 54,2 (28,2) мл, р=0,586) и в продолжительности операции (1-я группа – 94,1 (23,2) минут; 2-я группа – 101,3 (20,5) минут, р=0,084). В среднем операция с укорочением и пликацией круглых связок проходила на 7 минут дольше, что обусловлено невысокой сложностью выполнения данного этапа.
Гистероскопия позволила определить точное расположение дефекта рубца, наличие ниши, ее границы, а также наличие кист эндоцервикса и атипично расширенных сосудов. В 1-й группе рубец располагался в области внутреннего зева – в 50/61 (82%) случаях, в области нижней трети тела матки – в 11/61 (18%) случаях; во 2-й группе в области внутреннего зева – в 46/52 (88,5%) случаях, в области нижней трети тела матки – в 6/52 (11,5%) случаях, р=0,340.
Во время лапароскопии был выявлен спаечный процесс в малом тазу в виде фиксации мочевого пузыря к передней стенке матки в зоне рубца после КС у 51/61 (83,6%) пациентки в 1-й группе и у 40/52 (76,9%) пациенток во 2-й группе, р=0,376.
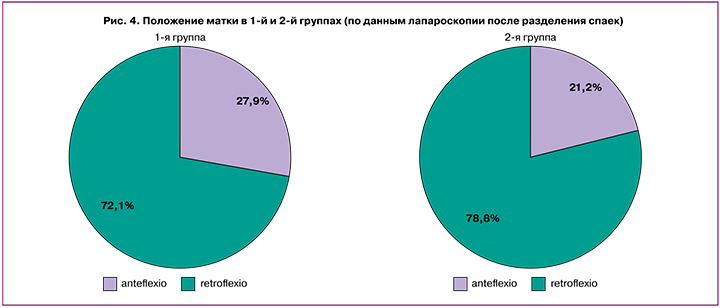
Таким образом после разделения спаек при окончательной оценке положения матки было выявлено: положение матки anteflexio определялось у 28/113 (24,8%) пациенток (в 1-й группе – у 17/61 (27,9%), во 2-й группе – у 11/52 (21,2%)), а положение матки retroflexio у 85/113 (75,2%) пациенток (в 1-й группе – у 44/61 (72,1%), во 2-й группе – у 41/52 (76,9%), р=0,414 (рис. 4).
Все операции прошли без интра- и послеоперационных осложнений, пациентки были выписаны в удовлетворительном состоянии на 6–7-е сутки после оперативного лечения. В 1 случае во 2-й группе у пациентки была отмечена парестезия по ходу n. genitofemoralis справа, которая купировалась самостоятельно в течение 3 недель.
При повторном анкетировании пациенток через 6 месяцев после операции было отмечено значимое уменьшение жалоб в обеих группах: НМЦ прекратились у 94/100 (94%) пациенток обеих групп, при этом во 2-й группе исчезновение жалоб было статистически значимо чаще чем в 1-й группе (47/47 (100%) пациенток из 2-й группы и 47/53 (88,7%) из 1-й группы, р=0,018). Болевой синдром отсутствовал в обеих группах (р<0,05) (табл. 1). Таким образом, исчезновение клинических проявлений было отмечено в 90,2% (55/61) случаев в 1-й группе и в 100% (52/52) случаев во 2-й группе, р=0,021.
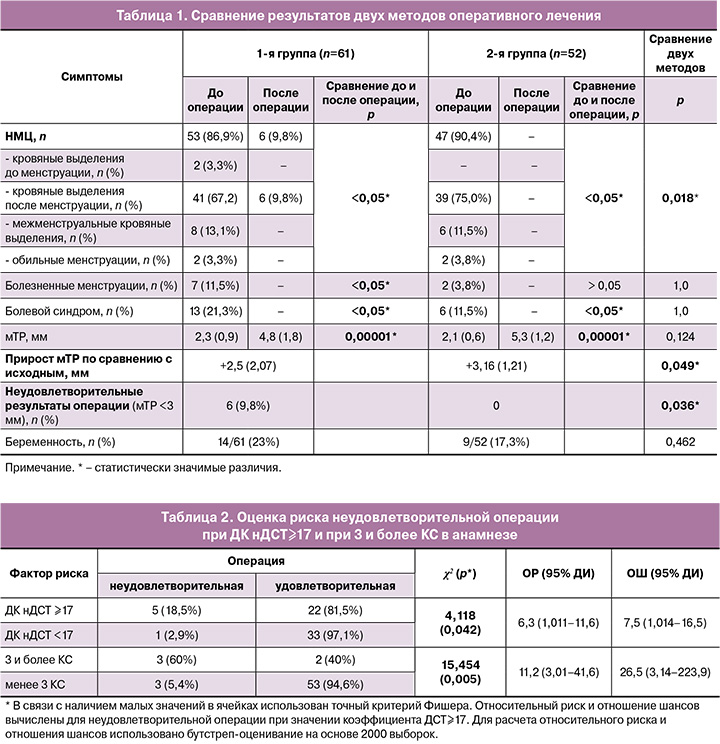
При выполнении контрольного эУЗИ через 6 месяцев после операции с целью оценки эффективности проведенной метропластики было выявлено, что мТР в 1-й группе была несколько меньше, чем во 2-й и составила 4,8 (1,8) и 5,3 (1,2) мм, соответственно, р=0,124. Однако прирост величины мТР по сравнению с дооперационными показателями во 2-й группе был статистически значимо больше в сравнении с 1-й группой и составил +3,16 (1,21) и +2,5 (2,07) мм, соответственно, р=0,049. К тому же в 1-й группе было выявлено 6 (9,8%) случаев неудовлетворительных исходов (мТР<3 мм), в 4 (7,7%) случаях мТР составила 3 мм, в остальных случаях (82,7%) – более 3 мм, при этом во 2-й группе не наблюдалось неудовлетворительных исходов, в 100% случаев мТР составила более 3 мм, что явилось статистически значимым различием, р=0,036.
При оценке факторов риска неудовлетворительных исходов оперативного лечения были выявлены 2 показателя, достоверно влияющих на результат операции (табл. 2).
ДК нДСТ≥17 увеличивал риск (вероятность) неудовлетворительной операции в 6,3 раза и увеличивал шансы неблагоприятного исхода в 7,5 раз по сравнению с пациентками с ДК нДСТ<17.
У пациенток с 3 и более КС риск (вероятность) неудовлетворительного исхода операции был выше в 11,2 раза, и шансы неблагоприятного исхода были выше в 26,5 раз, чем у пациенток, имеющих менее 3 КС в анамнезе.
При анализе репродуктивных исходов было выявлено, что в 1-й группе беременность наступила у 14/61 (23%) пациенток: 4 пациентки беременны в настоящий момент, у 3 беременность закончились неразвивающейся беременностью на малых сроках, у 2 пациенток беременность закончилась самопроизвольным абортом, у 1 пациентки – внематочной (трубной) беременностью, что потребовало выполнения лапароскопии, тубэктомии, у 4 пациенток беременность закончилась своевременными оперативными родами. Повторное КС было выполнено в плановом порядке на сроке гестации в среднем 37,2 (1,1) недель, в 2 случаях имело место врастание плаценты.
Во 2-й группе беременность наступила у 9/52 (17,3%) пациенток: у 3 пациенток беременность закончились неразвивающейся беременностью на малых сроках, 2 пациентки беременны в настоящий момент, у 4 беременность закончилась своевременными оперативными родами. Повторное КС было выполнено в плановом порядке на сроке гестации в среднем 38,1 (0,2) недели, в 1 случае имела место дихориальная диамниотическая двойня.
Во всех случаях в обеих группах признаков несостоятельности рубца во время беременности и в родах выявлено не было.
Обсуждение
На сегодняшний день важной задачей является не только оптимизация диагностики ДРМ, но и выявление факторов риска атипического течения репаративного процесса в матке, а также разработка новых методов хирургического лечения, позволяющих создавать оптимальные условия для формирования рубца de novo.
Признанными факторам риска формирования ДРМ являются: уровень разреза и техника ушивания матки во время КС, состояние нижнего сегмента матки во время выполнения КС, retroflexio uteri, формирование спаек в области рубца, количество проведенных КС в анамнезе, наличие воспалительных заболеваний в послеродовом периоде, сопутствующая соматическая патология [4, 14–31]. При этом остается неясным, какой из факторов является ведущим.
На наш взгляд, одним из недооцененных факторов риска формирования ДРМ является нДСТ. Данные нескольких исследований свидетельствуют, что частота встречаемости несостоятельного рубца во время беременности у пациенток с нДСТ достигает 28,6 – 42,4% [32, 33]. При этом причиной формирования неполноценного рубца на матке после КС при нДСТ считается нарушение процесса репарации, молекулярным механизмом которого являются дефекты цитокиновой и гормональной регуляции воспалительного ответа и неоангиогенеза. При гистологическом исследовании иссеченных тканей в зоне рубца при нДСТ наблюдаются увеличение содержания стромального компонента и снижение васкуляризации, повреждение миоцитов в виде гидропической дистрофии, апоптоз гладкомышечных клеток [32].
Согласно полученным нами результатам, дисплазия соединительной ткани была выявлена у 52/113 (46%) пациенток с ДРМ. Такая высокая частота встречаемости данного состояния согласуется с результатами исследования Щукиной Н.А. и соавт. [33] где данный показатель составил 48%. Подтверждением наличия нДСТ у обследованных женщин служила высокая встречаемость патогенетически однородных заболеваний: варикозного расширения вен нижних конечностей – у 46% (52/113), нарушений опорно-двигательного аппарата – у 47,8% (54/113), заболеваний органов зрения – у 37,2% (42/113), ИЦН – у 9,7% (11/113).
Подтверждением роли нДСТ в неадекватном течении репаративного процесса явилась высокая частота retroflexio uteri у пациенток с ДРМ. Согласно данным литературы, встречаемость данного состояния в популяции около 18–20% среди нерожавших женщин и около 30% среди пациенток с родами в анамнезе (и через естественные родовые пути, и посредством КС) [34–36]. Среди пациенток исследуемой нами группы данный показатель составил 75,2% (85/113), что более чем в 2 раза превышало популяционные значения. Высокая частота retroflexio uteri у пациенток с ДРМ на наш взгляд может быть связана с высокой вероятностью его формирования после КС в результате перерастяжения перешейка матки в зоне неполноценно формирующегося рубца (secondary retroflexio).
На течение репаративного процесса оказывают влияние многие факторы: ишемия тканей вследствие некорректного их сопоставления или использования блокирующих швов (шов Ревердена), наличие кист эндоцервикса в проекции рубца при его расположении в шейке матки, большое количество ранее проведенных КС, воспалительный процесс, сопутствующая соматическая патология. Как уже было показано в недавнем обзоре [4], дополнительное влияние наряду с вышеуказанными факторами может оказывать механическое воздействие на ткань в виде чрезмерного ее натяжения. Ofili-Yebovi D. et al. полагают, что при retroflexio uteri такое натяжение тканей в зоне рубца приводит к снижению перфузии, ишемии и замедлению выработки коллагена [21]. Таким образом, нДСТ, retroflexio uteri и возникающее из-за этого механическое натяжение тканей в зоне формирующегося рубца создают своеобразный «порочный круг», приводящий к нарушению репарации.
Особенности течения репаративного процесса оказывают влияние не только на формирование рубца после КС, но и на эффективность метропластики, выполняемой вне беременности. По данным литературы частота неудовлетворительных исходов этой операции остается довольно высокой, достигая 10,5% при лапароскопическом доступе [5–8] и 10,9% при влагалищном доступе [37]. При этом в литературе редко встречаются данные анализа возможных причин хирургических «неудач», хотя в опубликованных работах авторы отмечают нДСТ и эндометриоз зоны рубца [38]. Согласно полученным нами данным у 9,8% (6/61) пациенток стандартная метропластика также не привела к удовлетворительному результату и мТР через 6 месяцев после операции была менее 3 мм. При этом, согласно проведенному нами статистическому анализу, значительное влияние на частоту неудовлетворительных исходов оперативного лечения оказывали два параметра: многократная травма перешейка матки (наличие 3 и более КС в анамнезе), увеличивающая вероятность «неудач» в 11,2 раза, а также наличие нДСТ (ДК нДСТ≥17), увеличивающей частоту «неудач» в 6,3 раза.
Таким образом, совокупность полученных нами данных позволила предположить важную роль нДСТ не только в патогенезе формирования ДРМ после КС, но и в неэффективности хирургической коррекции данного состояния и учесть данный механизм при проведении метропластики у таких пациенток.
Одним из очевидных методов, позволяющих устранить чрезмерное натяжение тканей и создать более благоприятные условия для формирования рубца de novo, является укорочение и пликация круглых связок матки. Данная операция выполняется с использованием шовного материала или специального оборудования [6, 38, 39]. Несмотря на упоминание в литературе данного метода при метропластике у пациенток с ДРМ, авторами не проводилась оценка его эффективности в сравнении со стандартной операцией [6, 40], что послужило целью данного исследования.
При оценке эффективности лапароскопической метропластики было отмечено, что при использовании стандартной методики клинические проявления в виде НМЦ исчезли у 47/53 (88,7%) пациенток, а в группе с укорочением и пликацией круглых связок у 47/47 (100%) пациенток, р=0,018. Болевой синдром был полностью устранен в обеих группах (р<0,001). Таким образом, оба метода оказались высокоэффективны в коррекции клинических проявлений ДРМ. Полученные нами данные подтверждают мировые исследования. Так, по данным Vervoort A. et al. [7] лапароскопическая коррекция ниши привела к статистически значимому уменьшению длительности постменструальных выделений и увеличению мТР у 79,2% пациенток. По данным Zhang Y. клинические проявления исчезли у 86% больных [41], по данным Ciebiera M. et al. – у 90% [42], по данным Donnez O. et al. – у 91% [6].
Однако параметры сформированных de novo рубцов были различными в двух группах, что может свидетельствовать о разном качестве течения репаративного процесса. При контрольном эУЗИ через 6 месяцев в 1-й группе средняя мТР составила 4,8 (1,8) мм, что было значительно выше, чем до операции – 2,3 (0,9) мм, р=0,00001. Во 2-й группе данный показатель составил 5,3 (1,2) мм, что также было значительно выше, чем до операции – 2,1 (0,6) мм, р=0,00001. При этом разница средних значений мТР в каждой группе через 6 месяцев после операции была статистически незначимой, р=0,124. Однако при сравнении степени прироста мТР по сравнению с исходными значениями была отмечена статистически значимая разница: в группе с укорочением круглых связок матки прирост мТР был больше, чем в группе без него (+3,16 (1,23) и +2,5 (2,07) мм, соответственно, р=0,049). Кроме того, в группе с укорочением и пликацией круглых связок матки не было выявлено ни одного неудовлетворительного исхода метропластики (мТР<3 мм), тогда как в группе без данного этапа этот показатель составил 9,8%, р=0,036.
При оценке репродуктивных исходов оба метода позволили реализовать репродуктивную функцию в 21/113 (18,6%) случае (в 14/61 (23%) – в 1-й группе и в 7/52 (13,5%) – во 2-й группе, р=0,120). Однако, учитывая небольшой период наблюдения за результатами операции и планирование беременности большинством пациенток в настоящее время как с помощью программ вспомогательных репродуктивных технологий, так и самопроизвольно, этот показатель требует дальнейшей оценки.
Заключение
В связи с продолжающимся ростом частоты КС, проблема ДРМ будет оставаться актуальной еще долгое время. Поскольку радикально изменить структуру родоразрешений в развитых странах вряд ли возможно, основными задачами будут профилактика формирования ДРМ и совершенствование методов их коррекции.
Метропластика является, по сути, корректирующей пластической операцией, нацеленной на обеспечение неосложненного течения последующей беременности, в связи с чем очень важной на наш взгляд является возможность ее выполнения с результативностью, близкой к 100%. Частота неудовлетворительных исходов метропластики около 10%, описанная в литературе и подтвержденная нашим исследованием, является достаточно высокой и требует поиска новых более совершенных методов коррекции.
Основываясь на полученных нами данных о роли нДСТ в патогенезе ДРМ, одним из эффективных методов обеспечения благоприятных условий для формирования рубца de novo, может служить дополнительное укорочение круглых связок матки, что позволяет уменьшить натяжение тканей в зоне рубца и повысить эффективность метропластики.



