Введение
Еще 70 лет назад системная красная волчанка (СКВ) считалась заболеванием с фатальным прогнозом, а попытки терапии с применением антибиотиков, сульфаниламида и солей металлов были признаны безуспешными [1]. Только после открытия P. Hench и E. Kendall гормона надпочечников кортизола и описания высокой эффективности его применения шестью больными СКВ начинается новая эра лечения этого заболевания [2]. Глюкокортикостероидные гормоны (ГКС) и в настоящее время остаются основным препаратом лечения СКВ [3].
ГКС в лечении СКВ
ГКС с 1957 г. наряду с аспирином и гидроксихлорохином официально рекомендованы FDA (Food and Drug Administration) для лечения СКВ [4]. Эффективность применения высоких доз ГКС при высокой активности и критическом течении СКВ в реальной клинической практике не вызывает сомнения. Пульс-терапия и пероральный прием 0,5–1,0 мг/кг массы тела в сутки считаются стандартной терапией при активном люпус-нефрите (ЛН), нейро-люпусе, цитопеническом кризе, васкулите и полиорганной недостаточности. А длительное применение поддерживающей терапии низкими дозами ГКС в большинстве случаев обеспечивает развитие низкой активности и ремиссии [5–7]. С другой стороны, когортные исследования подтверждают связь длительного многолетнего применения ГКС при СКВ и развития многочисленных необратимых органных повреждений, которые приводят к сокращению продолжительности жизни, удорожанию стоимости лечения, ухудшению качества жизни и социальной адаптации пациентов с СКВ [8–14]. Таким образом, новая стратегий терапии СКВ, основанная на концепции Treat-to-Target, сохраняет большое значение ГКС в терапии самых различных вариантов течения болезни, но в то же время обязывает минимизировать их токсическое влияние за счет снижения ежедневной дозы до ≤5 мг или полной отмены, а также более широкого использования иммунодепрессантов (ИД) и генно-инженерных биологических препаратов (ГИБП) [15–20].
Иммунодепрессанты
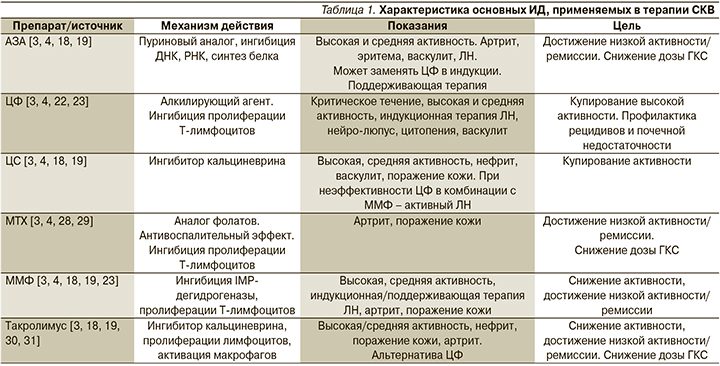
За последние несколько десятилетий благодаря многочисленным исследованиям в клинической практике терапии СКВ появилось несколько цитостатических иммунодепрессантов – циклофосфамид, азатиоприн (АЗА), хлорамбуцил (ХБ), циклоспорин (ЦС), метотрексат и др. [4].
Циклофосфамид (ЦФ). Высоко-дозные инфузии ЦФ в комбинации с ГКС прочно входят в стандарты терапии индукционной фазы терапии ЛН, поражении центральной нервной системы и других критических вариантах течения СКВ [22]. Несмотря на высокую эффективность ЦФ, его применение ограничивает ряд опасных побочных эффектов: лейкопению, инфекции, острый геморрагический цистит и потенциальный риск развития злокачественных новообразований, в связи с чем реальной альтернативой его применения является назначение микофенолата мофетила или АЗА [3, 23].
Микофенолата мофетил (ММФ). В настоящее время в лечении волчаночного нефрита все более важное место занимают ММФ и ингибиторы кальциневрина, по эффективности не уступающие ЦФ и обладающие лучшим профилем безопасности. ММФ – иммуносупрессивный препарат, механизм действия которого связан с обратимой ингибицией фермента инозин-5-монофосфат-дегидрогеназы. ММФ обладает способностью подавлять синтез лимфоцитами широкого спектра «провоспалительных» и «иммунорегуляторных» цитокинов (интерлейкин-2 – ИЛ-2, -3, -4, -5, -6, ИЛ-10, интерферона γ – ИФН-γ, фактора некроза опухоли α – ФНО-α) [18–20]. Особый интерес представляет тот факт, что у пациентов с СКВ, получающих лечение ММФ, отмечается снижение уровня ИФН типа I, занимающего центральное место в иммунопатогенезе СКВ. Механизмы действия ингибиторов кальциневрина (циклоспорин А, такролимус, волкоспорин) заключаются в предотвращении транслокации фактора транскрипции NFАТ (nuclear factor of activated Тcells), ингибиции активации Т-клеток (снижение синтеза ИЛ-1, ИФН-γ, ИЛ-6, -10) и подавлению функции В-клеток. Кроме того, ингибиторы кальциневрина обладают способностью улучшать функцию почек за счет стабилизации подоцитов и подавления пролиферации мезангиальных клеток. Комбинация ингибиторов кальциневрина с ММФ составляет основу т.н. политаргетной терапии ЛН, которая представляет собой применение препаратов с различными (возможно, «синергичными») механизмами действия, что позволяет использовать их в более низких дозах и тем самым снижать риск развития побочных эффектов. Так, при ЛН применение комбинированной терапии такролимусом (4 мг/сут), МФМ (1 г/сут) и ЦФ оказалось более эффективным и безопасным, чем монотерапия ЦФ (0,5–1,0 г/м2) [18–20]. Для подавления высокой активности и достижения ремиссии ММФ назначается пациентам с ЛН в дозах от 2 до 2,5 и 3 г/сут в течение не менее 6 месяцев. Отмечается высокая эффективность ММФ при васкулите, поражении кожи и полиартрите [3].
Метотрексат (MTX, аметоптерин или 4-амино-N10-метилптероил-глутаминовая кислота) является аналогом фолиевой кислоты, действие которого можно классифицировать на антипролиферативное (опосредованное дигидрофолатредуктазой – DHFR) и противовоспалительное действия (не DHFR). [50, 51]. По данным последнего систематического обзора, МТХ оказывает достоверное действие на пациентов с СКВ с преимущественным поражением кожи, слизистых оболочек и суставов. У пациентов, получающих МТХ, наблюдалось значительное снижение индекса активности СКВ (SLEDAI) по сравнению с контрольной группой (р=0,001). Также наблюдалось значительное снижение средней дозы ГКС среди пациентов, получавших МТХ, по сравнению с контрольной группой (р=0,001) [3, 52, 53].
В соответствии с рекомендациями EULAR/ACR (European League Against Rheumatism/American College of Rheumatology, 2019) МТХ назначают пациентам с СКВ с поражением кожи, слизистых оболочек, полиартритом по 15–20 мг еженедельно в комбинации с фолиевой кислотой, ГКС и гидроксихлорохином – ГХК [3, 52–54].
Ингибиторы кальциневрина
Такролимус (ТАС). TAC в течение многих лет успешно используется в трансплантологии с целью предотвращения развития криза отторжения. Как ингибитор кальциневрина он тормозит активацию Т-клеток, тормозит синтез ИЛ-2, -4, -5, ИФН-γ и ФНО-α [55, 56]. Результаты клинических исследований подтверждают эффективность различных режимов применения ТАК в индукционной и поддерживающей фазах терапии ЛН [57]. Для клинической практики большое значение имеют результаты мета-анализа результатов клинических исследований по сравнению эффективности и безопасности режимов ТАК+ГКС против ЦФ+ГКС. Оказалось, что ТАК превосходит ЦФ по таким показателям, как достижение полной и частичной ремиссии, протеинурия, уровень а-ДНК и индекса активности SLEDAI. При применении ТАК реже наблюдались такие побочные эффекты, как поражение желудочно-кишечного тракта, нарушение менструального цикла и лейкопения, инфекции, алопеция и нарушение функции печени. В то же время применение ТАК чаще ассоциировалось с повышением артериального давления, гипергликемией и повышением уровня креатинина [58–60]. В нескольких исследованиях различий в эффективности применения ТАК и ММФ при ЛН не выявлено [61, 62]. В свете политаргетной терапии комбинация низких доз ММФ+ТАК+ГКС превосходит монотерапию ЦФ и ММФ по таким показателям, как протеинурия, уровень альбумина и достижение ремиссии (все р<0,05) [63]. Высокоэффективна также комбинация ТАК с ЦС и ЦФ [64, 65]. Таким образом, доказанная высокая эффективность применения ТАК и приемлемая безопасность, особенно в комбинации с ММФ (политаргетная терапия), позволяют использовать этот препарат в терапии прогрессирующего ЛН, преимущественно в случаях неэффективности стандартной терапии.
Циклоспорин (ЦС) относится к ингибиторам кальциневрина, однако иммуносупрессивная активность ЦС in vitro и in vivo в 10–100 раз ниже, чем у ТАК [66]. Рандомизированные клинические исследования (РКИ) не выявили преимуществ ЦС в терапии СКВ перед ЦФ как в индукционной, так и поддерживающей фазах ЛН, а также в терапии внепочечных проявлений СКВ по сравнению с азатиоприном – АЗА [67].
Воклоспорин является химическим аналогом ЦС, но обладает более сильной способностью к связыванию с циклофилином А и значительно более выраженно ингибирует кальциневрин. Вероятно, волкоспорин – более эффективный препарат, чем ЦС, для него характерна более стабильная концентрация в плазме и быстрое выведение [68]. Эффективность ЦС при СКВ оценена в плацебо-контролируемой фазе IIb РКИ (AURA) у 265 рандомизированных пациентов с активным ЛН (RPS/ISN классы III/IV/V) (NCT02141672). В основной группе пациенты получали одну из двух доз воклоспорина (23,7 или 39,5 мг 2 раза в сутки), в группе плацебо – 2 г ММФ в дополнение к ГКС [69]. Полный ответ на 24-й неделе (33 против 19%) и частичный почечный ответ (70 против 49%) были значительно выше в группе с низкой дозой волкоспорина, чем плацебо. На 48-й неделе полный и частичный почечные ответы наблюдались достоверно чаще в группах волкоспорина по сравнению с плацебо.
В то же время частота летальных исходов и серьезные побочные эффекты чаще были при применении волкоспорина. Перспективные данные этого исследования привели к началу более широкой III фазы РКИ (NCT03021499). Благодаря результатам РКИ, проведенных за последние 20 лет, уточнены основные механизмы действия и разработаны показания к применению ИД при СКВ (табл. 1).
Гидроксихлорохин
Гидроксихлорохин (ГХК) остается одним из основных препаратов в терапии СКВ с достаточно высокой эффективностью при поражении кожи, артрите, применяется для предотвращения обострений, снижения риска тромбоза при антифосфолипидном синдроме, атеросклероза и диабета 2 типа [24–25]. Иммунологические эффекты ГХК включают снижение экспрессии HLA класса II и презентацию антигена, снижение продукции провоспалительных цитокинов (ИЛ-1β и ФНО), контроль активации Toll-подобного рецептора (TLR) 9 и уменьшение генерации активных форм кислорода иммунной системой клетки [25, 27]. В соответствии с современными рекомендациями EULAR/ACR (2019) ГХК назначают всем пациентам с СКВ в отсутствие противопоказаний [19, 20].
Генно-инженерные биологические препараты
Появление в конце ХХ в. ГИБП, обладающих способностью целевого блокирования молекул и клеток, которые являются ключевым звеном патогенеза многих ревматических заболеваний, неизбежно привело к попыткам применения этих препаратов при СКВ [3, 4, 32].
В последние годы продолжаются многочисленные клинические исследования целесообразности назначения ГИБП пациентам с СКВ с недостаточной эффективностью/непереносимостью стандартной терапии. Достижение стойкой ремиссии и восстановление толерантности иммунной системы являются основными целями применения ГИБП при СКВ. Вероятно, что их достижение будет возможно при выявлении целевых путей патогенеза в определенных подгруппах пациентов с СКВ (персонифицированная терапия).
Механизмы действия и данные РКИ по применению некоторых ГИБП при СКВ представлены в табл. 2.
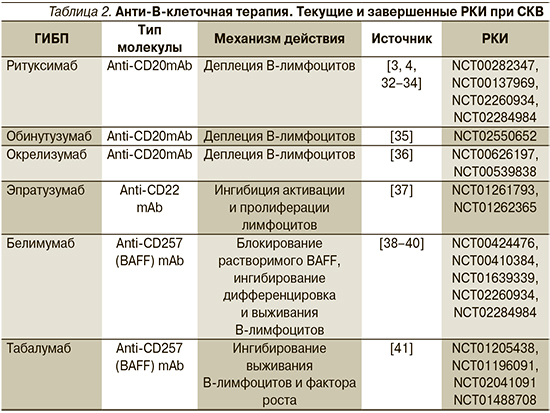
Ритуксимаб (РТМ) характеризуется как анти-CD20 mAb и является прототипом биологического препарата, представляет собой химерный mAb с человеческими доменами IgG1 и мышиными вариабельными областями к CD20. Результаты применения РТМ при СКВ начиная с 2005 г. демонстрируют его эффективность при высокой и средней активности, однако последующие РКИ (LUNAR и EXPLORER) не выявили его преимуществ по сравнению с контрольной группой больных ЛН и внепочечными проявлениями [42–44]. В то же время результаты проспективных и ретроспективных когортных исследований подтверждают достаточно высокую эффективность РТМ (до 74% и более) у пациентов с тяжелым течением СКВ и отсутствием эффекта от стандартной терапии высокими дозами ГКС и ЦФ, а также в виде монотерапии при некоторых формах ЛН [45–47]. В реальной клинической практике в соответствии с последними рекомендациями EULAR/ACR (2019), РТМ назначают больным СКВ с ЛН, нейро-люпусом, тромбоцитопенией, васкулитом в качестве терапии второй линии в отсутствие эффекта или невозможности применения стандартной терапии [19, 20]. Обнадеживают также результаты применения РТМ на ранней стадии СКВ и в комбинации с ММФ при IV–III формах ЛН [48, 49].
Белимумаб (БЛМ) представляет собой полностью гуманизированное моноклональное антитело, которое ингибирует BLyS (B Lymphocyte Stimulator). В двух исследованиях III фазы, BLISS-52 и BLISS-76, изучена эффективность внутривенного введения БЛМ при активной СКВ. БЛМ в дозе 10 мг/кг приводил к значительно более высокому уровню клинико-лабораторного ответа по индексу SRI по сравнению с плацебо в первичной конечной точке через 52 недели [70, 71]. Важным эффектом длительного применения БЛМ оказались значительное уменьшение частоты обострений, выраженный стероидосберегающий эффект, улучшение качества жизни и снижение уровня усталости [72]. Аналогичные результаты получены при проведении другого РКИ III фазы у пациентов с активной СКВ в Китае, Японии и Южной Корее [73]. Эффективность БЛМ при СКВ в реальной клинической практике во многом зависит от правильного выбора пациента. Так, в группу потенциальных «ответчиков» входят пациенты молодого возраста с СКВ высокой и средней степенью активности, с поражением суставов, кожи, слизистых оболочек, серозитом, нефритом (без признаков прогрессирования и ненарушенной азотовыделительной функцией почек), высоким уровнем анти-ДНК, снижением комплемента С3/С4 [39, 74]. Более высокий уровень оптимизации и терапии ГИБП достигнут при создании подкожной формы БЛМ [75, 76].
Важным элементом в совершенствовании терапии СКВ служит создание новых таргетных препаратов и формирование принципиально новых схем терапии. Такая схема может включать последовательное применение двух ГИБП – быстрое снижение активности СКВ с помощью РТМ с последующим назначением БЛМ с целью поддержания эффекта и достижения ремиссии. Перспективы такого лечения могут быть подтверждены детальным изучением механизмов действия препаратов и особенностей патогенетических мишеней (субпопуляций В-лимфоцитов, BLyS), на которые ориентирован каждый ГИБП. Проведенные исследования позволили установить, что у больных СКВ после применения РТМ, как правило, развивается деплеция B-лимфоцитов (CD20) с последующим существенным повышением в сыворотке крови концентрации BlyS(BAFF) – основной мишени для БЛМ [77, 78]. Резкое повышение уровня BLyS, по данным некоторых исследований, служит предиктором обострения СКВ [79, 80]. Высокий уровень BAFF после инфузий РТМ может ограничивать его эффективность в отношении некоторых пациентов с СКВ. Клинические и лабораторные эффекты применения ГИБП служат теоретическим обоснованием для проведения двойной анти-В-клеточной терапии больных СКВ. Проведенные недавно как in vivo, так и ограниченные клинические исследования подтвердили достаточно высокую эффективность последовательного применения РТМ и БЛМ у больных СКВ [81–84]. В настоящее время инициировано несколько РКИ, в которых исследуется комбинированное применение РТМ и БЛМ по сравнению с контрольной группой – пульс-терапия МП (метилпреднизолон), преднизолон 60 мг и ММФ до 2000 мг/сут. Анализ предварительных результатов – октябрь 2020 г. (NCT03747159). Другое РКИ (https://www. isrctn. com/ISRCTN47873003) инициировано профессором D. Aizen-berg, его дизайн заключается в двух последовательных инфузиях РТМ по 1 г с интервалом 2 недели и приемом или инфузией БЛМ 10 мг/кг/4 недели или плацебо. Планируется набор 56 пациентов с достоверной активной СКВ, за исключением пациентов с «критическим течением». В конечной точке – 52-я неделя, будет проведена оценка влияния на уровень анти-ДНК, дозу ГКС, активность, обострения и субпопуляции В-лимфоцитов. Первичная оценка результатов – март–апрель 2020 г. [85]. Еще одно РКИ (BLISS BELIEVE NCT03312907) предусматривает 3 группы пациентов с низкой или средней активностью СКВ: а) БЛМ+РТМ, б) БЛМ+плацебо, в) стандартная терапия. Все пациенты могут получать ГКС не более 5 мг/сут, ГХК и нестероидные противовоспалительные средства без иммунодепрессантов. Большой практический интерес вызывает исследование CALIBRATE (NCT02260934), в котором в откры-том РКИ у 43 пациентов с СКВ с ЛН будет оценена эффективность комбинации РТМ+ЦФ с последующим БЛМ против РТМ+ЦФ. Публикация первых результатов ожидается к концу 2020 г.
Ингибиторы «провоспалительных» цитокинов
Перспективное направление фармакотерапии СКВ связано с лекарственным препаратом устекинумаб (УСТ), который представляет собой моноклональные антитела к общей (р40) субъединице «провоспалительных» цитокинов ИЛ-12 и -23 [86], зарегистрирован для лечения псориаза, псориатического артрита и болезни Крона. ИЛ-12 и -23 (а также ИЛ-17) активно участвуют в патогенезе СКВ, в частности в гиперодукции аутоантител В-клетками [87]. По данным РКИ фазы II, лечение УСТ (6 мг/кг в/в, затем 90 мг п/к каждые 8 недель) ассоциировалось с достоверным снижением активности СКВ (индекс SRI-4) по сравнению с плацебо (р=0,006) [88].
Ингибиторы ИФН
Известно, что гиперпродукция ИФН типа I играет фундаментальную роль в иммунопатогенезе СКВ [89]. Установлено, что при СКВ нуклеиновые кислоты, высвобождающиеся из подвергнутых апопозу клеток и нейтрофильных внеклеточных ловушек (neutrophil extracellulasr traps), активируют плазмоцитоидные дендритные клетки (ДК), синтезирующие ИФН типа I (а также ИФН типа III), который в свою очередь стимулирует миелоидные ДК, вызывающие активацию Тh1, Th17 и В-клетки, в отношении синтеза «провоспалительных» цитокинов и аутоантител и ингибируют активность Т-рег-клеток. Кроме того, ИФН типа I поддерживает развитие и хронизацию воспаления за счет механизмов «обратной связи». Это послужило основанием для клинического изучения эффективности моноклональных антител, в частности анифролумаба (АНИФ) – полностью человеческих моноклональных антител (lgG 1ҡ) к рецепторам ИФН, блокирующиж сигнализацию, опосредованную ИФН-α и -β [90]. Применение анифролумаба приводило к снижению активности заболевания (SIR-4 и SLDAI-2K), положительной динамике поражения кожи по индексу CLASI (Cutaneous Lupus Erythema tosus Disease Area and Severity Index), в меньшей степени – артрита, позволило снизить дозу ГКС и частоту обострений заболевания по сравнению с плацебо.
Ингибиторы JAK-STAT
Патогенетическим обоснованием применения ингибиторов JAK при СКВ является блокирование широкого спектра «патогенетически значимых» цитокинов, включая ИФН типа I, а также ИЛ-12, -23, -6, -10, -21, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и др. [91]. Ингибитор JAK3/JAK1 – тофацитиниб (ТОФА) и ингибитор JAK1/JAK2 барицитиниб (БАРИ), зарегистрированы для лечения ревматоидного артрита, а ТОФА – и псориатического артрита. Недавно продемонстрирована эффективность ТОФА при семейной ознобленной (chilblain) волчанке [92, 93]. Эффективность БАРИ также оценивалась у пациентов с СКВ: так, применение БАРИ приводило к положительной динамике поражения кожи и/или артрита по сравнению с плацебо (р=0,04), индекса SRI-4, BILAG, показателя PGA ( (р=0,02) [127].
Плазмаферез
Терапевтический плазмаферез (ТПФ) используется при лечении различных аутоиммунных заболеваний. Эффективность ТПФ доказана при лечении гемолитико-уремического синдрома и синдрома Гудпасчера. Кроме того, TПФ может быть эффективным при прогрессирующем ЛН, геморрагическом альвеолите и нейро-люпусе, тромботической микроангиопатии или катастрофическом антифосфолипидном синдроме [94–98].
Заключение
Поскольку лечение пациентов с СКВ остается проблемой и в ХХI в., новые препараты позволят расширять терапевтические возможности ревматологов, курирующих это заболевание. Можно надеяться, что ингибиторы провоспалительных цитокинов, ингибиторы JAK-STAT и ингибиторы ИФН будут в ближайшее время применяться пациентами с СКВ наравне с анти-В-клеточными препаратами.
Дополнительная информация
Прозрачность исследования. Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать. Статья предоставлена в качестве информационной и образовательной поддержки врачей. Мнения, высказанные в статье, отражают точку зрения авторов, которая не обязательно совпадает с точкой зрения фармацевтических компаний.
Декларация о финансовых и других взаимоотношениях. Все авторы принимали участие в разработке концепции статьи и написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы подтверждают, что получают гонорары за консультационные услуги в области научной и педагогической деятельности (образовательные услуги, научные статьи, участие в экспертных советах, участие в исследованиях и др.).



