Гастроинтестинальные стромальные опухоли (ГИСО) имеют агрессивное течение. В большинстве случаев они характеризуются быстрым ростом и появлением метастазов (в печень, брюшную полость). Совсем недавно, до появления препаратов таргетной терапии, длительность жизни больных с метастатическими ГИСО составляла 9–12 месяцев. Цитостатическая химиотерапия при лечении пациента с ГИСО неэффективна.
В результате фундаментальных исследований достигнут значительный прогресс в лечении больных ГИСО. Установлено, что механизмы опухолевого прогрессирования ГИСО связаны с рецептором фактора стволовых клеток, продуктом протоонкогена с-kit. Экспрессия CD 117 (мембранная тирозинкиназа c-kit-рецептора) наблюдается в 95 % случаев ГИСО, чего не наблюдается при других веретеноклеточных опухолях желудочно-кишечного тракта [1].
В 80–90 % случаев ГИСО активация c-kit-рецептора обусловлена различными мутациями протоонкогена c-kit, причем в этих случаях для активации рецептора не требуется внешнего c-kit-лиганда. В 66 % случаев мутации происходят в 11-й экзоне (юкстамембранный домен) рецептора с-kit; в 10 % – в 9-й, в 2 % – в 13/14-й и 17-й экзонах [1].
В 30 % с-kit-негативных ГИСО (5 % всей популяции больных) выявляется мутация PDGFR-α (фактор роста, выделяемый тромбоцитами). Сочетанные мутации c-kit и PDGFR-α крайне редки, а отсутствие мутации и c-kit, и PDGFRA (дикий тип ГИСО) встречаются лишь в 5–10 % случаев [2].
Появление в 2002 г. иматиниба (Гливек), являющегося селективным ингибитором тирозинкиназ c-kit и PDGFR-α, позволило кардинально изменить судьбу больных ГИСО и добиться увеличения медианы времени до прогрессирования до 18–29 месяцев, а общей выживаемости – до 51–57 месяцев. Около 50 % больных в настоящее время живут более 5 лет [3, 4].
У 10–15 % больных ГИСО имеется первичная резистентность к иматинибу, кроме того, в течение 2 лет прогрессирование при лечении иматинибом развивается в 50 % случаев [5]. До 2006 г. в указанных ситуациях никаких лечебных перспектив для названных категорий больных не существовало.
В 2006 г. для лечения пациентов с прогрессированием ГИСО на терапии иматинибом был одобрен к применению сунитиниб (Сутент) – мультикиназный ингибитор c-kit, PDGFR-α, -β, рецепторов сосудистого эндотелиального фактора роста 1-го, 2 и 3-го типов (VEGFR 1, 2, 3) и ряда других рецепторов, обладающих как противоопухолевой, так и антиангиогенной активностью [6, 7]. Эффективность сунитиниба продемонстрирована в исследовании III фазы, включившем 312 больных с прогрессированием ГИСО на фоне терапии иматинибом. Использование сунитиниба в стандартном интермиттирующем режиме (по 50 мг в сутки в течение 4 недель с последующим 2-недельным перерывом) позволяет добиваться частичного регресса у 7 %, стабилизации болезни – у 58 % (длительностью более 6 месяцев – у 19 % больных). Медиана времени до прогрессирования в лечебной группе составила 6,5 месяцев по сравнению с 1,5 месяца без применения сунитиниба. Медиана общей выживаемости составила 16,4 и 7,9 месяца соответственно [8].
Наиболее выраженными побочными явлениями (степень III) при терапии Сутентом являются: артериальная гипертензия – у 7 % и ладонно-подошвенный синдром – у 6 % больных. Редко наблюдаются астения и диарея (I–II степени). Перерыв в приеме сунитиниба в связи с развитием побочных явлений потребовался в 36 % случаев, редукция дозы – в 28 % [8]. На основании этих данных были разработаны методы коррекции дозы сунитиниба и сформулированы рекомендации по безопасному ведению больных при развитии тех или иных побочных явлений.
В дальнейшем эффективность и безопасность интермиттирующего режима терапии сунитинибом были подтверждены и в исследовании “широкого доступа” на примере 1126 больных: медиана времени до прогрессирования составила 41 неделю, а медиана общей выживаемости –75 недель [9].
Эффективным и безопасным при прогрессировании ГИСО после терапии иматинибом оказался и другой режим применения Сутента –37,5 мг в сутки ежедневно длительно. В исследовании II фазы, включившем 60 больных, использование сунитиниба в данном режиме позволило добиться частичного регресса в 12 %, а длительной (более 6 месяцев) стабилизации – в 42 % случаев. Медиана времени до прогрессирования составила 7,6, а медиана общей выживаемости –23,8 месяца [10].
Таким образом, эффективность постоянного режима оказалась сопоставимой с таковой интермиттирующего, что позволяет безопасно использовать его в рутинной практике наравне с последним.
В отделении химиотерапии и комбинированного лечения злокачественных опухолей РОНЦ им. Н.Н. Блохина РАМН оценка эффективности и безопасности Сутента в качестве 2-й линии лечения распространенных ГИСО была проведена у 11 больных в возрасте от 23 до 70 лет. Первичная опухоль локализовалась в желудке у 1 пациента, в различных отделах тонкой и толстой кишки у 7 больных, а у 3 пациентов первичный очаг выявить не удалось. При молекулярно-генетическом исследовании мутации в 11-й экзоне гена c-kit были выявлены у 5 больных, в 9-й – у 1 пациента. В 5 случаях исследование мутаций с-kit не проводилось.
В качестве первой линии лечения все больные получали иматиниб в дозе 400 мг/сут. На фоне проводимой терапии частичный регресс отмечен у 6 больных, длительная стабилизация – у 5 пациентов. Продолжительность терапии Гливеком составила от 12 до 78 месяцев, после чего больные были переведены на терапию Сутентом.
Сутент назначали в интермиттирующем режиме (по 50 мг/сут в течение 4 недель с последующим 2-недельным интервалом). При развитии дозолимитирующей токсичности режим приема препарата изменяли (назначали по 25 мг/сут длительно без перерывов). На фоне проводимой терапии контроль над опухолью был достигнут у 9 из 11 больных (частичный регресс – у 3 пациентов: 9, 10 и 12 месяцев; длительная стабилизация – у 6 больных: 30, 21, 9, 9, 10 и 14+ месяцев). Еще одна пациентка на момент анализа продолжает принимать Сутент (4+).
Наиболее частыми побочными эффектами (степени I–II) были нейтропения и тромбоцитопения. Кроме того, отмечены артериальная гипертензия II степени, ладонно-подошвенный синдром, повышение уровня билирубина. Токсичность III степени (артериальная гипертензия) была отмечена у одного больной. Изменение режима приема Сутента в связи с токсичностью проведено у трех пациентов. Отмены препарата в связи с токсичностью не потребовалось ни в одном случае.
В качестве примера мы приводим описание двух клинических наблюдений, демонстрирующих эффективность и безопасность терапии Сутентом в качестве 2-й линии лечения распространенных ГИСО.
Клинический случай № 1
Больная С., 32 года. В феврале 2004 г. пациентке была выполнена резекция тощей кишки по поводу лейомиосаркомы. Интраоперационно метастазов в брюшной полости выявлено не было. При гистологическом и иммуногистохимическом исследованиях опухоль была расценена как ГИСО тонкой кишки с низкой митотической активностью I степени злокачественности по системе FNCLCC, СD-117 (с-kit) ++/+++. При молекулярно-генетическом исследовании обнаружены мутации в 11-й экзоне гена c-kit, приводящие к замене 550K → Q и делеции аминокислот с заменой 551-557 (PMYEVQW → R).
В дальнейшем больная находилась под динамическим наблюдением до апреля 2005 г., когда при компьютерной томографии 14.05.2005 были выявлены множественные метастазы в печень. Максимальный размер очагов составлял 3,5 × 3,9 см, плотность – 32–42 ЕДН.
В связи с этим 19.05.2005 больной начата терапия Гливеком в дозе 400 мг в сутки внутрь ежедневно. Уже после 3 месяцев лечения (в августе 2005 г.) отмечено уменьшение размеров и плотности очагов в печени. Максимальный эффект лечения в рамках стабилизации болезни был достигнут через полгода от начала терапии (максимальный размер очагов – 3,5 × 2,0 см, плотность – 14 ЕДН).
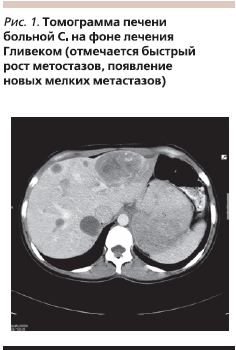
Достигнутый эффект сохранялся до марта 2007 г., когда было отмечено прогрессирование заболевания (увеличение размеров очагов и возрастание их плотности до 45 ЕДН). В связи с этим с мая 2007 г. доза Гливека была увеличена до 800 мг в сутки, что продлило стабилизацию болезни еще на 5 месяцев. Однако при компьютерной томографии 22.10.2007 отмечен быстрый рост опухолевых образований в печени: контрольные очаги в S7-8 2,1 × 1,8 см, в S7 3,3 × 2,8 см, в S6 1,8 × 1,6 см, в S8 2,6 × 1,5 см, в S3 8,2 × 6,0 см. Появились новые мелкие метастазы в печени. Плотность очагов составила 45 ЕДН (рис. 1). С 03.11.2007 больная начала прием Сутента в режиме 50 мг в сутки внутрь 4 недели; 2 недели перерыв.
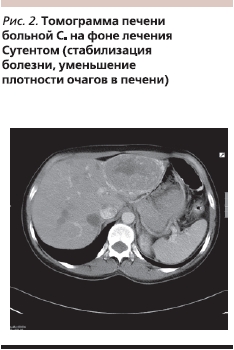
При проведении лечения Сутентом наблюдали стабилизацию болезни. В дальнейшем отмечено уменьшение плотности очагов в печени. Данная картина заболевания сохранялась в дальнейшем на протяжении всего периода лечения Сутентом (рис. 2).
Побочные эффекты: ладонно-подошвенный синдром II степени, тромбоцитопения I степени, нейтропения II степени.
С октября 2008 г. был начат непрерывный прием Сутента по 25 мг в сутки ежедневно. Побочных эффектов не наблюдалось. Лечебный эффект сохранялся.
Лечение Сутентом продолжалось до мая 2010 г. и было прекращено в связи с прогрессированием заболевания в виде увеличения размеров отдельных метастатических очагов на 0,5–0,7 см за счет нарастания солидного компонента и полостей распада (рис. 3).
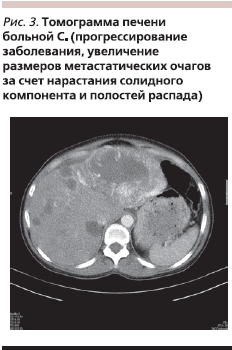
Таким образом, на фоне приема Сутента достигнута стабилизация болезни на протяжении 30 месяцев, а суммарная длительность контроля над болезнью составила более 5 лет. В течение всего периода лечения у больной сохранялось вполне удовлетворительное состояние (ECOG-1).
Клинический случай № 2
Больная К., 56 лет. В мае 2005 г. больной по поводу опухоли подвздошной кишки была выполнена резекция кишки и большого сальника с несколькими метастатическими узлами до 25 см в диаметре. Кроме того, были удалены множественные опухолевые узлы, располагавшиеся на париетальной брюшине. При гистологическом и иммуногистохимическом исследованиях удаленных узлов был установлен диагноз гастроинтестинальной стромальной опухоли тонкой кишки III степени злокачественности, СD-117 (с-kit) ++/+++. При молекулярно-генетическом исследовании обнаружены мутации в 9-й экзоне гена c-kit.
После операции больная была оставлена под динамическим наблюдением, однако при обследовании через 5 месяцев (в октябре 2005 г.) было выявлено появление множественных метастазов в печени (максимальный размер – до 2,1 см, плотность – до 38 ЕДН).
С 5.11.2005 начат прием Гливека по 400 мг в сутки внутрь ежедневно. Максимальный эффект терапии (частичный регресс) был зафиксирован через год после начала приема Гливека: в паренхиме печени отчетливо определялись только два метастаза размером до 1 см, плотность которых составила 25 ЕДН. В феврале 2007 г. (через 15 месяцев от начала терапии Гливеком) было выявлено прогрессирование заболевания в виде увеличения размера (до 1,6 см) и плотности (до 48 ЕДН) очагов в печени.
В марте–апреле 2007 г. проведено два курса химиотерапии в режиме MAID (ифосфамид, доксорубицин, дакарбазин), однако при контрольном обследовании выявлено увеличение размеров метастазов в печени, а также появление опухолевых узлов в области послеоперационного рубца размером до 5,8 см.
С 04.05.2007 больной начата терапия Сутентом по 50 мг в сутки внутрь ежедневно 4 недели с перерывом в 2 недели. После двух циклов терапии Сутентом отмечена стабилизация размеров очагов в печени и в области послеоперационного рубца.
Этот эффект сохранялся до ноября 2008 г. При последующих обследованиях отрицательной динамики выявлено не было, все метастатические очаги были прежних размеров и плотности. Прогрессирование заболевания было зафиксировано лишь в феврале 2009 г. (увеличение очагов в печени – до 9,4 см, в области послеоперационного рубца – до 5,6 см).
Таким образом, длительность приема Сутента у больной составила 21 месяц, а суммарное время контроля над болезнью – 39 месяцев. Состояние пациентки оставалось относительно удовлетворительным в течение всего времени лекарственной терапии.
Основным побочным эффектом было повышение артериального давления, что требовало изменения гипотензивной терапии. Однако это не препятствовало применению Сутента.
Заключение
Таким образом, из приведенных данных следует, что в настоящее время при прогрессировании ГИСО после применения Гливека пациенты могут перейти на прием Сутента, обладающего высокой эффективностью и минимальными побочными эффектами.
Интересно отметить, что в приведенных нами клинических случаях длительность контроля над болезнью на фоне 2-й линии лечения Сутентом была сопоставимой с длительностью лечебного эффекта Гливека в 1-й линии терапии. Эффективность и безопасность Сутента при использовании в 1-й линии лечения ГИСО продолжают изучаться.
Представленные данные свидетельствуют, что внедрение в клиническую практику Гливека и Сутента существенно изменило судьбу больных с метастазами ГИСО.



