Введение
Высокая контагиозность нового коронавируса SARS-CoV-2 за короткие сроки привела к широчайшему его распространению по планете с объявлением Всемирной организацией здравоохранения (ВОЗ) о пандемии [1]. В начале ее для ведения пациентов с COVID-19 были предложены принципы, ранее апробированные при лечении SARS, H5N1, лихорадки Денге и Эбола. Они включали противовирусную, антибактериальную терапию, противомалярийные препараты [2, 3].
При этом использование системных глюкокортикостероидов (ГКС), несмотря на их наличие в протоколе лечения острого респираторного дистресс-синдрома (ОРДС), допускалось только в исключительных ситуациях [4]. Целью настоящей статьи стало освещение динамики мировых подходов к лечению новой коронавирусной инфекции и представление клинических ситуаций течения COVID-19 у детей в клинике НМИЦЗД, потребовавших интенсивного лечения, а также случаи течения этой инфекции, которые при наличии значимых изменений в легких не требовали специфического подхода.
Эпидемиология
Острое респираторное вирусное заболевание COVID-19 вызвано новым коронавирусом SARS-CoV-2, представляющим собой РНК-содержащий вирус. От человека к человеку вирус передается воздушно-капельным путем при кашле или чихании больного, а также контактным – попаданием преимущественно через руки на слизистую оболочку глаз, носа и рта. Обсуждается также вертикальный путь передачи от COVID-инфицированной матери, а также заражение детей при грудном вскармливании. Особую роль в распространении играют бессимптомные носители и люди с клинически невыраженной симптоматикой или во время инкубационного периода, который в среднем составляет 5 дней (от 1 до 14 дней). В 95% случаев заболевание манифестирует в период до 12,5 дней после экспозиции, что послужило поводом для установления карантинного срока в 14 дней [5, 6].
Клиническая картина
Спектр клинических проявлений COVID-19 не только многообразен (лихорадка, миалгия, головная, боль, астенический синдром, кишечный синдром, кашель, боль в груди, одышка и др.), но и значительно варьируется по степени выраженности – от бессимптомного течения до тяжелейшего ОРДС.
Исследования показывают, что взрослые пациенты тяжелее переносят заболевание, однако в педиатрической практике описаны крайне тяжелые пациенты во всех возрастных группах, в т.ч. дети до года. Одним из возможных объяснений меньшей восприимчивости детей к SARS-CoV-2 может быть разница в экспрессии ангиотензинпревращающего фермента 2 (АПФ2) по сравнению со взрослыми [7].
Благодаря легкому течению болезни у большой части пациентов в распространении вируса основная роль принадлежит именно детям [3].
Предиктором тяжелого заболевания у взрослых принято считать двусторонние изменения на компьютерной томографии (КТ) грудной клетки в сочетании с высоким уровнем ферритина. Сложнее выделять критерии тяжести заболевания у детей, точнее – определять их адекватность для детской популяции с учетом небольшой выборки [3, 6].
Одно из наиболее масштабных исследований по течению коронавирусной инфекции у детей (2143 случая) проведено в Китае. Результаты показали, что 4,4% пациентов имели бессимптомную форму заболевания, 50,9% – легкую, 38,8% – средней степени тяжести. Тяжелое течение показали 5,8% заболевших, при этом бόльшая часть (10,6%) пришлась на детей до года в отличие от пациентов старше 16 лет (3%), из 13 случаев крайне тяжелого течения 7 пришлось на детей младше года. Смертельный исход развился у одного 14-летнего мальчика [8].
В другом китайском наблюдении из 171 инфицированного ребенка у 15,8% симптомов не было, 19,3% детей имели признаки поражения верхних дыхательных путей и в 64,9% случаев было выявлено поражение легких. Лихорадка от 1 до 16 дней отмечена у 41,5% детей (медиана составила 3 дня). Троим детям с тяжелыми коморбидными состояниями потребовалась интенсивная терапия; один из них, 10-месячный ребенок с кишечной инвагинацией, умер от полиорганной недостаточности [9].
У части пациентов SARS-CoV-2 провоцирует гипервоспалительную реакцию с активным высвобождением цитокинов вплоть до цитокинового шторма или вторичного гемофагоцитарного синдрома. Дыхательные расстройства, вероятнее всего, связаны именно с иммуноопосредованным поражением легочной ткани [10].
В клинической картине некоторых заболевших наблюдаются кожные изменения, однако до сих пор нет надежных свидетельств их вирусного генеза [11, 12].
Лабораторная и инструментальная диагностика
Гематологические изменения чаще всего проявляются лейко- и лимфопенией. По данным китайских авторов, у детей их можно наблюдать в 26,3 и 3,5% соответственно. Повышение уровня С-реактивного белка (СРБ), печеночные и мышечные ферменты, а также уровень D-димера коррелируют с тяжестью заболевания [6, 9].
Инструментальные исследования полезны, пожалуй, только в диагностике поражения легочной ткани. И если изменения на рентгенограмме грудной клетки неспецифичны: крайне скудные (небольшая затененность, интерстициальная альтерация) или вообще отсутствуют, то поражения легких, схожих с таковыми при ОРДС, наблюдаемые при КТ грудной клетки, значительно более значимы. Специфические изменения по типу «матового стекла» или «булыжной мостовой» в периферических отделах обоих легких достаточно распространены и среди детей вплоть до билатеральной долевой консолидации легочной ткани при тяжелом течении [6]. Высокая частота таких специфических изменений привела к тому, что характерным проявлением коронавирусной инфекции стали называть именно пневмонию, преимущественно с консолидацией в заднебазальных отделах легких [13]. Этиологическая диагностика в настоящее время основывается на выявлении РНК вируса SARS-CoV-2 методом полимеразной цепной реакции (ПЦР). Идентификация возбудителя может проводиться при исследовании верхних и нижних дыхательных путей (мазок из носоглотки, трахеальный аспират, мокрота, бронхоальвеолярный лаваж), а также при анализе крови, мочи, кала [4, 14].
Согласно исследованию, проведенному в Шанхае, вирусная РНК была выделена из носоглотки пациентов в течение первых 4–48 часов болезни и далее ПЦР была положительной от 6 до 22 дней (в среднем 12 дней). У пятерых детей вирусная РНК в кале обнаруживалась до 18–30 дней от начала появления симптомов [15].
Лечение
Для ведения пациентов с COVID-19, особенно в начале пандемии, предложено много препаратов (противовирусные, противомалярийные, внутривенные иммуноглобулины, рекомбинантные моноклональные антитела), ранее апробированных при лечении SARS, H5N1, лихорадки Денге и Эбола, хотя ни один из них до настоящего времени не доказал своей эффективности в отношении SARS-CoV-2 [2, 3].
Ранее неоднократно было заявлено о положительном эффекте противовирусной терапии с использованием осельтамивира, рибавирина, ганцикловира, лопинавира и ритонавира [4, 16]. В ранних российских клинических рекомендациях лечения детей с COVID-19 также отражены противовирусные препараты: рекомбинантный интерферон α-2b интраназально, умифеновир, осельтамивир, лопинавир/ритонавир, рибавирин [17].
Но результаты последних исследований, опубликованные в Китае, включившие 199 пациентов, показали отсутствие эффективности терапии лопинавиром/ритонавиром, кроме того, в этой группе отмечено наибольшее число побочных эффектов [16]. Такое лечение также не сопровождалось укорочением выделения вируса [18]. В настоящее время в педиатрической практике не рекомендованы противовирусные препараты за исключением возможности назначения интерферона α-2b через небулайзер, в частности детям групп риска и с иммунодефицитом [19–21].
Антибактериальная терапия при COVID-19 рассматривалась только в случаях присоединения бактериальной инфекции [22]. Однако изменения, выявленные при КТ грудной клетки, трактовались как пневмония и с учетом рекомендаций ВОЗ эмпирическая антибактериальная терапия рекомендовалась на основании клинического диагноза (внебольничная, госпитальная, вирусная, бактериальная пневмония), поэтому на практике антибиотик получали практически 100% пациентов даже с минимальными изменениями в легочной ткани.
Кроме того, два противомалярийных препарата (хлорохин и гидроксихлорохин), использующихся в т.ч. в ревматологии, показали свою противовирусную активность инвитро, что позволило их ранее применять в отношении пациентов с инфекциями Денге, Эбола, SARS, H5N1. Также было заявлено об их эффективности при COVID-19, и они были внесены в клинические рекомендации многих стран, включая Китай и Италию [2].
Несмотря на то что в протокол лечения ОРДС входят системные ГКС, способствующие супрессии легочного воспаления, их назначение при инфекционных заболеваниях рекомендовалось избегать с учетом возможности ингибирования иммунного ответа и элиминации возбудителя. Поэтому допускалось использование ГКС только в исключительных случаях развития жизнеугрожающих состояний, бронхоспазме, септическом шоке и т.д., но не рекомендовалось при вирусных пневмониях, что отражено в ранних клинических рекомендациях ВОЗ [4, 6, 22, 23]. Данное суждение было основано на результатах ранее проведенных исследований, показавших, что у пациентов с SARS1 ГКС не уменьшали смертность и могли приводить к побочным эффектам [22].
Исходя из возможности редукции цитокинового поражения легких ГКС, 11–12 февраля 2020 г. на Всемирном научно-исследовательском форуме, посвященном чрезвычайной ситуации, связанной с COVID-19, ВОЗ были индуцированы 8 приоритетных исследований, в т.ч. по применению системных ГКС в лечении новой коронавирусной инфекции [24].
В марте были опубликованы данные, опровергающие негативное влияние нестероидных противовоспалительных средств (НПВС) и ГКС на течение COVID-19. А в дальнейшем появились результаты эффективности ГКС при дыхательной недостаточности на фоне этой инфекции [25].
Одними из первых китайские специалисты в протокол диагностики и лечения COVID-19 у взрослых и детей в качестве возможного метода терапии включили низкие дозы системных ГКС (метилпреднизолон 1–2 мг/кг/сут) в течение 3–5 дней при прогрессировании дыхательной недостаточности и системной воспалительной реакции. Высокие дозы ГКС не рекомендовались из-за иммуносупрессивного эффекта и возможного увеличения времени репликации вируса [26, 27].
В Японии опубликованы результаты применения высоких доз ГКС в марте 2020 г. в отношении 7 взрослых пациентов, находившихся на искусственной вентиляции легких (ИВЛ) по поводу ОРДС, вызванного коронавирусом. Они получали внутривенную пульсотерапию метилпреднизолоном 500–1000 мг/сут в течение 3 дней с дальнейшей постепенной отменой по 1 мг/кг/сут. Средняя продолжительность лечения ГКС составила 13 дней. На фоне такого лечения выжили все пациенты, в течение 7 дней они были экстубированы и не потребовали повторной респираторной поддержки. Побочных эффектов не отмечено [28].
С учетом отсутствия доказанной эффективности противовирусной и иммуномодулирующей терапии при COVID-19, а также данных о том, что прогрессирование заболевания сопряжено с провоспалительным ответом организма, в США в марте 2020 г. также было проведено исследование эффективности ранней терапии системными ГКС пациентов со среднетяжелым и тяжелым течением заболевания. Метипреднизолон назначался на 3 дня в дозе 0,5–1,0 мг/кг/сут, разделенных на 2 внутривенных введения. Такое лечение достоверно (p=0,005) снижало риск ухудшения состояния, перевода в отделение реанимации и интенсивной терапии, ИВЛ и смертельного исхода по сравнению с обычной схемой лечения. Также отмечено значительное снижение продолжительности госпитализации (5 против 8 дней; p<0,001) [29].
С марта по июнь 2020 г. в Великобритании на базе 175 стационаров было проведено масштабное исследование RECOVERY, включившее более 11,5 тыс. пациентов с COVID-19. Результаты показали, что на фоне стандартной терапии у пациентов на ИВЛ 28-дневная летальность составила 41%, у пациентов на неинвазивной кислородной поддержке – 25% и 13% – у лиц без дыхательной недостаточности. Однако на фоне лечения дексаметазоном в дозе 6 мг/сут в течение 10 дней смертность была ниже на треть в первой группе, на 1/5 – во второй Дексаметазон не улучшал течения инфекции у пациентов, не требовавших кислородной поддержки [30].
Ряд экспертов рекомендуют использовать более высокие дозы метилпреднизолона: по 1–2 мг/кг/внутривенно каждые 8 часов детям с массой тела ≤50 кг; 120–125 мг/введение внутривенно каждые 8 часов – детям с массой тела >50 кг в течение 3–4 суток [31].
Центром по контролю и профилактике заболеваний в США 25.06.2020 на основании еще неопубликованных результатов RECOVERY уже внесены рекомендации по назначению дексаметазона пациентам с дыхательной недостаточностью на фоне COVID-19 [32].
Гипериммунный ответ некоторых пациентов настолько выражен, что приводит к т.н. цитокиновому шторму, ответственному за гиперкоагуляцию и полиорганную недостаточность со смертельным исходом. Гиперкоагуляция в свою очередь ответственна за тромбоз глубоких вен, приводящего к тромбоэмболии легочных артерий [2, 33].
Многочисленные исследования среди взрослых привели к тому, что на сегодня нет сомнений относительно наличия диссеминированной внутрисосудистой коагуляции у умерших пациентов, в т.ч. с окклюзией и микротромбозом легочных артерий низкого калибра [34]. Одним из критериев коагулопатии является повышение уровня D-димера и продукта распада фибрина. Последние публикации говорят об улучшении прогноза пациентов с тяжелым течением заболевания на фоне лечения антикоагулянтами, особенно с повышенным уровнем D-димера [35].
Поэтому пациенты с COVID-19, как госпитализированные, так и на амбулаторном этапе, требуют раннего профилактического пролонгированного назначения низкомолекулярных гепаринов [2, 35–37]. К сожалению, такие данные среди педиатрических публикаций крайне скудны.
Также были сообщения об эффективности внутривенных иммуноглобулинов и плазмы переболевших пациентов при тяжелом течении COVID-19 [31, 38, 39]. Однако на сегодняшний день нет достаточных оснований для рутинного их применения в отношении госпитализированных пациентов, однако эти препараты могут рассматриваться в комплексной терапии крайне тяжелых больных [3].
До сих пор с учетом отсутствия этиотропной терапии, как и при других респираторных вирусных инфекциях, симптоматическая терапия с назначением антипиретиков и обильного питья служит основой в лечении большинства нетяжелых пациентов с COVID-19 [2]. В нашей клинике за период с 24 апреля по 1 июня 2020 г. были пролечены более 400 пациентов от 0 до 18 лет, госпитализированных с подозрением на COVID-19 или контактных по этой инфекции дома. У 210 детей SARS-CoV-2 был подтвержден методом ПЦР. К началу госпитализации этих пациентов в нашем распоряжении имелись временные российские клинические рекомендации по диагностике и лечению COVID-19 у детей. Таким образом, мы были вынуждены всем детям, поступившим в конце апреля – начале мая с подтвержденным заболеванием, назначать противовирусную терапию, а также антибактериальную при выявлении изменений на КТ грудной клетки. Однако мы осознавали потенциальную неэффективность как противовирусной терапии, особенно применяемой в поздние сроки заболевания, так антибактериальной, учитывая вирусный генез пульмонологических изменений. Поэтому в случае тяжелого течения COVID-19 были вынуждены искать иные подходы к лечению, исходя из патогенеза состояния. К тому времени начали появляться публикации о возможной эффективности терапии системными ГКС, кроме того, в нашем центре имеется достаточный опыт ведения пациентов с первичным и вторичным гемофагоцитарным синдромом в отделениях ревматологии и реанимации.
Клинический случай 1
Девочка С. 13,5 лет, масса тела – 55 кг. Поступила в клинику 12.05.2020 на 8-й день болезни с жалобами на лихорадку до 39°С, боль в груди, затруднение дыхания, снижение аппетита. Последние 2 дня появилось затруднение дыхания. Дома получала ибупрофен, цефиксим без эффекта.
При поступлении: вялая, лихорадка 39°С, сухой кашель. SpO2 – 91%, частота дыхательных движений (ЧДД) – 30 в минуту. Участие вспомогательной мускулатуры в акте дыхания. Дыхание поверхностное, ослабленное, экскурсия грудной клетки низкая, с обеих сторон обилие влажных мелкопузырчатых хрипов. При попытке глубокого вдоха возникал сухой кашель. SpO2 повышалась до 97–98% по подаче увлажненного кислорода со скоростью 5 л/мин. ПЦР на SARS-CoV-2 положительная.
На КТ органов грудной клетки при поступлении: полисегментарно в обоих легких с участками «матового стекла», с ретикулярными изменениями по типу «crazy paving», процент вовлечения легочной паренхимы справа до 20%, слева до 50–60%. КТ-3 (рис. 1).
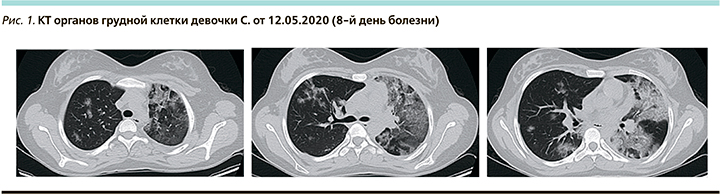
В анализах крови: лейкоциты – 6,88×109/л, лимфоциты – 0,87×109/л, тромбоциты – 217×109/л, Д-димер – 2 мкг/мл (норма – 0,16–0,39), фибриноген – 5,54 г/л (норма – 2,12–4,33), ферритин – 146 нг/мл (норма – 13–68), лактатдегидрогеназа – 200, СРБ – 12 мг/л, прокальцитонин (ПКТ) – 0,05 нг/мл.
В соответствии с действовавшими клиническими рекомендациями назначены амоксициллин/клавуланат, умифеновир (Арбидол), интерферон α-2β (Гриппферон), в качестве жаропонижающего – парацетамол. Через 2 суток (10-й день болезни) уровень СРБ повысился вдвое (25,82 мг/л), сохранялась одышка с низкой сатурацией, лихорадка. Решением консилиума в составе педиатров, пульмонологов, инфекциониста, ревматолога, реаниматолога была назначена парентеральная гормональная терапия метилпреднизолоном (Солу-Медрол) в дозе 6,8 мг/кг/сут в 3 введения, а также низкомлекулярный гепарин – далтепарин натрия (Фрагмин) 100 ЕД/кг/сут, п/к.
На этом фоне лихорадка купировалась за первые сутки введения, через день (к 15.05.2020) уровень лимфоцитов повысился до 1,37×109/л, Д-димер снизился до 0,81 мкг/мл, фибриноген – до 4,97 г/л, СРБ – до 10,05 мг/л.
С 17.05.2020 дозу метилпреднизолона начали снижать ежедневно на 20% до полной отмены. К 18.05.2020 все показатели крови полностью нормализовались, одышка не беспокоила, без подачи кислорода уровень сатурации повышался до 95%.
По КТ органов грудной клетки от 20.05.2020 (16-й день болезни) положительная динамика: участки уплотнения «матового стекла» с ретикулярными изменениями по типу «crazy paving» и зонами уплотнения легочной паренхимы полисегментарно в обоих легких уменьшились в размерах, стали менее интенсивными. Вовлечение паренхимы легкого – 25–50%. КТ-2 (рис. 2).
С 21.05.2020 SARS-CoV-2 не выделялся, с 22.05.2020 потребности в кислороде не было.
Таким образом, на ранних этапах дыхательной недостаточности применение метилпреднизолона купировало начинающийся цитокиновый шторм.
Клинический случай 2
Мальчик К. 13,5 лет, масса тела – 53 кг. Поступил 16.05.–2020 на 5-й день болезни с жалобами на лихорадку до 39°С, боль в груди, рвоту, разжижение стула. Последние 2 дня появилось затруднение дыхания. Дома получал парацетамол, азитромицин, лоратадин без эффекта.
Госпитализирован в связи с сохранением лихорадки и одышки. При поступлении лихорадка – 39°С, сухой кашель, SpO2 – 94–95%, ЧДД – 27 в минуту. Участие вспомогательной мускулатуры в акте дыхания. Дыхание жесткое, в нижних отделах ослаблено, там же влажные мелкопузырчатые хрипы. Рвота 2–3 раза в день, жидкий стул 3–4 раза в день. SpO2 94% повышалась до 97–98% при подаче увлажненного кислорода со скоростью 3 л/мин. Ребенок вялый, токсичный. ПЦР на SARS-CoV-2 положительная.
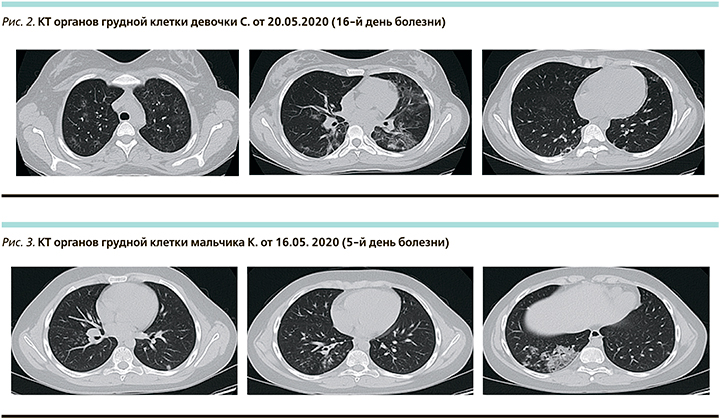
На КТ органов грудной клетки при поступлении в обоих легких округлые участки «матового стекла», в нижней доле правого легкого в S10 сливной участок «матового стекла» с ретикулярными изменениями «crazy paving». Процент поражения легочной паренхимы слева до 5%, справа до 15%, преимущественно нижние доли, КТ-1 (рис. 3).
В анализах крови: лейкоциты – 5,72×109/л, лимфоциты – 1,05×109/л, тромбоциты – 239×109/л, Д-димер – 0,65 мкг/мл (норма – 0,16–0,39), фибриноген – 5,53 г/л (норма – 2,12–4,33), ферритин – 212 нг/мл (норма – 13–68), СРБ – 36,97 мг/л, ПКТ – 0,05 нг/мл. В соответствии с действовавшими клиническими рекомендациями назначены амоксициллин/клавуланат, умифеновир (Арбидол), интерферон α-2β (Гриппферон), в качестве жаропонижающего парацетамол. Ондансетрон при рвоте.
В динамике сохранялись лихорадка, одышка, рвота, 18.05.2020 SpO2 снизилась до 92–93% и повышалась до 97–98% при подаче увлажненного кислорода уже со скоростью 5 л/мин, уровень СРБ повысился до 80 мг/л, уровень интерлейкина-6 (ИЛ-6) составил 53,52 пг/мл (норма до 7).
В связи с ухудшением состояния решением консилиума в том же составе были назначены парентеральная гормональная терапия метилпреднизолоном (Солу-Медрол) в дозе 6 мг/кг/сут в 3 введения, а также низкомлекулярный гепарин – далтепарин натрия (Фрагмин) 100 ЕД/кг/сут, п/к.
На этом фоне лихорадка и рвота купировались за первые сутки введения, через 48 часов (к 20.05.2020) уровень Д-димера снизился до 0,45 мкг/мл, СРБ – до 58,99 мг/л, но уровни ферритина и фибриногена повысились до 313 нг/мл и 6,59 г/л соответственно. С 21.05.2020 дозу метилпреднизолона начали снижать ежедневно на 20% до полной отмены. С 22.05.2020 SpO2 повысилась до 95%, одышки не было, все показатели крови, в т.ч. уровень ИЛ-6 ,снизились до нормы, лишь ферритин сохранялся на уровне до 292,7 нг/мл и нормализовался в течение недели. С 26.05.2020 потребности в кислороде не было.
На КТ органов грудной клетки в динамике от 26.05.2020 (15-й день болезни) выявлены новые инфильтративные фокусы и увеличение объема поражения легочной ткани. Однако уменьшилась интенсивность уже существовавших уплотнений легочной ткани. Процент поражения легочной паренхимы: слева – до 25–30%, справа – до 45–50%. КТ-2 (рис. 4).
Тем не менее такие изменения в легких были сопоставимы со сроками заболевания и не требовали дальнейшего лечения.
Заключение: таким образом, на ранних этапах дыхательной недостаточности с помощью метилпреднизолона был купирован начинающийся цитокиновый шторм. ПЦР на SARS-CoV-2 оставалась положительной до 01.06.2020.
Клинический случай 3
Девочка Л. 5 лет 9 месяцев, масса тела – 20 кг. Поступила 27.04.2020 на 12-й день болезни с жалобами на субфебрильную температуру, сухой кашель. ПЦР на SARS-CoV-2 положительная от 18.04.2020. В дебюте фебрильно лихорадила 3 дня, далее наблюдался субфебрилитет, с 6-х по 10-е сутки – повторная лихорадка. Дома получала симптоматическую терапию. С учетом сохранения кашля и первого эпизода в жизни обильного носового кровотечения ребенок госпитализирован.
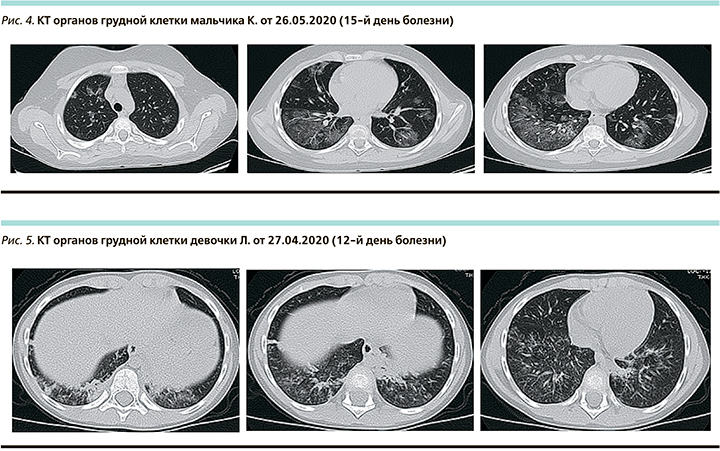
При поступлении самочувствие не страдает, не лихорадит, активная. Аускультативно в легких без физикальных изменений. ЧДД – 22 в минуту, SpO2 – 98%. По другим органам без особенностей. ПЦР на SARS-CoV-2 отрицательная. Лабораторно: общий анализ крови, СРБ, биохимический анализ крови без патологии, фибриноген – 4,7 г/л. На КТ органов грудной клетки при поступлении в нижних отделах обоих легких (в основном на уровне S 8, 9, 10) участки «матового стекла», а также участки гомогенной консолидации легочной такни, расположенные субплеврально. Прилежащие листки костальной плевры утолщены с минимальным количеством жидкости в полости. Поражение левого и правого легкого 25–50%. КТ-2 (рис. 5).
В соответствии с действовавшими клиническими рекомендациями получала лечение: азитромицин, умифеновир (Арбидол), интерферон α-2β (Гриппферон).
В отделении состояние оставалось стабильным, не лихорадила, SpO2 не падала ниже 98%. Уровень фибриногена через двое суток снизился до 2,8 г/л.
КТ в динамике (18-е сутки болезни) – участки консолидации не определяются, субплеврально негрубое утолщение плевры и минимальные тяжистые зоны уплотнения легочной ткани (поствоспалительные, рис. 6).
Заключение: возможно, впервые возникшее носовое кровотечение связано непосредственно с коронавирусной инфекцией. К моменту поступления лихорадка купировалась. При выраженном поражении обоих легких признаков дыхательной недостаточности не было, очень быстро произошла обратная динамика КТ, изменений в легких фактически без лечения.
Клинический случай 4
Девочка П. 10 лет, масса тела – 46 кг.
Поступила 21.04.2020 на 5-й день болезни с жалобами на лихорадку до 39°С, боль в горле, слабость, боль за грудиной, сухой кашель, головную боль. Дома получала джозамицин, парацетамол. С учетом сохранения лихорадки и отсутствия эффекта от лечения ребенок был госпитализирован. Контакт с матерью и отцом по SARS-CoV-2. При поступлении температура 38,5°С, небольшая вялость. Аускультативно в легких без физикальных изменений. ЧДД – 18 в минуту, SpO2 – 96–98%. По другим органам без особенностей.
Лабораторно: в общем анализе крови, СРБ, биохимическом анализе и коагулограмме без изменений. ПЦР на SARS-CoV-2 отрицательная.
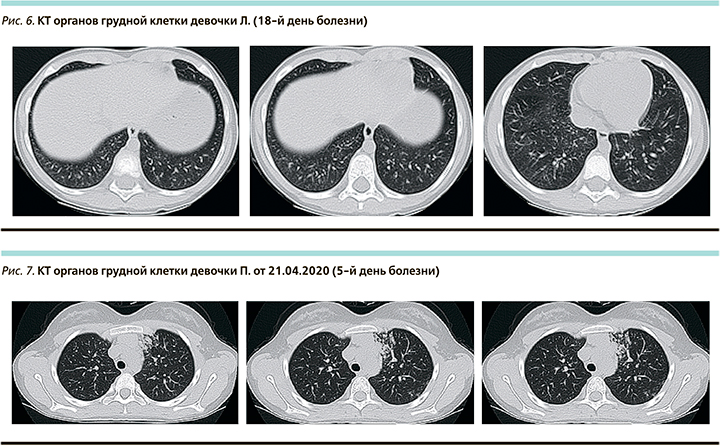
На КТ органов грудной клетки при поступлении в верхних отделах левого легкого участки как интерстициальной, так и альвеолярной инфильтрации с преобладанием процесса в периамедиастинальных отделах, а также по ходу листков костальной и междолевой плевры. Вовлечение паренхимы легкого до 25%. КТ-2 (рис. 7).
В соответствии с действовавшими клиническими рекомендациями, назначены амоксициллин/клавуланат, умифеновир (Арбидол), интерферон α-2β (Гриппферон).
В отделении со вторых суток самостоятельно перестала лихорадить, купировалась вялость, SpO2 не ниже 98%, головная боль купировалась через 3 дня. ПЦР на SARS-CoV-2 трижды отрицательная (на 1-й, 4-й, 11-й дни госпитализации).
На КТ органов грудной клетки в динамике от 29.04.2020 (13-й день болезни) – выраженная положительная динамика: выявленные ранее участки уплотнения легочной ткани в верхней доли левого легкого уменьшились в размерах, слабой интенсивности (рис. 8). Вовлечение паренхимы легкого <25%.
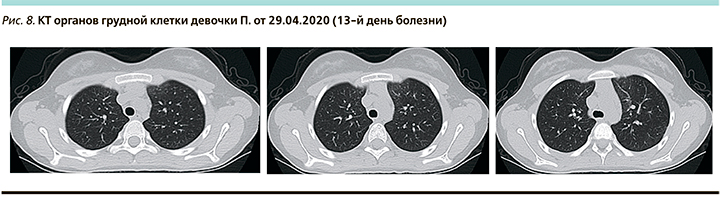
Заключение: несмотря на трижды отрицательные результаты ПЦР на SARS-CoV-2 при положительном результате у обоих родителей, ребенок имел типичную клиническую картину COVID-19 с характерными изменениями на КТ легких. Без специфического лечения лихорадка купировалась на 2-е сутки после поступления, признаков дыхательной недостаточности не было.
Клинический случай 5
Мальчик С. 15 лет, масса тела – 57 кг.
Поступил 10.05.2020 на 6-й день болезни с жалобами на лихорадку до 39,5°С, боль в горле, сухой кашель. ПЦР на SARS-CoV-2 от 07.05.2020 положительная. Дома получал азитромицин 1 сутки. Сохранение лихорадки и ухудшение самочувствия обусловили госпитализаци.
При поступлении температура – 38,5°С, активен. Даже на высоте лихорадки самочувствие практически не страдало. Аускультативно в легких без физикальных изменений, ЧДД – 18 в минуту, SpO2 – 98%. Минимальная гиперемия задней стенки глотки. По другим органам без особенностей.
Лабораторные данные при поступлении (10.05.2020): лимфопения – 0,63×109/л, СРБ – 83 г/л, ПКТ – 0,14 нг/мл, ферритин – 171 нг/мл (норма – 14–152), фибриноген – 4,6 г/л, Д-димер – 0,31 мкг/мл, экспресс-тест на стрептококк отрицательный. На КТ органов грудной клетки при поступлениибез патологических изменений.
В соответствии с действовавшими клиническими рекомендациями назначены азитромицин, умифеновир (Арбидол), интерферон α-2β (Гриппферон).
На 9-й день болезни 12.05.2020 лимфопения – 0,86×109/л, небольшая тромбоцитопения – 131×109/л, СРБ – 187 мг/л, ПКТ – 0,4 нг/мл, ферритин – 3 53 нг/мл, ИЛ-6 – 1 пг/мл (норма – 0–7), фибриноген – 5,7 г/л, Д-димер – 0,27 мкг/мл.
С учетом отрицательной лабораторной динамики, сохраняющейся лихорадки до 39°С азитромицин был заменен парентеральным введением цефтриаксона в дозе 2 г/сут в/в, начато введение метилпреднизолона 125 мг (2 мг/кг) 3 раза в сутки каждые 8 часов, эноксапарин натрия (Клексан) 3000 ЕД 2 раза в сутки п/к (100 ЕД/сут).
Через сутки, 13.05.2020, лихорадка купировалась, лабораторно лимфопения – 0,58×109/л, тромбоциты – 166×109/л, СРБ – 136 мг/л, ПКТ – 0,4 нг/мл, ферритин – 389 нг/мл, фибриноген – 6,7 г/л, Д-димер – 0,46 мкг/мл.
14.05.2020 самочувствие не страдает, не лихорадит, жалоб нет, лабораторно явная положительная динамика: лимфопения – 0,7×109/л, тромбоциты – 217×109/л, СРБ – 57 мг/л, фибриноген – 4,7 г/л, Д-димер – 0,29 мкг/мл.
С 15.05.2020 дозу метилпреднизолона начали снижать ежедневно на 20% до полной отмены. С 19.05.2020 нормализовались все показатели крови, кроме ферритина, уровень которого снизился к 25.052020. На КТ органов грудной клетки при поступлении 20.05.2020 (16-й день болезни) без изменений (рис. 9).
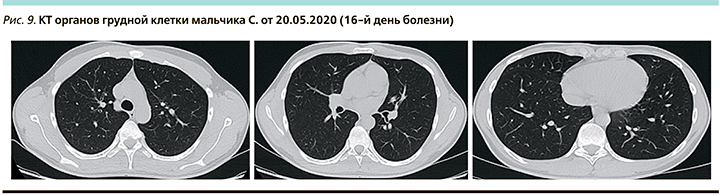
Заключение: пациент развил клинико-лабораторные признаки синдрома цитокинового «шторма» без поражения легких, дал быстрый ответ на патогенетическую терапию.
Заключение
Начальные принципы лечения COVID-19 основаны на предшествовавшем опыте терапии SARS1 и включали противовирусную, антибактериалную терапию, при этом отвергнув введение системных ГКС. Тем не менее в процессе пандемии стало ясно, что некоторые пациенты разворачивают клинику ОРДС на фоне цитокинового шторма, а также значимые изменения со стороны свертывающей системы крови, что потребовало в кратчайшие сроки пересмотра основных позиций ведения таких пациентов.
На осонвании постоянно обновляющихся мировых данных и собственном опыте в нашей клинике были внесены изменения в протоколы лечения детей со среднетяжелым и тяжелым течением COVID-19, включившие назначение короткого курса системных ГКС, а также низкомолекулярного гепарина. Успешность такого подхода стала отправным моментом его включения в новую, вторую, версию методических рекомендаций по лечению COVID-19 у детей от 03.07.2020.
Все дети с тяжелоперенесенным заболеванием и значимыми изменениями в паренхиме легких пройдут в центре повторное катамнестическое обследование осенью 2020 г.



