Актуальность
В доступной академической литературе все чаще применяют термин «репродуктивные неудачи», под которым суммарно понимают первичное и вторичное бесплодие, неудачи имплантации в программах вспомогательных репродуктивных технологий (ВРТ), невынашивание, неразвивающуюся беременность [1]. По данным Всемирной организации здравоохранения, встречаемость бесплодия в современном мире балансирует на грани, демографически значимой (до 15%), и не имеет тенденции к снижению [2]. Согласно данным официальной статистики (Росстат, 2015), его уровень в России – 224,2 на 100 тыс. женщин в возрасте 18–49 лет [3]. Потери потенциальных рождений, связанных с женским бесплодием, в 2014 г. составили 618,6 тыс. Общеизвестно, что проблема бесплодного брака выходит далеко за границы медицинской плоскости, поскольку он как для бесплодной пары, так и для общества в целом влечет за собой демографические, социальные и психологические последствия [3].
С другой стороны, неутешительными остаются данные о высокой распространенности самопроизвольного прерывания беременности в России – от 15 до 23% среди всех случаев зарегистрированных беременностей, около 50% выкидышей приходится на долю привычного невынашивания беременности [3]. Интересно, что риск потери желанной беременности возрастает с увеличением числа репродуктивных неудач и составляет 38% после двух предшествовавших выкидышей [4].
И наконец, в соответствии со сведениями последних лет частым осложнением после ВРТ является самопроизвольное прерывание беременности (12–29%), при этом 80% из них – в I триместре [5].
Одной из глобальных проблем современной репродуктологии, далекой от окончательного решения, по мнению исследователей, является нарушение процессов имплантации, обусловленное дефектом морфологического субстрата и/или дисфункцией эндометриального интерфейса [2, 3, 5, 6]. Особенно важным это представляется с точки зрения прогнозирования исхода беременности при экстракорпоральном оплодотворении (ЭКО) – все еще неуловимой цели репродуктологии, определившей активный поиск прогностических маркеров [5].
В систематическом обзоре и мета-анализе показано, что при выраженном отставании толщины эндометрия (ТЭ) от нижней нормативной границы в середине и в конце фолликулярной фазы стимулируемого цикла в протоколах ВРТ имеет место резкое снижение вероятности успешной имплантации, что служит одной из причин феномена повторных репродуктивных неудач (RIF – recurrent implantation failure) [7, 8]. Именно в этом контексте ранее были оценены материнский возраст, овариальный резерв и маркеры рецептивности эндометрия (РЭ). Безусловно, РЭ является неотъемлемой частью имплантации, поэтому идентификация точного маркера имплантации была бы весьма полезной в циклах ВРТ.
Несмотря на массу исследований в области маточной имплантологии и эмбриологии, на сегодняшний день идеального маркера РЭ не существует. Недостаточная диагностическая точность, прогностическая ценность и инвазивный характер гистологических и биохимических маркеров РЭ ограничивают их клиническую применимость [5].
Эндометрий – уникальная ткань организма, которая у женщин репродуктивного возраста ежемесячно подвергается регулярным динамическим изменениям: процессам трансформации, репарации и регенерации [4]. Все эти превращения направлены прежде всего на подготовку к имплантации эмбриона. Изменения в эндометрии, происходящие в течение менструального цикла, отражают совокупное влияние стероидов овариального цикла. Функциональный слой эндометрия начинает расти под влиянием эстрогена (Эс), пока не достигнет максимума в начале пикового выброса лютеинизирующего гормона (ЛГ), а пред- и постовуляторное повышение прогестерона (Пр) отвечает за секреторную трансформацию эндометрия, что сопровождается структурными изменениями в эндометриальном паттерне [9].
Необходимо отметить тот факт, что в силу своей неинвазивности и универсальной доступности трансвагинальная сонография – наиболее часто используемый и довольно информативный метод для оценки РЭ в протоколах ВРТ. При сонографическом исследовании в динамике могут быть отслежены увеличение ТЭ в фолликулярную фазу и его трансформация из гипоэхогенной полоски в трехслойный компактный вид гиперэхогенной картины в постовуляторном периоде. Считается, что именно наличие трехслойной структуры эндометрия в день введения триггера овуляции связано с увеличением вероятности с точки зрения наступления беременности [10].
При трансвагинальной сонографии ТЭ измеряется как максимальное расстояние между эхогенными интерфейсами миометрия и эндометрия в плоскости, проведенной через центральную продольную ось тела матки. На сегодня доказано, что ТЭ<7 мм в отсутствие структурности эндометриального паттерна на момент переноса эмбриона считается неоптимальной в протоколах ВРТ [10].
В отношении сонографической оценки структурности и РЭ [11] появление (трехслойной) тройной линии эндометрия в день триггера овуляции определяется как класс A, или рецептивный (восприимчивый), в то время как однородный фенотипический вид, или немногослойный эндометрий, относится к классу C – нерецептивный (невосприимчивый).
Секреция прогестерона (Пр) инициирует изменения в эндометрии, что отражается в однородности соединительной маточной зоны и четкости центральной эхогенной линии, в данном анатомическом паттерне определяется как класс В [11].
Следует констатировать, что основные параметры, используемые для оценки толщины и структуры эндометриального паттерна традиционным двухмерным ультразвуком, имеют существенно более низкую диагностическую информативность и значимость по сравнению с трех- и четырехмерным.
С появлением соответствующего сонографического оборудования появились дополнительные возможности повышения прогностической ценности этого метода исследования в протоколах ВРТ. К ним относятся измерение объема эндометрия и допплерография маточного и субэндометриального кровотока [9, 10].
В свете сказанного весьма интересными оказались результаты исследования М.П. Плясуновой (2018), где была показана роль гемодинамических нарушений в реализации синдрома «тонкого» эндометрия. Автор утверждает, что достоверными допплерометрическими критериями изложенной выше эндометриальной дисфункции следует считать увеличение индекса резистентности (IR)≥0,80 и отсутствие его снижения во 2-ю фазу менструального цикла, увеличение систолодиастолического отношения (S/D)>4,5 и уменьшение конечной диастолической скорости (Vmin)<2,5 см/с в эндометриальных и субэндометриальных сосудах [12]. Однако ТЭ и структура эндометрия по-прежнему остаются наиболее изученными и востребованными параметрами для оценки его несостоятельности.
Закономерно возникает первый ключевой вопрос: что мы понимаем сегодня под термином «тонкий эндометрий» в отсутствие такого диагноза в Международной классификации болезней 10-го пересмотра. Итак, «тонким» считается эндометрий, когда его толщина при сонографическом сканировании не превышает 7 мм [13–18], хотя, по данным других исследователей, М-эхо 6 [19–21,] и 8 мм также относят к гипопластическим эндометриопатиям [22]. Именно такая ТЭ используется для прогнозирования возможности наступления беременности в циклах ВРТ. Независимо от причинного фактора «тонкий» эндометрий часто ассоциируется с низкими показателями успеха после ЭКО [22–23].
Вместе с тем в многочисленных исследованиях доказана возможность наступления беременности даже при ТЭ на момент переноса эмбриона 4 и 5 мм [23–25]. Это позволяет предположить, что РЭ не всегда связана с ее толщиной.
По мнению К.В. Краснопольской (2016), ТЭ менее 8 мм к моменту завершения естественной (в натуральных циклах), искусственной (при применении индукторов фолликулогенеза) или имитируемой (при заместительной гормонотерапии Эс) фолликулярной фаз целесообразно считать «тонким». Но при этом сам феномен недостаточности развития (рост) эндометрия в пролиферативной фазе цикла без признаков гипоэстрогении следует рассматривать как проявление резистентности к эстрогенной стимуляции [26].
«Тонкий» эндометрий может быть результатом различных факторов, наиболее распространенными из которых являются воспалительные и ятрогенные. Бедная васкуляризация и низкие уровни эстрадиола могут также приводить к недостаточному росту эндометрия. Эндометрий также может быть по своей сути «тонким» у некоторых женщин, что многие исследователи называют идиопатической гипоплазией [27].
Если рассматривать основные причины возникновения синдрома «тонкого» эндометрия, то условно можно их разделить на три основные группы.
Воспалительные причины: острая или хроническая инфекция может приводить к поражению базального слоя эндометрия. Например, в Индии наиболее распространенной причиной «тонкого» эндометрия является генитальный туберкулез. Поскольку регенерация происходит при патологическом фиброзе, это приводит к разрушению эндометрия и облитерации полости матки. Регенерация эндометрия даже после полного лечения очень затруднена, т.к. фиброз разрушает базальный слой эндометриального паттерна, вместе с ним уничтожая надежды на восстановление ее рецептивности.
Ятрогенные причины: хирургический аборт, повторные выскабливания слизистой оболочки полости матки повреждают базальный слой эндометрия. Гистероскопическая миомэктомия, полипэктомия или лапароскопическая миомэктомия с вхождением (с проникновением) в полость матки может приводить к внутриматочному спаечному процессу.
Идиопатические причины: «тонкий» эндометрий не обязательно может быть вторичным по отношению к процессу формирования заболевания. Это может быть результатом индивидуальной маточной архитектуры [28] или внутренних свойств эндометрия, влияющих на его рост [29].
Но все же, если более конкретизировать гинекологические причины, негативно влияющие на РЭ, то следует обратить внимание на заболевания, представленные в таблице [30].
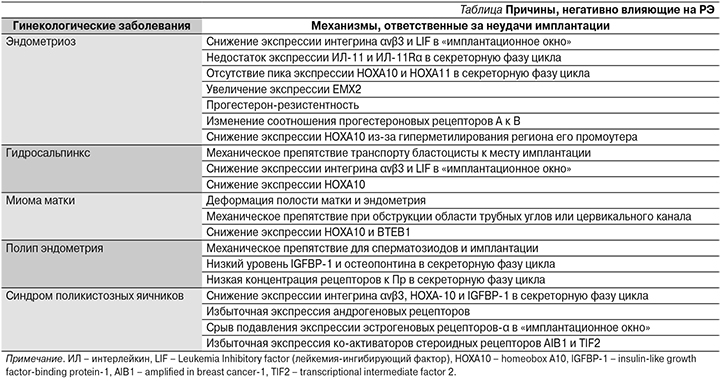
Следует отметить тот факт, что до сих пор нет никакой ясной патогенетической картины реализации названной эндометриопатии.
B. Xu et al. (2015) в попытке найти патофизиологические признаки «тонкого» эндометрия установили, что «тонкий» эндометрий характеризуется бедным ростом железистого эпителия, высоким сопротивлением в маточных артериях, уменьшением экспрессии сосудистого эндотелиального фактора роста VEGF (Vascular endothelial growth factor) и бедным образованием сосудов [31]. Высокое сопротивление кровотока в радиальных артериях может быть триггером, неблагоприятно влияющим на рост железистого эпителия и как результат – на снижение уровня васкуляризации в эндометрии. Многочисленные исследования дают основание предположить, что РЭ регулируется не только локальной концентрацией половых стероидов, но и множеством факторов, в т.ч. определяющих эндометриальный кровоток [31–33].
Вместе с тем любой патологический процесс, нарушающий функциональное состояние эндометрия, сопровождается снижением выработки фертильных факторов с нарушением адаптивных свойств организма и может приводить к расстройству процессов имплантации.
Согласно данным В.А. Крутовой (2016), под «маской» бесплодия неясного генеза могут скрываться вненозологические структурно-функциональные изменения в эндометрии, снижающие его рецептивность, вызывающие уменьшение его толщины и несоответствие структуры эндометрия дню менструального цикла [34].
Этим данным не противоречат результаты исследования А.В. Львовой (2018), в ходе которого было показано, что в основе патогенеза «тонкого» эндометрия лежат дисхронозное созревание эндометриальных желез на фоне выраженного обеднения его сосудистой сети, уплотнение стромального компонента, асинхронность и акселерация созревания пиноподий, плотные межклеточные контакты, гладкая апикальная поверхность, атипичные клетки микроокружения и снижение экспрессии таких факторов роста, как лейкемия-ингибирующие факторы LIF (Leukemia Inhibitory Factor), LIF-R, CD34, VGEF A (Vascular Endothelial Growth Factor) [35].
Не меньший интерес представляют исследования М.И. Базиной (2016), где было показано, что в генезе реализации морфофункциональных дефектов эндометрия с нарушением его рецептивности лежит прогрессирующее локальное воспаление, тригером последних служит нарастание лимфоплазмоцитарной инфильтрации эндометрия, способствующей снижению уровня экспрессии рецепторов к Эс в железах и ранней гиперэкспрессии рецепторов к Пр, приводящих к прогрессированию фиброза стромы базального эндометриального паттерна [1].
Таким образом, изложенные данные позволяют заключить, что в доступной литературе отсутствуют четкие представления о патогенетических механизмах формирования «тонкого» эндометрия.
Говоря о возможных методах диагностики, следует констатировать, что офисная гистероскопия, все шире применяемая в современной амбулаторной практике, в отношении точности верификации хронического эндометрита, в т.ч. и «тонкого» эндометрия, демонстрирует недостаточно высокую чувствительность (40%) и специфичность (80%) [4]. Данный метод сам по себе не является «золотым» стандартом, и его необходимо дополнять морфологическим исследованием.
Для непрямой оценки РЭ помимо гистологической оценки его структуры в последнее время применяют такие маркеры рецептивности, как интегрин αvβ3, муцин-1, LIF, экспрессия гена HOXA10. Тест для оценки функции эндометрия (An Endometrial Function Test) позволяет оценить иммуногистохимическое состояние эндометрия с помощью особых маркеров – митотического регулятора циклина E и p27 (ингибитора циклина E). Применение маркеров РЭ пока не нашло рутинного применения, поскольку клиническая польза от применения данного диагностического метода весьма ограничена. Возможно, в будущем молекулярная оценка РЭ станет более перспективной, чем гистологическая [4].
Следует признать, что не существует и абсолютных морфологических критериев верификации нарушений РЭ.
В мировой научной литературе описаны маркеры, такие как интегрины, гликоделин, LIF, HOXA-гены, гепаринсвязывающий фактор, фактор, подобный эпидермальному фактору роста (HB-EGF – heparin-binding epidermal growth factor-like growth factor), VEGF, колониестимулирующий фактор (СSF – colony stimulating factor), ИЛ-15 и некоторые другие. Однако ни один из них не является универсальным маркером РЭ. Вероятно, фундаментальной науке предстоит лишь приблизиться к пониманию имплантации и требуются многочисленные исследования в данной области [4].
Отечественными исследователями высказывается предложение определять в эндометрии иммуногистохимическим методом уровни экспрессии LIF, TGF-β1 (Transforming growth factor beta 1) и VEGF [36] с использованием наборов антител и системы компьютерного анализа микроскопических изображений. В процессе такого анализа проводится оценка относительной площади экспрессии и оптической плотности LIF, TGF-β1 в железистом и поверхностном эпителии и в строме эндометрия как маркера РЭ [26].
Интересно, что «тонкий» эндометрий чаще наблюдается у женщин старшей возрастной группы, вероятно, из-за снижения субэндометриального кровотока. Распространенность такого рода эндометриопатии зарегистрирована у 5% женщин в возрасте <40 лет и до 25% старше 40 лет в естественных циклах [9].
В 2009 г. в рамках рандомизированного клинического испытания [14] были изучены особенности циклов ВРТ и их исходы у 175 пациенток с ТЭ<7 мм в день извлечения ооцитов. В ходе исследования пациентки были стратифицированы на три группы в зависимости от ТЭ≥4 и <5 мм; ≥5 и <6 мм; ≥6 и <7 мм. Частота наступления беременности (ЧНБ) и частота имплантации не показали статистически значимой разницы между сравниваемыми группами, хотя тенденция к увеличению вышеизложенных показателей все же наблюдалась по мере увеличения ТЭ. Кумулятивную частоту наступления клинической беременности (КЧНБ) и частоту выкидышей основной группы сравнивали с таковой у 5573 пациенток, перенесших ЭКО в тот же период, у которых ТЭ составляла ≥7 мм. Оказалось, что КЧНБ составила 26 и 51% (р<0,0001), частота выкидышей – 31 и 17% (р=0,02) у пациентов с ТЭ<7 и >7 мм соответственно. Интересно, что исследователи сравнили КЧНБ и коэффициент живорождения. У пациенток с «тонким» эндометрием они были дополнительно оценены в зависимости от возраста, числа извлеченных ооцитов и перенесенных эмбрионов.
Оказалось, что значительно лучшие результаты были получены, когда возраст пациенток не достигал 35 лет или число извлеченных ооцитов было >5, или число перенесенных эмбрионов было 3 или более. Авторы пришли к выводу, что если ТЭ<7 мм в день получения ооцитов, а число эмбрионов ≥3, то пациенткам должна быть предложена программа криоконсервации эмбрионов [14]. Несмотря на то что это исследование подтверждает мнение, согласно которому ТЭ<7 мм снижает вероятность наступления беременности, результаты, основанные на стратификации по возрасту, числу ооцитов и перенесенных эмбрионов, указывают на то, что ТЭ не является единственным определяющим фактором исхода.
Совершенно противоположная точка зрения описана в рамках систематического обзора и мета-анализа A. Kasius et al. (2014), охватившх 1170 пациенток, включенных в программы ВРТ. Авторы считают, что ТЭ в протоколах ВРТ нельзя использовать как маркер для отмены проведения протокола переноса эмбрионов, в т.ч. и криоконсервированных [33].
Согласно данным указанных авторов, частота «тонкого» эндометрия (≤7 мм) была невысокой и составила – 2,4% (260 из 10 724). Тем не менее была также отмечена тенденция к снижению КЧНБ и частоты живорождений у этих женщин (отношение шансов [ОШ]=0,38; 95% доверительный интервал [ДИ] – 0,09–1,5), т.к. вероятность клинической беременности при ТЭ≤7 мм оказалась значительно ниже, чем при >7 мм (23,3 против 48,1%, или ОШ=0,42; 95% ДИ – 0,27–0,67). Положительное прогностическое значение для наступления клинической беременности составило 77%, отрицательное – 48%. Из этого обзора можно сделать вывод: ТЭ может предсказать нам вероятность, но не может быть фактором для прогнозирования наступления беременности [33].
Между тем следует подчеркнуть, что некоторые авторы описывают отрицательное влияние контролируемой стимуляции яичников на РЭ и для улучшения имплантации рекомендуют криоконсервацию эмбрионов с последующим переносом в циклы заместительной гормонотерапии [14].
В свете сказанного интересно было изучить значение ТЭ для КЧНБ и исходов циклов переноса криоконсервированных эмбрионов. Например, в исследованиях T. El-Toukhy et al. (2008) установлено, что ТЭ=9–14 мм, измеренная в день начала прогестероновой поддержки, ассоциируется с более высокой имплантацией и КЧНБ по сравнению с ТЭ=7–8 мм [13].
Не менее интересны результаты Е. Dix и J.H. Check (2010), в ретроспективном анализе изучавших частоту наступления беременности у пациенток с ТЭ<6 мм [37]. Из 35 пациенток только 3 забеременели и две родили. Частота наступления беременности в изучаемой когорте составила 8,5%.
В то же время результаты недавнего исследования той же группы исследователей [38], сравнивавших КЧНБ между свежим и криопротоколами при ТЭ<6 мм оказались пессимистичными, КЧНБ при ТЭ=4–5 мм в свежем протоколе по сравнению с криопротоколом составила 10,6 против 27,2% (р=0,079).
Циклы донорства яйцеклеток (донации ооцитов) идеально подходят для измерения независимого эффекта ТЭ в качестве параметра эндометриальной рецептивности, поскольку существует более низкая вариабельность качества эмбрионов. В связи со сказанным небезынтересны данные L. Dain et al. (2013), изучавших влияние ТЭ на репродуктивный исход в циклах донорства ооцитов с использованием 6,0 и 8,2 мм в качестве конечной точки для включения в группу с синдромом «тонкого» эндометрия [27]. Статистически значимых различий в КЧНБ (29,6 против 30,0%) и в частоте живорождений (16,7 против 23,6%) у женщин с ТЭ<6 мм по сравнению с ТЭ>6 мм соответственно не выявлено. Однако исследователи подчеркнули, что в группе с ТЭ не более 8,2 мм наблюдалась бóльшая доля живорождений, чем при более «тонком» эндометрии. Возможно, «тонкий» эндометрий не способен поддерживать развитие беременности после имплантации, что приводит к большему числу выкидышей из-за внутриутробной смерти плода.
Качество эмбрионов играет важную роль в имплантации и является одним из определяющих факторов для исхода беременности. J.A. Gingold et al. (2015) попытались оценить взаимосвязь ТЭ и РЭ на исход беременности после переноса эуплоидных эмбрионов [22]. Перенеся только эуплоидные эмбрионы после предимплантационного генетического скрининга, авторы обнаружили, что ТЭ (≤8 против >8 мм) в день введения триггера овуляции не имела статистически значимой корреляции с КЧНБ или клиническими исходами во всех возрастных группах (23,4–44,4 года, средний – 36,1±4,0 года) ни в свежем, ни в криопротоколах.
Методы, используемые для лечения «тонкого» эндометрия, могут включать гистероскопический адгезиолиз, циклическую гормональныю терапию двумя средствами – эстрогеном (Эс) и прогестероном (Пр), вазоактивными препаратами, и технологии, включая физиотерапию, внутриматочную инфузию гранулоцитарного колониестимулирующего фактора роста и регенеративную медицину [36]. Из вышеперечисленных методов лечение экзогенными Эс – наиболее часто используемый и удобный, позволяющий увеличивать ТЭ и улучшать репродуктивные исходы [1, 12, 39].
Известно, что морфологические изменения в составных компартментах эндометрия в норме на протяжении менструального цикла проходят под воздействием Эс и Пр. Эстрадиол (Э2) — наиболее активный Эс, связываясь с α-рецепторами эстрадиола, вызывает увеличение толщины эндометриальной ткани [32].
Cледует помнить, что именно Э2 обеспечивает повышение чувствительности ткани к Пр, индуцируя экспрессию рецепторов к Пр [32]. Эпителиальные клетки эндометрия эстрогенчувствительны, но они пролиферируют не в результате прямого действия Э2. Эс действуют на стромальные клетки, способствуя синтезу ростовых факторов эпителиальных клеток, что приводит к увеличению синтеза ДНК и размножению соседних клеток эпителия. В противоположность пролиферативному эффекту Э2 Пр способствует четкой дифференцировке эндометрия [32, 40].
Наиболее значимый результат такого рода влияния Пр – инактивация Э2 через стромальные рецепторы к Пр и обеспечение подготовки эндометрия к имплантации эмбриона. Продукция и секреция богатых гликогеном субстанций эпителиальными клетками также индуцируются Пр [40].
Существует несколько путей введения Э2, прописанных в лечении синдрома «тонкого» эндометрия (пероральный, трансдермальный и вагинальный). Пероральное назначение Э2 хорошо переносится пациентками, однако следует отметить, что после перорального введения Э2 активно метаболизируется в слизистой оболочке кишечника и в печени. При этом он легко преобразуется в эстрон (Э1) и эстрон-сульфат (Э1С) с уровнем в крови Э1 в 3–6 раз выше, чем Э2. Э1 является слабым Эс с низким сродством для α- и β-рецепторов Эс. Таким образом, т.н. первичный пассаж через печень может значительно снижать ожидаемую активность Э2, вместе с тем повышая тромботический риск [41].
Очень важно подчеркнуть, что, по мнению некоторых авторов, существует понятие «минимальный период», за который рецептивный эндометрий может вырасти [40, 41]. Он составляет 5–7 дней, поэтому продолжительность назначения Э2 на 10–14 дней не абсолютна. Если ТЭ не достигает нужных параметров за этот период, применение препаратов Э2 может быть продолжено [42].
Результатами многочисленных отечественных исследований убедительно показано, что трансдермальные формы Эс могут вызывать адекватный рост эндометрия, несмотря на более низкую концентрацию Э2 в крови по сравнению с пероральными путями доставки. Исследователями был сделан вывод: трансдермальное применение Э2 благотворно влияет на РЭ [41, 43].
Эксперты междисциплинарной ассоциации специалистов репродуктивной медицины (МАРС) солидарны с изложенным выше мнением.
В протоколе указано, что при выявлении ТЭ менее 8 мм на 21–24-й день цикла получила распространение циклическая гормональная терапия двумя средствами – эстрогеном и прогестероном. Препарат Э2 рекомендуют назначать трансдермально, причем не только в первую, но и во вторую половину цикла. Во вторую фазу цикла к лечению добавляют препарат прогестерона по схеме, совпадающей с терапией НЛФ. Доза эстрадиола подбирается индивидуально в зависимости от толщины слизистой оболочки матки, в cреднем 1–4 мг/сут [44]. В то же время для клинициста важно помнить, что препараты должны назначаться в дозах, не противоречащих официальной инструкции по примененению. В связи с этим необходимо отметить, что зарегистрированные в России трасдермальные формы эстрадиола (Эстрожель и Дивигель) имеют различные ограничения по максимально допустимой суточной дозировке. Для Эстрожеля максимальная суточная доза – 3 мг [45], в то время как для Дивигеля максимально допустимая суточная доза, согласно инструкции – всего 1,5 мг/сут [51]. Таким образом, применение препарата Эстрожель во флаконе с помпой-дозатором позволяет использовать более высокие дозы, оставаясь в рамках правового поля. [45].
Существуют хирургические технологии улучшения репаративной функции эндометрия, такие как процедура эндометриального «скретчинга» с использованием офисной гистероскопии, в ходе которой предусматривается нанесение биопсийными щипцами продольных царапин (каждая длиной 20 и глубиной 2 мм) на обеих боковых и задней поверхностях матки. Установлено, что травматизация эндометрия при биопсии способствует усилению регенераторного потенциала и положительно влияет на частоту наступления клинической беременности в циклах ЭКО [4]. Предположительно существует несколько механизмов, обеспечивающих улучшение рецептивности эндометрия при его повреждении в ходе биопсии в пролиферативной фазе. Локальная травматизация, вероятно, индуцирует децидуализацию эндометрия, таким образом повышая вероятность имплантации. Наличие раневой поверхности при биопсии эндометрия служит фактором, интенсифицирующим процессы репарации, инициируя дополнительную секрецию цитокинов и факторов роста (ИЛ-11, LIF, HB-EGF), принимающих участие в процессе имплантации [4, 46].
Следует отметить, что сегодня поиск физических методов прегравидарной подготовки эндометрия при нарушении его рецептивности продолжается. Например, предложены орошение полости матки кавитированными растворами при гипопластическом эндометрии [35, 47], комплексная синхронная электротерапия, магнито-лазеро-светотерапия при хроническом эндометрите с аутоиммунным компонентом, приводящие к увеличению ТЭ и положительной динамике морфологической картины [48].
В уникальной работе Е.С. Силантьевой (2008) доказана клинико-морфологическая эффективность лечебного действия физиотерапии при синдроме «тонкого» эндометрия. Автором сделан следующий вывод: использование физических методов лечения в комплексной терапии нарушений репродуктивной функции способствует ее восстановлению у 55,3% больных, частота наступления беременности в первом цикле использования ЭКО у инфертильных женщин, ассоциированных с гипопластической дисфункцией эндометрия при предшествовавших неудачах, достигала 41,1%, при этом частота донашивания беременности при синдроме привычной потери плода на ранних сроках беременности регистрировалась у 82,4% пациенток [48].
Аналогичные позитивные изменения после применения комплексного физиотерапевтического лечения были получены в исследовании М.П. Плясуновой (2018). Автором показано достоверное увеличение ТЭ>7,0 мм в период «окна имплантации», исчезновение неоднородности эндометрия, гиперэхогенных включений в эндометрии по данным ультразвукового исследования, а также уменьшение IR<0,80 и S/D<4,5 и увеличение Vmin >2,5 см/с при допплерометрии кровотока в маточных артериях [12].
Перспективно при синдроме «тонкого» эндометрия использование с целью коррекции трофических нарушений витамина Е, L-аргинина, PRP (Platelet Rich Plasma)-терапии, силденафила цитрата: гистологически доказан рост железистого эпителия и улучшение васкулогенеза, экспрессии сосудистых факторов роста, но пока недостаточно рандомизированных клинических испытаний [39, 49]. Целесообразна при синдроме «тонкого» эндометрия, но не доказана терапия аспирином и омега-3 при верифицированной недостаточности маточной перфузии [4, 50].
Заключение
Таким образом, варианты совершенствования подготовки женщин к имплантации эмбриона после неудач в циклах ВРТ в научной литературе обсуждаются активно, однако с позиций анализа синдрома «тонкого» эндометрия данная тема далека от окончательного решения. В мире до сих пор отсутствует единая методология определения РЭ – все диагностические маркеры имеют недостаточную доказательную базу в плане интерпретации результатов, трудно воспроизводимы в рутинной клинической практике. Улучшение диагностических возможностей в отношении РЭ позволит в будущем повысить эффективность преодоления репродуктивных неудач, ассоциированных с синдромом «тонкого» эндометрия.



