Гормональные контрацептивы (ГК), содержащие синтетические аналоги половых стероидов, считаются самыми эффективными обратимыми методами предохранения от нежелательной беременности [1–4]. В то же время опыт их применения выявил негативное влияние комбинированных эстроген-гестагенных препаратов на риск тромбофилических осложнений, как венозных, включая тромбоз глубоких вен и тромбоэмболию легочной артерии, так и артериальных, включая острый инфаркт миокарда и инсульт [2, 5–7].
В настоящее время доказано, что частота артериальных тромбозов повышается только при применении высокодозированных ГК, содержащих дозу этинилэстрадиола более 40 мкг в сутки. При использовании молодыми здоровыми женщинами современных низкодозированных эстроген-гестагенных препаратов с дозой этинилэстрадиола менее 40 мкг в сутки повышения частоты острого инфаркта миокарда и ишемического или геморрагического инсульта выявлено не было [8, 9].
Значимое влияние на развитие артериальных тромботических осложнений оказывают возраст старше 40 лет, гипертония, дислипидемия, ожирение и сахарный диабет. Все они, сами являясь независимыми факторами риска сердечно-сосудистых заболеваний, могут увеличивать риск развития инсульта и инфаркта у женщин, использующих ГК, содержащие синтетический эстроген этинилэстрадиол [10–15].
Одной из актуальнейших проблем здравоохранения остается курение, с которым также ассоциирован высокий риск артериальных тромботических осложнений. Так, по данным Всемирной организации здравоохранения [8, 16], количество случаев развития инфаркта миокарда серди некурящих женщин моложе 35 лет, как принимающих, так и не принимающих ГК-препараты, составляет 4 на 10 тыс. женщин в год. У курящих молодых женщин, при этом не использующих методы гормональной контрацепции, показатель артериальных тромбозов в 2 раза выше и повышается с возрастом еще в 20 раз. При приеме комбинированных контрацептивов женщинами молодого возраста курение увеличивает частоту артериальных тромботических осложнений в 10 раз, составляя около 40 случаев на 10 тыс. женщин в год, а у женщин после 35 лет – в сотни раз, составляя 485 случаев на 10 тыс. женщин в год.
За последние годы появились данные о некотором увеличении частоты артериальных тромбозов у женщин старше 35 лет, принимающих дроспиренон-содержащие комбинированные пероральные контрацептивы [17, 18], но эти данные требуют дополнительного анализа.
За последние годы проведено несколько крупных исследований, оценивавших возможный риск венозных тромботических осложнений, таких как тромбоэмболия легочной артерии и тромбоз глубоких вен голени, при применении различных видов ГК [5, 17, 19, 20]. Было установлено, что в отличие от артериальных тромбозов вероятность венозных осложнений повышается (преимущественно тромбозов глубоких вен), но значительно меньше, чем при беременности и в послеродовом периоде.
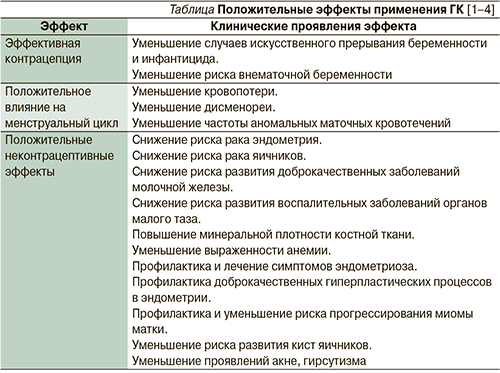
Так, среди женщин репродуктивного возраста, не курящих и не принимающих ГК, относительный риск развития венозных тромбозов составляет, по разным данным, от 2,1 до 4,7 случая на 10 тыс. женщин в год. Во время беременности этот риск возрастает в среднем в 6 раз и составляет 9,5–30,0 случаев на 10 тыс. женщин в год. За первые 6–8 недель послеродового периода частота венозных тромбозов увеличивается еще более значимо – в 14 раз – и оценивается разными авторами от 19,4 до 50,0 случаев на 10 тыс. женщин в год [5, 21–24].
При использовании ГК частота венозных тромбоэмболий составляет от 6,0 до 9,9 случая на 10 тыс. женщин в год, что в 1,5–2,0 раза больше, чем у не применяющих ГК женщин репродуктивного возраста [5, 17, 21, 24, 25]. При этом данный показатель значительно варьируется в зависимости от дозы и вида эстрогенного компонента, вида прогестагена, пути введения и наличия дополнительных факторов риска венозных тромбоэмболий [7, 16, 17, 21, 25, 26].
Наибольший вклад в развитие сосудистых венозных осложнений вносит патология свертывающей системы крови, причем как приобретенная (антифосфолипидный синдром), так и наследственная (мутация V-фактора Лейдена, в гене протромбина, дефицит протеина С, S и антитромбина III). Самым неблагоприятным, увеличивающим риск венозных тромбоэмболий в 10–30 раз при приеме комбинированных ГК, является наследственная мутация V-фактора Лейдена и гена протромбина [7, 24, 27].
Варикозная болезнь не относится к дополнительным факторам риска развития как венозных, так и артериальных тромбозов у женщин, использующих гормональные методы предохранения от беременности [28, 29].
Созданные за последние годы контрацептивы, содержащие вместо этинилэстрадиола другие синтетические производные эстрогены, эстрадиола валерат или 17β-эстрадиол, также не оказывают неблагоприятного влияния на факторы свертывания крови. Риск тромбофилических осложнений при их приеме такой же, как у женщин репродуктивного возраста, не использующих гормональных методов контрацепции [29–31]. Но в связи с отсутствием длительных масштабных исследований, подтверждающих их безопасность (в составе ГК они применяются сравнительно недавно), в рекомендациях ВОЗ [2] оральные контрацептивы с новыми эстрогенами объединены в общую группу с этинилэстрадиол-содержащими средствами.
Этинилэстрадиол в отличие от эстрадиола валерат и 17β-эстрадиола дозозависимо увеличивает коагуляционный потенциал свертывающей системы крови [32]. Низкодозированные средства, содержащие менее 40 мкг синтетического эстрогена, оказывают слабое влияние на свертывающую систему, изменения ее показателей происходят в пределах 10–15 % и, как правило, не выходят за нормативные значения [33, 34].
Возможным механизмом тромботического влияния этинилэстрадиола является его повышенная резистентность к активированному протеину С, отвечающему за антикоагулянтное звено гемостаза [35]. Косвенным маркером нарушения антикоагулянтного потенциала расценивается сывороточный уровень глобулина, связывающего половые стероиды (ГСПС) [18, 36]. Этинилэстрадиол дозозависимо увеличивает выработку в печени данного транспортного белка, при этом в циркулирующей крови с ним практически не связывается, что ведет к увеличению сывороточного уровня ГСПС [32].
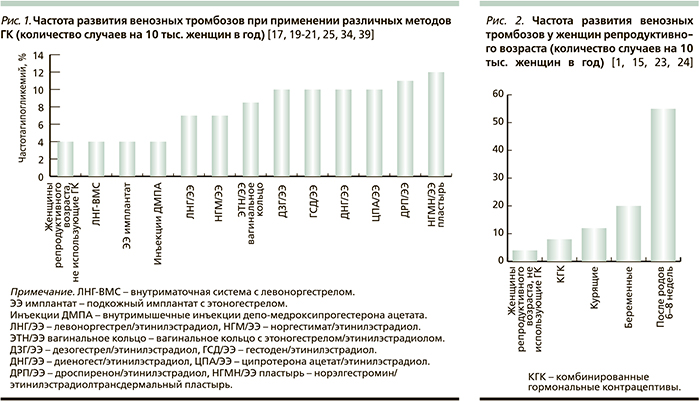
Входящие в состав комбинированных контрацептивов синтетические гестагены также влияют на уровень ГСПС, как потенцируя стимулирующее действие на него этинилэстрадиола, так и блокируя [18, 34]. Наибольшей антиэстрогенной активностью в отношении ГСПС обладает левоноргестрел. При приеме комбинированных препаратов, содержащих этинилэстрадиол с левоноргестрелом, сывороточный уровень ГСПС не отличается от такового у женщин, не применяющих ГК. Другие сочетания гестагенов с этинилэстрадиолом приводят к повышению концентрации ГСПС в крови. Так, контрацептивы, содержащие этинилэстрадиол в сочетании с дезогестрелом, гестоденом, норгестиматом или дроспиреноном, увеличивают этот показатель в 3 раза, с диеногестом или ципротерона ацетатом – в 4–5 раз [18, 36]. При применении пролонгированных методов комбинированной гормональной контрацепции сывороточный уровень ГСПС также повышается. Наибольшее неблагоприятное влияние на уровень ГСПС оказывает трансдермальный пластырь с этинилэстрадиолом и норэлгестромином (рис. 1) [37, 38].
В отличие от эстроген-содержащих средств чисто прогестагенные контрацептивы не оказывают неблагоприятного влияния на сывороточный уровень ГСПС [18, 36] и на риск тромбофилических осложнений [39]. При применении таблетированных форм, содержащих только гестагены [40], внутримышечных инъекций медроксипрогестрона ацетата [41], подкожных имплантатов, содержащих этоногестрел [42, 43], а также внутриматочной рилизинг-системы с левоноргестрелом [41], риск венозных и артериальных тромбофилических осложнений такой же, как для женщин, не использующих методы гормональной контрацепции.
Частота тромбофилических осложнений при применении низкодозированных комбинированных контрацептивов с этинилэстрадиолом составляет в среднем 6–14 случаев на 10 тыс. женщин в год и напрямую зависит от гестагенной составляющей. Наименьший риск венозных тромбозов среди комбинированных оральных контрацептивов с этинилэстрадиолом имеют средства, содержащие в качестве прогестагенного компонента левоноргестрел и норгестимат. Частота развития венозных тромбоэмболий при их применении составляет 6–8 случаев на 10 тыс. женщин в год [9, 17, 21]. Препараты с дезогестрелом, гестоденом, диеногестом и ципротероном ассоциируются с более высокой частотой развития венозных тромбозов: 9–12 случаев на 10 тыс. женщин в год [19, 21]. Наивысший тромбофилический риск имеют этинилэстрадиол-содержащие препараты с дроспиреноном, показатель которого превышает аналогичный у средств с левоноргестрелом в 1,5–2,0 раза [17, 20, 21, 34], хотя не всеми исследованиями это подтверждается [22, 25].
Применение трансдермального пластыря, содержащего этинилэстрадиол и норэлгестромин, сопровождается 9–14 случаями венозных тромбозов на 10 тыс. женщин в год, что в 2 раза больше, чем при применении орального препарата с аналогичным составом. У вагинального кольца, содержащего этинилэстрадиол и этоногестрел, наоборот, частота венозных тромбозов по сравнению с таблетированными препаратами, содержащими дезогестрел, метаболитом которого служит этоногестрел, и этинилэстрадиол в той же дозе, риск венозных осложнений в 1,5 раза ниже и составляет 6–11 случаев на 10 тыс. женщин в год [19, 39].
B целом степень влияния современных низкодозированных ГК на риск развития венозных тромботических осложнений, несмотря на некоторые различия, связанные с составом препарата, в 1,5–2,0 раза меньше, чем у курящих женщин, и значительно уступает имеющемуся риску при бере-менности и в послеродовом периоде (рис. 2) [1, 15, 23, 26]. При этом потенциальная польза от их применения превышает все возможные риски для здоровых женщин моложе 40 лет (см. таблицу).
Своевременное назначение индивидуально подобранного контрацептивного средства не только предотвращает наступление нежеланной беременности, но и оказывает существенное положительное влияние как на репродуктивное, так и на общее здоровье современной женщины [1–4].



