Введение
В последние годы наблюдается возрастающий интерес к проблеме тромботических микроангиопатий (ТМА) в нефрологии, что в первую очередь обусловлено расширяющимся спектром ТМА с преимущественным поражением почек и развитием острого почечного повреждения (ОПП), клиническое течение которого нередко напоминает быстропрогрессирующий гломерулонефрит (БПГН) [1].
ТМА представляет собой гетерогенную группу заболеваний, объединенных общностью клинико-гистологических проявлений, но различных по патогенезу. Основой ТМА является комплекс морфологических признаков, формирующих картину ишемического повреждения органов и тканей вследствие микроциркуляторного тромбообразования. Клиническими признаками ТМА служат микроангиопатическая (Кумбс-негативная) гемолитическая анемия, тромбоцитопения, поражение ЦНС и почек, чаще всего проявляющееся ОПП [2]. В подавляющем большинстве случаев именно почки являются мишенью микроангиопатического тромбообразования, однако нередко патологический процесс приобретает генерализованный характер с развитием полиорганного поражения.
Классификация тромботических микроангиопатий, предложенная Европейской педиатрической группой по изучению гемолитико-уремического синдрома в 2006 г., включает все формы ТМА, известные сегодня. Среди них выделены первичные ТМА с установленным механизмом развития и вторичные или ассоциированные с определенными заболеваниями и клиническими состояниями ТМА, механизмы развития которых на сегодняшний день до конца не изучены [3]. Основные формы ТМА включают инфекционную, шига-токсин-индуцированную ТМА или STEC-ГУС, атипичный гемолитико-уремический синдром (аГУС), обусловленный комплемент-опосредованным повреждением эндотелия сосудов в результате дисрегуляции альтернативного пути активации комплемента (АПК), явившейся следствием генетических аномалий, и тромботическую тромбоцитопеническую пурпуру (ТТП), ассоциированную с врожденным или приобретенным дефицитом фермента ADAMTS13, расщепляющего сверхкрупные мультимеры фактора Виллебранда. Несмотря на очевидный прогресс в понимании патогенеза основных форм ТМА, внедрение алгоритмов ее диагностики и новых методов лечения, летальность и риск необратимых инвалидизирующих поражений жизненно важных органов остаются высокими. Так, процент пациентов с аГУС, достигших терминальной почечной недостаточности и оставшихся диализ-зависимыми после первого эпизода комплемент-опосредованной ТМА, достигает 50%, несмотря на своевременно начатое лечение [4].
Наряду с основными формами известны также ТМА, ассоциированные с такими заболеваниями и клиническими состояниями, как злокачественная артериальная гипертензия (ЗАГ), ВИЧ-инфекция, злокачественные новообразования, беременность, системная красная волчанка (СКВ), антифосфолипидный синдром (АФС), системная склеродермия, трансплантация солидных органов, прием различных лекарственных препаратов, в т.ч. циклоспорина и оральных контрацептивов. Клинико-морфологическая мимикрия тромботических микроангиопатий зачастую не позволяет четко дифференцировать одну нозологическую форму ТМА от другой, что затрудняет своевременную диагностику и отсрочивает начало лечения этих больных [5].
Кроме того, в клинической практике нефрологов все чаще стали наблюдаться случаи выявления морфологической картины ТМА у пациентов, течение заболевания у которых не укладывается в классические представления о ТМА. Их заболевание проявляется развитием в молодом возрасте злокачественной или тяжелой артериальной гипертензии (АГ), по течению приближающейся к ЗАГ, с поражением ЦНС, сердца, органа зрения, но в первую очередь почек, признаком которого чаще всего является ОПП или быстронарастающая почечная недостаточность, предотвратить прогрессирование которой в ряде случаев не может даже удовлетворительный контроль АД. Важной особенностью этой формы болезни является отсутствие гематологических проявлений, хотя морфологическое исследование ткани почки выявляет характерную картину ТМА [6].
Среди факторов, ассоциированных с развитием ТМА, ЗАГ занимает особое место как проблема малоизученная, однако нередко приводящая к катастрофическим последствиям: до настоящего времени ежегодная смертность больных ЗАГ в 13 раз выше таковой нормотензивных пациентов [7]. Возможные механизмы развития ТМА при ЗАГ до конца не изучены, и подходы к ее патогенетической терапии четко не определены. До настоящего времени предметом дискуссий остается вопрос: является ли ТМА причиной или следствием ЗАГ?
В связи с этим в настоящей статье мы хотели бы предложить клинические наблюдения, иллюстрирующие особенности ТМА, ассоциированной с злокачественной АГ, у молодых лиц.
П а ц и е н т № 1 32 лет, ИМТ – 25,8 кг/м2.
С подросткового периода беспокоили редкие головные боли. Повышений АД более 130/80 мм рт.ст. зарегистрировано не было. С 2010 г. (27 лет) наблюдался урологами по поводу мочекаменной болезни. За период наблюдения перенес три эпизода почечной колики, однократно проводилась дистанционная литотрипсия. Значения АД в этот период не известны.
В сентябре 2015 г. вскоре после перенесенного острого бронхита отметил появление и нарастание слабости, одышку. При обращении к врачу впервые зарегистрировано повышение АД до 280/170 мм рт.ст., в связи с чем госпитализирован в клинику кардиологии Первого МГМУ им. И.М. Сеченова. При обследовании впервые выявлены признаки нарушения функции почек – креатинин крови (СКр) 5,57 мг/дл, рСКФ 12 мл/мин, азот мочевины 25,7 ммоль/л, мочевая кислота 703 мкмоль/л, калий 6,0 ммоль/л. Мочевой синдром был представлен минимальной изолированной протеинурией (ПУ) – 0,18 г/л. В общем анализе крови гемоглобин – 148 г/л, тромбоциты – 381 тыс/мкл. Активность ренина плазмы 41,7мг/мл/ч (N 0,06–4,69), альдостерон 369 пмоль/л (N 25–315).
УЗИ выявило нормальные размеры почек (правая 107×50 мм, левая 104×46 мм) с ровными четкими контурами, толщиной паренхимы до 18 мм, сохраненной кортико-медуллярной дифференциацией. Кровоток до корковых отделов, ЧЛС не расширены, конкременты не выявлены.
На ЭКГ – признаки гипертрофии левого желудочка (ГЛЖ) с нарушением процессов реполяризации.
При эхокардиографическом исследовании (ЭхоКГ) выявлены дилатация левого предсердия (размер=5,0 см [норма до 4 см], объем=110 мл [норма до 65 мл]), выраженная концентрическая гипертрофия левого желудочка, больше задне-боковой стенки (МЖП=1,7 см, ЗСЛЖ=1,9–2,0 см [норма до 1,1 см], ИММЛЖ – 224 г/м2), диффузный гипокинез, снижение глобальной систолической функции (фракция выброса=35%, локальная сократимость ЛЖ не нарушена), митральная регургитация 1-й степени.
Учитывая сочетанное поражение сердца и почек у молодого человека, в круг дифференциальной диагностики была включена болезнь Фабри, однако результаты дополнительного обследования не подтвердили этот диагноз. Для контроля АД пациенту были назначены амлодипин и доксазозин, что, однако, не привело к коррекции АГ (АД – 170/110 мм рт.ст.).
Для дальнейшего обследования и уточнения характера поражения почек был направлен в нефрологическое отделение клиники им. Е.М. Тареева.
При поступлении констатирована рефрактерная к терапии АГ, поскольку, несмотря на регулярный прием антигипертензивных препаратов, АД оставалось на уровне 180/140 мм рт.ст. Сохранялись нормальные показатели гемоглобина и тромбоцитов (132 г/л и 363 тыс/мкл соответственно), прежняя выраженность почечной недостаточности (СКр – 5,53 мг/дл) и мочевого синдрома (ПУ – 0,2 г/л, СПУ – 0,8 г/сут).
В ходе обследования были исключены системные заболевания: СКВ, АФС, ANCA-васкулит, узелковый полиартериит, системная склеродермия, эндокринная патология (эндогенный гиперкортицизм, первичный гиперальдостеронизм), а также коарктация аорты. Для исключения вазоренальной АГ, несмотря на крайне низкие показатели рСКФ, выполнена МР-ангиография с контрастным усилением, выявившая стеноз левой почечной артерии. Однако степень стеноза не превышала 30%, в связи с чем от имплантации стента было решено воздержаться.
Характер патологии почек оставался неясным, поскольку 30%-ный односторонний стеноз почечной артерии не мог объяснить развитие ЗАГ с тяжелым поражением сердца и почек у молодого человека. Высказано предположение о возможной ТМА, в связи с чем проведена нефробиопсия. Препарат для световой микроскопии представлен маленьким фрагментом почечной ткани, содержащим 3 клубочка, 1 из которых полностью склерозирован. Еще в одном клубочке – ишемия капиллярных петель. Оставшийся клубочек выглядит малоизмененным. Пролиферативные изменения отсутствуют. Стенки капиллярных петель не утолщены, одноконтурные. Диффузно-очаговый склероз, интерстиция и атрофия канальцев (около 20% площади паренхимы). Неспецифическая лимфогистиоцитарная инфильтрация интерстиция в зонах склероза. Просвет артериол и артерий малого калибра резко сужен вплоть до полной окклюзии за счет мукоидного набухания и склероза интимы. При иммунофлюоресценции депозиты иммунореактантов не выявлены. Заключение: гипертонический нефроангиосклероз с элементами тромботической микроангиопатии.
На основании клинической картины заболевания и данных морфологического исследования ткани почки установлен диагноз «тромботическая микроангиопатия, ассоциированная со злокачественной артериальной гипертензией». Подобрана 4-компонентная антигипертензивная терапия (амлодипин, небиволол, доксазозин, моксонидин), позволившая впервые с начала заболевания снизить АД до 150/100 мм рт.ст. После выписки состояние больного сохранялось стабильным, АД контролировалось на уровне 140–150/90–100 мм рт.ст. с редкими эпизодами повышения до 170/100 мм рт.ст.
В марте 2016 г. повторно госпитализирован в клинику им. Е.М. Тареева для динамического обследования. При поступлении АД 150/100 мм рт.ст. Отмечена значимая положительная динамика со стороны функции почек и сердца: двукратное по сравнению с исходным снижение уровня СКр до 2,76 мг/дл, увеличение рСКФ до 30 мл/мин, полное восстановление сократительной способности миокарда и нормализация систолической функции левого желудочка (фракция выброса – 57%). Для уточнения характера поражения сердца проведена перфузионная томосцинтиграфия миокарда, выявившая отчетливое включение индикатора в миокард ЛЖ с диффузно неравномерным распределением (рис. 1). Полость желудочка не расширена, визуальные признаки гипертрофии миокарда не выражены. Включение индикатора в миокард правого желудочка незначительно (пренебрежимо мало). Заключение: сцинтиграфическая картина диффузных нарушений перфузии миокарда.
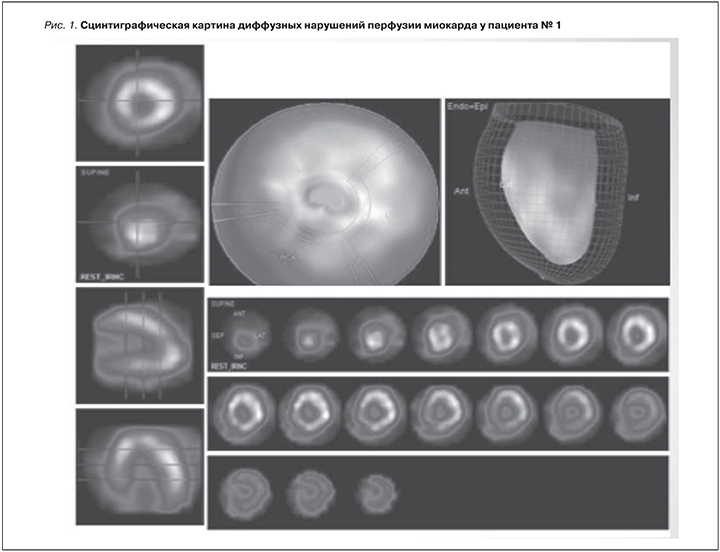
Выявленные при сцинтиграфии, выполненной спустя 3 месяца от стабилизации АД и купирования острой сердечной недостаточности перфузионные нарушения, на наш взгляд, могут быть косвенным свидетельством дефекта микроциркуляции в рамках ТМА миокарда.
В поисках дополнительных факторов, способствовавших развитию ТМА, пациенту было выполнено исследование полиморфизма генов системы гемостаза, выявившее гетерозиготные мутации в генах ингибитора активатора плазминогена (PAI-1: 675 5G>4G), рецептора гликопротеина 1а (ITGA2: 807 С>T), метилентетрагидрофолатредуктазы в 2 локусах (MTHFR: 1298 A>C; 677 C>T ), метионинсинтазы-редуктазы (MTRR: 66 A>G) и метионинсинтазы (MTR: 2756 A>G).
Гомоцистеин 20,4 мкмоль/л (N 5,46–16,20)
По данным коагулограммы: ПИ – 94 (N 85–110%), фибриноген – 3,96 (N 1,8–4,5) г/л, РКФМ – 3,5 г/л (N<5,5), Д-димер – 0,08 (N<0,5) мкг/мл.
С антитромботической и ангиопротективной целью пациенту было назначено лечение сулодексидом 250 ЛЕ дважды в сутки.
В настоящий момент в ходе продолжающейся терапии показатели АД сохраняются на уровне 140/90 мм рт.ст. Показатели функции почек стабильны (креатинин – 267 мкмоль/л, рСКФ – 26 мл/мин). Hb – 155 г/л, тромбоциты – 256 тыс/мкл. ПУ – 0,5 г/л.
Резюме: Предложенное наблюдение ЗАГ, ассоциированной c ТМА, полностью соответствует представлению об этой патологии: пациент – молодой мужчина, у которого при характерной морфологической картине ТМА отсутствуют ее гематологические признаки, АГ отличается резистентностью к многокомпонентной антигипертензивной терапии и сопровождается поражением органов-мишеней – почек и сердца. Однако наличие 30%-ного стеноза левой почечной артерии оказалось необычной особенностью заболевания, обусловившей необходимость дальнейшего обследования для исключения генетической тромбофилии.
П а ц и е н т № 2 28 лет. ИМТ – 22 кг/м2.
С 18 лет злостный курильщик (курил около 1 пачки сигарет в сутки). В 2008 г. (21 год) обратился к врачу по поводу внезапно появившейся резкой слабости. При обследовании выявлена тяжелая анемия (Hb – 55 г/л), обусловленная кровотечением из язвы антрального отдела желудка, в связи с чем выполнена резекция желудка. Послеоперационный период и реабилитация протекали благоприятно. Впоследствии к врачам не обращался, гемоглобин не контролировал. До октября 2015 г. чувствовал себя удовлетворительно.
В октябре 2015 г. после многочасовой езды за рулем автомобиля отметил выраженную слабость, одышку при умеренной физической нагрузке. Обратился к врачу. Впервые отмечено повышение АД до 240/140 мм рт.ст. При амбулаторном обследовании СКр 140 мкмоль/л, мочевой синдром в виде изолированной ПУ 0,45 г/л. Диагностирован хронический пиелонефрит, назначена терапия уроантисептиками. Для контроля АД принимал 10 мг конкора без существенного эффекта.
К декабрю 2015 г. отметил нарастание слабости и одышки вплоть до ортопноэ, резкое ухудшение зрения на оба глаза. При обследовании обнаружено нарастание СКр до 581 мкмоль/л, в связи с чем госпитализирован в нефрологический стационар по месту жительства.
При поступлении состояние средней степени тяжести. АД – 170/110 мм рт.ст. В анализах: Hb – 96 г/л, тромбоциты – 292 тыс/мкл, ЛДГ – 156 МЕ/л, АСТ – 39, АЛТ – 53, общий билирубин – 5,0 мкмоль/л, общий белок – 64 г/л, общий холестерин – 5,1 ммоль/л. Уровень СКр составил 476 мкмоль/л, рСКФ – 13 мл/мин (CKD-EPI). Определялся мочевой синдром в виде изолированной ПУ – 1,1 г/сут.
Принимая во внимание быстрое нарастание почечной недостаточности у молодого пациента, обсуждался диагноз БПГН идиопатического или в рамках системного заболевания. В ходе обследования получены отрицательные результаты антител к ДНК, АНФ, ANCA, антифосфолипидных антител, нормальные значения С3- и С4-компонентов комплемента: 1,4 г/л (0,9–1,8) и 0,4 г/л (0,1–0,4) соответственно, что позволило исключить диагнозы СКВ, АФС, ANCA- васкулита.
По данным УЗИ – почки расположены симметрично, в типичных местах, с ровными четкими контурами, размерами: ПП – 9,6×4,9×4,2 см, ЛП – 9,9×5,3×4,4 см, подвижность не изменена, почечные синусы не расширены, паренхима толщиной 1,6 см. В паренхиме нижнего сегмента правой почки визуализируется единичная киста диаметром 1,6 см, в паренхиме левой почки – несколько мелких кист от 0,6 до 1,0 см, на остальных участках эхоструктура паренхимы почки сохранная, корковый слой не менее 0,5–0,6 см, диффузно повышенной эхогенности, ЧЛС не расширена, конкрементов не обнаружено.
При ЭхоКГ выявлены признаки гипертрофии миокарда ЛЖ (ТМЖП – 1,4 см, ТЗСЛЖ – 1,2 см), дилатации ЛП (4,4 см). Недостаточность митрального клапана 2-й степени и трикуспидального клапана 2–3-й степени. Легочная гипертензия 3-й степени (СДЛА – 60 мм рт.ст.), ФВ – 60%.
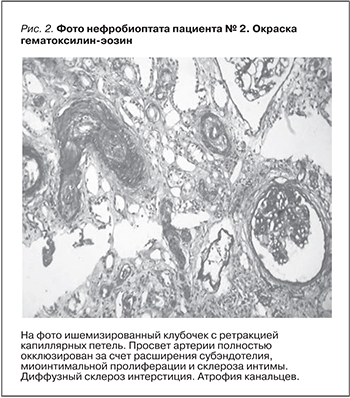 Для уточнения диагноза выполнена пункционная биопсия почки (рис. 2).
Для уточнения диагноза выполнена пункционная биопсия почки (рис. 2).
В препарате 6 клубочков, 1 из которых полностью склерозирован. Во всех оставшихся клубочках отмечается ишемия капиллярных петель различной степени выраженности. Диффузный склероз интерстиция и атрофия канальцев, занимающие более 50% почечной паренхимы. Диффузно очаговая инфильтрация интерстиция в зонах склероза. Некоторые атрофичные канальцы кистозно расширены, содержат белковые цилиндры. Артерии – выраженный артериосклероз с гиперплазией медии, расширением субэндотелиального пространства и выраженным сужением просвета сосудов. Гипертрофия мышечного слоя. В артериях малого калибра и артериолах просвет сосудов резко сужен вплоть до полной окклюзии за счет набухания эндотелиальных клеток, артериологиалиноза, миоинтимальной пролиферации и склероза интимы. Иммунофлюоресценция: не выявлено депозитов IgG, A, M, C3, k λ, Заключение: тромботическая микроангиопатия. Несмотря на морфологическую верификацию ТМА, диагноз вызывал определенные затруднения. Отсутствие лабораторных признаков микроангиопатического гемолиза (анемия с нормальными показателями ЛДГ, без шизоцитоза) и тромбоцитопении не позволяли уверенно диагностировать атипичный ГУС. ТТП была исключена на основании лишь незначительного снижения активности ADAMTS13, составившей 67% (норма – 80–113%). Наличие мультигенной формы тромбофилии (MTRR 66 G/G; MTHFR 677 C/T, PAI-1 -675 5G/4G), выявленной при генетическом исследовании системы гемостаза и представленной гетерозиготной мутацией гена ингибитора активатора плазминогена в сочетании с двумя полиморфизмами генов фолатного цикла, могло внести дополнительный вклад в развитие ТМА, но вряд ли оказалось его единственной причиной.
После тщательного анализа особенностей течения и клинико-морфологической картины заболевания пациенту был установлен диагноз тромботической микроангиопатии, ассоциированной со злокачественной артериальной гипертензией. В связи с наличием лабораторных признаков гиперкоагуляции: ПВ – 13,0 с (12–20); МНО – 1,0 (0,8–1,2); АЧТВ – 26 с (24–35), фибриноген7,0 г/л (1,8–4,0), назначена терапия малыми дозами низкомолекулярных гепаринов (НМГ) (Фраксипарин 0,3 мл/сут), антигипертензивная терапия конкором 5 мг/сут и амлодипином 10 мг/сут. Для дальнейшего обследования и лечения госпитализирован в клинику им. Е.М. Тареева спустя 2 недели от начала лечения НМГ (январь 2016 г.).
Несмотря на кратковременность лечения, при поступлении отмечал исчезновение одышки и улучшение зрения. Значения АД составили 150/90 мм рт.ст. По данным лабораторного обследования отмечена тенденция к снижению СКр (3,69 мг/дл) и нарастанию гемоглобина (Hb – 105 г/л). Признаки микроангиопатического гемолиза и тромбоцитопения отсутствовали (тромбоциты – 375 тыс/мкл, ЛДГ – 289 ЕД/л, гаптоглобин – 1,57 г/л (N 1,00–3,2 г/л).
Учитывая выявленные ранее признаки поражения сердца, пациенту выполнено перфузионное томосцинтиграфическое исследование миокарда, которое выявило отчетливое включение индикатора в миокард ЛЖ с диффузно неравномерным распределением, свидетельствующее о диффузных нарушениях перфузии миокарда.
При ЭхоКГ отмечена положительная динамика в виде исчезновения легочной гипертензии, уменьшения недостаточности МК и ТК до 1-й степени.
Пациент консультирован офтальмологом, обнаружившим тяжелые изменения сетчатки обоих глаз. При фундоскопии – V OD=0,7 не корр; V OS=0,9 не корр. Глазное дно: OU-ДЗН гиперемирован, границы стушеваны, отек сетчатки перипапиллярно.
В макулярной области множественные мелкие очажки, образующие фигуру звезды. Артерии резко сужены. Вены извиты. Единичные геморрагии по ходу сосудов. Заключение: OU-нейроретинопатия в рамках основного заболевания.
Пациенту было рекомендовано продолжить проводимую терапию амбулаторно под динамическим наблюдением нефролога.
При обращении в клинику в мае 2016 г. сохранялась положительная динамика со стороны показателей функции почек (снижение СКр до 2,9 мг/дл, увеличение СКФ до 28 мл/мин). Hb – 138 г/л, тромбоциты – 315 тыс/мкл. Показатели АД сохранялись стабильными на уровне 140/90 мм рт.ст.
Резюме. Представленное наблюдение, как и первое, демонстрирует характерную клинико-морфологическую картину злокачественной АГ, ассоциированной с ТМА. У пациента имеется поражение трех органов-мишеней, включая почки, сердце и глаза, в отсутствие гематологических проявлений ТМА. Наличие в анамнезе язвы желудка, осложнившейся кровотечением, у молодого (21 год) пациента также дает основание обсуждать возможность развития ее в рамках ТМА, причина которой нуждается в уточнении.
Обсуждение
Злокачественная артериальная гипертензия – клинический синдром, характеризующийся тяжелой диастолической АГ (ДАД>120 мм рт.ст.), которая сопровождается ишемическим повреждением почек, сердца, головного мозга, глаз и может проявляться ОПП, острой сердечной недостаточностью или острым коронарным синдромом, острым нарушением мозгового кровообращения, ретинопатией и в ряде случаев признаками ТМА – микроангиопатическим гемолизом и тромбоцитопенией [7]. Именно полиорганным поражением – почек, сердца и в одном случае глаз, однако без гематологических признаков ТМА проявлялось заболевание у наших пациентов (см. таблицу).
Достижения в изучении патогенетических механизмов АГ и обусловленные ими современные терапевтические подходы привели к изменению взглядов на ЗАГ. Если раньше основной причиной последней считали нелеченную или резистентную к немногочисленным по тем временам лекарственным средствам эссенциальную АГ, то в течение последних десятилетий развитие злокачественной АГ связывают в первую очередь с наличием паренхиматозной почечной патологии, что особенно справедливо в отношении тяжелой АГ, возникающей у молодых (до 35 лет) пациентов [8]. В большинстве случаев злокачественной АГ имеется поражение почечного микроциркуляторного русла – тромботическая микроангиопатия, лежащая в основе ГУС (STEC-ГУС и особенно аГУС), ТТП, склеродермического почечного криза, АФС-ассоциированной нефропатии. Однако признаки микроангиопатического гемолиза и тромбоцитопению обнаруживают далеко не у всех пациентов с ЗАГ, из-за чего ассоциация последней с ТМА до последнего времени не привлекала достаточного внимания, хотя гистологическая картина ТМА характерна для ЗАГ с поражением почек. Так, полный симптомокомплекс ТМА, по данным B-J.Van den Born и соавт., был выявлен лишь у 27% из 97 больных злокачественной АГ с почечной недостаточностью [9]. При этом морфологические признаки поражения почек у большинства пациентов были представлены обструктивной васкулопатией, фибриноидным некрозом сосудистой стенки и интралюминальным тромбозом междольковых артерий, что, несомненно, укладывается в картину ренальной ТМА. До настоящего времени частота системной ТМА при ЗАГ точно не установлена, что, по-видимому, обусловлено разницей в частоте выявления клинических и морфологических признаков ТМА при этой патологии. С другой стороны, полагают, что ЗАГ развивается приблизительно у 13% пациентов с ТМА [10]. В случаях, когда диагнозы аГУС, ТТП, АФС-нефропатии, острой склеродермической нефропатии и других заболеваний, сопровождающихся развитием ЗАГ, исключены, а в биоптате почки имеются признаки ТМА, считается возможным устанавливать диагноз «ТМА, ассоциированная с ЗАГ».
У обоих представленных нами пациентов с не вызывающей сомнения ЗАГ имело место тяжелое ишемическое поражение почек, обусловленное характерной морфологической картиной ТМА в отсутствие гематологических ее проявлений. Ишемический генез нефропатии был подтвержден не только результатами биопсии почки, но и лабораторными данными, свидетельствующими об активации РААС, характерной для ЗАГ (высокие активность ренина плазмы и уровень альдостерона), у первого пациента. Хотя у второго пациента и наблюдалась анемия, она не носила микроангиопатического характера, в пользу чего свидетельствуют нормальные показатели ЛДГ и гаптоглобина, а число тромбоцитов при динамическом наблюдении в обоих случаях ни разу не достигло даже нижней границы нормы. Активность ADAMTS13, определенная у второго пациента, оказалась лишь несколько сниженной, что наблюдается при любой ТМА (кроме ТТП, при которой она составляет менее 10%), и отражает потребление этой металлопротеазы в локальных процессах микроциркуляторного тромбообразования. Ни у одного из пациентов, таким образом, не было достаточных оснований для установления диагноза первичной ТМА – ТТП или аГУС, а все вторичные ТМА были исключены в ходе обследования. Именно поэтому в обоих случаях мы установили диагноз «тромботическая микроангиопатия, ассоциированная со злокачественной АГ».
Обращает на себя внимание феномен неполной ТМА у наших больных ЗАГ. Несмотря на несомненную морфологическую картину ренальной ТМА, у обоих полностью отсутствовала гематологическая составляющая данного синдрома. Отсутствие тромбоцитопении и реже – микроангиопатического гемолиза, вероятно, не редкость при синдроме ТМА и встречается даже при аГУС и ТТП [11] Для наименования прогрессирующего поражения почек у пациентов, перенесших острый эпизод аГУС и в дальнейшем не имеющих гематологических проявлений болезни, нами был предложен термин «субклиническая ТМА» [12]. По-видимому, субклиническая ТМА наиболее характерна именно для ЗАГ. Наше предположение согласуется с результатами исследования, выполненного T. Akimoto et al., в котором гематологические проявления ТМА имелись только у 7 из 16 обследованных больных злокачественной АГ и тяжелой почечной недостаточностью, тогда как у 9 тромбоцитопения и признаки микроангиопатического гемолиза отсутствовали [13]. Причины диссонанса между гематологической составляющей синдрома ТМА и ее морфологической картиной при ЗАГ до конца не ясны. Данный феномен, на наш взгляд, может быть обусловлен недостаточной выраженностью либо недостаточной протяженностью поражения почечного микроциркуляторного русла (МЦР). Такое объяснение соответствует предположению H.M. Tsai, который полагает, что небольшой площади повреждения эндотелия почечного МЦР при преимущественной локализации его в приносящих артериолах может оказаться достаточным для развития обусловленной ТМА ишемической нефропатии с активацией внутрипочечной РААС, ведущей к освобождению массы ренина и тяжелой АГ, однако не хватить для индукции микротромбообразования с потреблением тромбоцитов и системным микроангиопатическим гемолизом [6]. Справедливость этого мнения хорошо иллюстрируют особенности морфологической картины заболевания у наших пациентов. В обоих случаях в биоптатах почек особенно наглядны гистологические изменения клубочков, представленные ишемией капиллярных петель разной степени выраженности. Еще одним феноменом, обращающим на себя внимание, является резко суженный вплоть до полной окклюзии (за счет набухания эндотелиальных клеток, артериологиалиноза, миоинтимальной пролиферации и склероза интимы) просвет артерий малого калибра и артериол. Вероятно, подобная окклюзия сосудов почечного МЦР также может вносить свой вклад в формирование неполной ТМА: очевидно, что нетромботический генез стенозирования (тромбы МЦР у пациентов не обнаружены) в данном случае не способен вызывать тромбоцитопению потребления. С другой стороны, при локальном прекращении циркуляции крови в отдельных сосудах почечного МЦР вследствие их полной окклюзии исчезает возможность механического повреждения эритроцитов, являющаяся причиной микроангиопатического гемолиза. По-видимому, сочетание перечисленных механизмов и приводит к достаточно частому при ЗАГ отсутствию гематологических проявлений ТМА, несмотря на ее несомненную морфологическую картину, нарастающую почечную недостаточность и неконтролируемое повышение АД.
До настоящего времени патогенез ТМА при злокачественной АГ до конца не изучен. Полагают, что центральную роль в развитии ТМА в этом случае играет эндотелиальное повреждение, вызванное активацией РААС и нарастающим воздействием сил тока крови (shear stress), которые являются важным звеном патогенеза ЗАГ. Поврежденный эндотелий начинает экспрессировать провоспалительные цитокины, вещества, вызывающие вазоконстрикцию, активацию тромбоцитов и системы гемостаза, что в свою очередь способствует усилению эндотелиального повреждения и приводит к локальному микротромбообразованию и фибриноидному некрозу сосудистой стенки [8, 7, 14]. Однако развитие подобного сценария возможно только при тяжелой и/или достаточно длительно существующей АГ, когда действие компенсаторных механизмов, включающихся в ответ на активацию РААС (секреция клетками эндотелия вазодилататоров – простациклина, оксида азота), уже исчерпано. Таким образом, эндотелиальная дисфункция и повреждение клеток эндотелия служат той основой, которая объединяет злокачественную АГ и ТМА [7, 15]. Убедительным доказательством общности этих состояний является умеренное снижение активности ADAMTS13, выявляемое у больных со злокачественной АГ, как и при большинстве других микроангиопатических синдромов. В исследовании B.J. van der Born et al. было продемонстрировано снижение активности ADAMTS13 у больных ЗАГ не только по сравнению с нормотензивными пациентами, но и с пациентами, имеющими тяжелую АГ, однако в последнем случае различия не достигли статистической значимости [16]. Активность ADAMTS13 обратно коррелировала с уровнем фактора фон Виллебранда, который у больных ЗАГ оказался повышенным, что, по-видимому, отражает его избыточное освобождение из поврежденных клеток эндотелия [16], подтверждая роль эндотелиальной дисфункции в развитии ЗАГ. Активность ADAMTS13 у одного из наших пациентов также была несколько снижена и практически соответствовала данным, приведенным в литературе. Мы полагаем, что всем больным ЗАГ с поражением почек, у которых отсутствуют тромбоцитопения и микроангиопатический гемолиз, целесообразно определять активность ADAMTS13, снижение которой могло бы стать дополнительным аргументом в пользу возможной ТМА до выполнения нефробиопсии.
С нашей точки зрения, развитие ТМА у пациентов с ЗАГ может ускорить предрасположенность к микротромбообразованию вследствие генетических аномалий, о чем свидетельствует пример наших больных. У обоих мужчин было выявлено по нескольку полиморфизмов генов гемостаза (6 – у первого пациента, 3 – у второго), причем спектр их оказался схожим.
В обоих случаях обнаружены гетерозиготные мутации гена PAI1 и генов, кодирующих ферменты фолатного цикла, в т.ч. MTHFR C677T и MTRR A66G. У первого больного, кроме того, имелись полиморфизмы генов ITGA2 C807T, MTR A2756G и MTHFR A1298C. Генетический дефект ферментов фолатного цикла сопровождался у него умеренной гипергомоцистеинемией.
Ранее в нескольких исследованиях была продемонстрирована возможность развития ренальной ТМА, аналогичной таковой при АФС, у больных с генетическими аномалиями в системе свертывания крови. В биоптатах почек этих пациентов обращала на себя внимание выраженность склеротических изменений клубочков и интерстиция, а также сосудистых изменений, причем наибольшей «профиброгенностью» отличалось сочетание мутантных аллелей 4G гена PAI и T гена MTHFR. Двойной гетерозиготный полиморфизм гена MTHFR C677CT/1298AC, как оказалось, предрасполагал к развитию нефроангиосклероза и почечной недостаточности у пациентов с АГ [17–20]. Можно предположить, что локально почечное нарушение фибринолиза вследствие мутации гена PAI1 способствует тромбообразованию в сосудах МЦР почек, а гипергомоцистеинемия, к которой приводит генетический дефект фолатного цикла, является дополнительным фактором, повреждающим сосудистый эндотелий и, следовательно, усиливающим протромбогенные тенденции. Результатом этих процессов является нарастающая ишемия почечной ткани, приводящая к ускоренному развитию нефросклероза и прогрессированию почечной недостаточности. Вклад генетической тромбофилии в формирование ТМА, ассоциированной с ЗАГ, безусловно, может обсуждаться, однако необходимы дальнейшие исследования в этой области. Нельзя исключать, что нарушения в системе гемостаза могут исполнять роль «второго удара», дополняющего воздействие другого, возможно, основного, механизма.
Таким механизмом, приводящим к развитию ТМА при ЗАГ, может оказаться дисрегуляция альтернативного пути активации комплемента вследствие генетического дефекта белков-регуляторов. Более того, в некоторых последних публикациях авторы высказывают предположение, будто ТМА, ассоциированную со злокачественной АГ, можно рассматривать как один из вариантов течения атипичного ГУС. Основанием для этого предположения стало исследование M. Noris et al., в котором при генетическом обследовании 191 пациента с аГУС у двух из 14 больных ЗАГ, предшествовавшей острому эпизоду ТМА и расцененной как комплемент-активирующее состояние, были обнаружены мутации, ассоциированные с развитием аГУС, в генах белков-регуляторов АПК [4]. Правомерность гипотезы о комплемент-опосредованной природе ЗАГ подкрепляет наблюдение H.M. Tsai, описавшего пациента, который несколько лет страдал трудноконтролируемой злокачественной АГ с эпизодами транзиторного нарушения функции почек, но без тромбоцитопении и признаков микроангиопатического гемолиза, а в последующем продемонстрировал развернутую клиническую картину атипичного ГУС с поражением почек, ЦНС и ЖКТ. Назначение комплемент-блокирующей терапии Экулизумабом не только позволило купировать все проявления острого эпизода ТМА, но и привело к стабилизации АД на цифрах, не превышавших 140/90 мм рт.ст. [21] Таким образом, в идентификации природы ТМА, ассоциированной с ЗАГ, перспективным направлением является изучение роли генетических аномалий регуляции альтернативного пути активации комплемента.
Заключение
Представленные клинические наблюдения демонстрируют развитие тяжелого полиорганного поражения у лиц с ЗАГ, причиной которого, скорее всего, является системная ТМА. Основной вклад в ее формирование при ЗАГ вносят дисфункция и повреждение эндотелия сосудов почечного МЦР. Причины эндотелиального повреждения и тромбообразования многообразны, не ограничены только механизмами активации РААС и shear stress и нуждаются в дальнейшем изучении. Среди возможных направлений исследования приоритет следует отдавать комплексному изучению системы комплемента при ЗАГ, включая маркеры активации и генетические дефекты АПК. Активация свертывающей системы крови как следствие генетической тромбофилии может оказаться дополнительным комплемент-активирующим фактором, ускоряющим развитие ТМА.



