Тромботическая микроангиопатия (ТМА) представляет собой клинико-морфологический синдром, в основе которого лежит эндотелиальная дисфункция сосудов микроциркуляторного русла с их воспалением, развитием в них генерализованных тромбозов, в итоге приводящих к органной недостаточности [1].
Одной из патофизиологических основ развития ТМА является избыточная активация альтернативного пути комплемента с формированием мембраноатакующих комплексов, приводящих к осмотическому лизису собственных клеток организма путем образования в ее стенке трансмембранного канала [2].
Системная красная волчанка (СКВ) представляет собой аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов. Заболеваемость СКВ колеблется от 4 до 250 случаев на 100 тыс. населения, при этом женщины страдают в 8–10 раз чаще мужчин. Смертность при СКВ в 3 раза выше, чем в популяции.
Волчаночный нефрит (ВН) – одно из самых частых клинических и грозных проявлений СКВ, приводящих к инвалидизации пациентов (особенно при прогрессировании до терминальной почечной недостаточности) и несущих значительное экономическое бремя для системы здравоохранения в целом ввиду необходимости пожизненного проведения пациентам данной группы заместительной почечной терапии [3, 4].
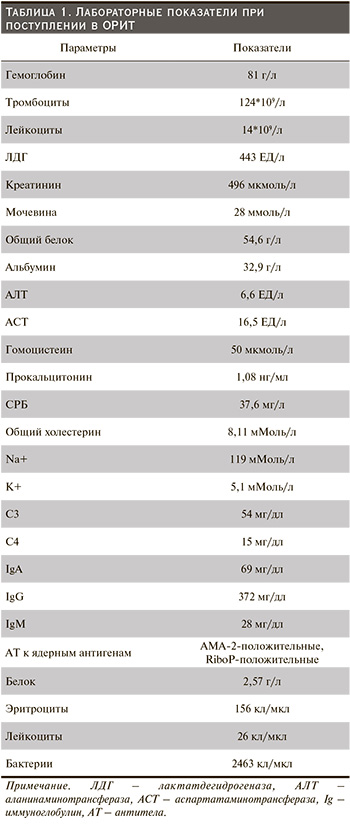
С учетом приобретающей хронический характер активации системы комплемента c функциональным нарушением работы регуляторных белков СКВ является одним из факторов риска развития комплемент-опосредованной тромботической микроангиопатии (рис. 1) с частотой встречаемости до 20% в подгруппе пациентов с ВН, при котором частота частичного или полного восстановления почечной функции составляет всего лишь 44%, что указывает на необходимость поиска альтернативных подходов к терапии пациентов данной группы [5, 6].
Поскольку клинические и лабораторные проявления комплемент-опосредованной ТМА (КО-ТМА), связанной с ВН, не отличимы от таковой при атипичном гемолитико-уремическом синдроме (аГУС), применение препаратов из группы ингибиторов компонента комплемента С5 (экулизумаб) у данной группы пациентов явилось вполне логичным результатом поиска патогенетически обоснованной терапии ВН, особенно в случаях рефрактерности ВН к проводимой терапии с непрерывным прогрессированием почечного повреждения [7, 8].
В ходе клинических исследований препарата Элизария была показана его эффективность и подтверждена биоаналогичность оригинальному экулизумабу [9–11]. Также накоплен опыт эффективного применения препарата пациентами различных категорий с аГУС [12–14]. Вместе с тем в России имеется ограниченное число публикаций, посвященных применению экулизумаба при ТМА у больных СКВ [15].
В данном собственном клиническом наблюдении наглядно представлен опыт успешного применения ингибитора комплемента экулизумаба (Элизария) в лечении ассоциированной с ВН КО-ТМА, рефрактерной к плазмообмену, глюкокортикостероидам и проведенной ранее иммуномодулирующей терапии.
Клинический случай
Пациентка М. 21 года госпитализирована в отделение реанимации и интенсивной терапии ГКБ № 52 переводом из ФГБНУ НИИР им. В.А. Насоновой в связи с прогрессированием хронической болезни почек, развитием острого почечного повреждения и явлениями гипергидратации, что потребовало проведения сеансов заместительной почечной терапии (ЗПТ).
Из анамнеза: первые симптомы появились летом 2016 г. в виде болей боли в суставах. При лабораторном обследовании отмечалась анемия тяжелой степени (гемоглобин – 87 г/л), повышенный уровень С-реактивного белка (СРБ) – 38 г/л, лейкопения до 3,0*109/л. Пациентке был выставлен диагноз «ювенильный артрит», начато лечение по месту жительства препаратами Найз, Сульфасалазин, Диклофенак, Актефферин без значимого эффекта. В ноябре 2016 г. пациентка была госпитализирована в ФГБНУ НИИР им. В.А. Насоновой в связи с ухудшением состояния, проявившегося в виде появления субфебрилитета, усиления болей в суставах. При обследовании были выявлены повышенные титры антител к двуцепочечной ДНК (более 200 ЕД/л), антинуклеарный фактор (АНФ) (1/640 h), в связи с чем был установлен диагноз «системная красная волчанка», проведена пульс-терапия метилпреднизолоном в суммарной дозе 750 мг с последующим началом перорального приема Метипреда в дозе 16 мг/сут. и Плаквенила 200 мг/сут.
В течение 4 лет (с 2016 по 2020 г.) пациентка за медицинской помощью не обращалась. В июне 2020 г. в связи с нарастанием отеков лица и нижних конечностей она была повторно госпитализирована в ФГБНУ НИИР им. В.А. Насоновой. При лабораторном обследовании сохранялась высокая иммунологическая активность СКВ, сопровождавшаяся высоким титром антител к ДНК (более 200 ЕД/л), АНФ (1/2560 h), положительной прямой пробой Кумбса (++++). По данным биохимического анализа крови, отмечалось повышение уровня креатинина до 130 мкмоль/л и мочевины до 18 ммоль/л. В общем анализе мочи впервые была зарегистрирована протеинурия до 1 г/л, эритроцитурия до 180 кл/мкл. С учетом полученных данных у пациентки диагностирован волчаночный гломерулонефрит и проведена пульс-терапия метилпреднизолоном в суммарной дозе 1500 мг. В ноябре 2020 г. с учетом тяжелого поражения почек инициирована анти-В-клеточная терапия ритуксимабом в дозе 1000 мг. Далее в связи с эпидемиологической обстановкой пациентка у врачей не наблюдалась.
В апреле 2022 г. при очередном обследовании зарегистрировано нарастание показателей азотемии (креатинина 323 мкмоль/л, мочевины 24,4 ммоль/л), увеличение объема суточной протеинурии до 4 г/л, в связи с чем в рамках лечения обострения люпус-нефрита доза принимаемого перорально метилпреднизолона была увеличена до 48 мг/сут. В июне 2022 г. в связи с прогрессированием почечной недостаточности, выраженным нарастанием показателей азотемии (мочевины 37 ммоль/л, креатинина 646 мкмоль/л), развитием инфекции мочевыводящих путей (лейкоцитурии до 500 кл/мкл) пациентка была повторно госпитализирована в ФГБНУ НИИР им. В.А. Насоновой, где по жизненным показаниям была инициирована ЗПТ. В связи с необходимостью продолжения ЗПТ пациентка была переведена в ГБУЗ ГКБ № 52 в отделение нефрологической реанимации.
При поступлении в ОРИТ в лабораторных данных выявлен ряд изменений (табл. 1).
С учетом выявленной высокой активности СКВ (по SLEDAI-17) запланировано усиление патогенетической терапии путем введения ритуксимаба 1000 мг, однако в связи с проявлениями активного системного воспаления на фоне инфекции мочевыводящих путей его введение было отложено до разрешения воспалительного процесса и инициирована антимикробная терапия.
На 3-и сутки пребывания больной в стационаре в условиях ОРИТ с целью верификации степени почечного повреждения выполнена биопсия почки. Проведена окраска биоптатов с использованием гематоксилин-эозина, ШИК-реакции, трихром по Массону. В препаратах для световой микроскопии и иммунофлюоресценции суммарно было определено девять клубочков, три из которых были полностью склерозированы. Еще в трех клубочках определялись крупные участки сегментарного склероза капиллярных петель с остаточной эндокапиллярной гиперклеточностью и образованием грубых сращений с капсулой Боумена в т.ч. по типу сегментарных фиброзного и фиброзно-клеточного полулуний в двух из них. Оставшиеся клубочки были немного увеличены в размерах, отмечалась мезангиальная и эндокапиллярная гиперклеточность. При окраске по Массону определялись отдельные фуксинофильные депозиты в мезангии и на периферии капиллярных петель, в т.ч. по типу «гиалиновых тромбов» в одном клубочке.
Стенки капиллярных петель были утолщены и преимущественно одноконтурные. Диффузно-очаговый фиброз интерстиция и атрофия канальцев занимали около 50% почечной паренхимы. Отмечалась диффузно-очаговая инфильтрация интерстиция мононуклеарами в зонах фиброза без явлений тубулита.
Сохранные канальцы были гипертрофированы. Имелась одна частично срезанная артерия среднего/малого калибра с расширением субэндотелиального пространства и формирующимся фиброзом интимы. Просвет артериол был сужен за счет набухания эндотелиальных клеток, расширения субэндотелиального пространства, мукоидного набухания и склероза интимы (рис. 2). По данным иммунофлуоресценции: IgG – мезангий и периферия капиллярных петель гранулярно ++, сосуды+, IgA – то же, что IgG+, IgM – то же, что IgG+, С3 – то же, что IgG+++ сосуды+, C1q – то же, что IgG+сосуды+, Каппа – нет, Лямбда – нет.
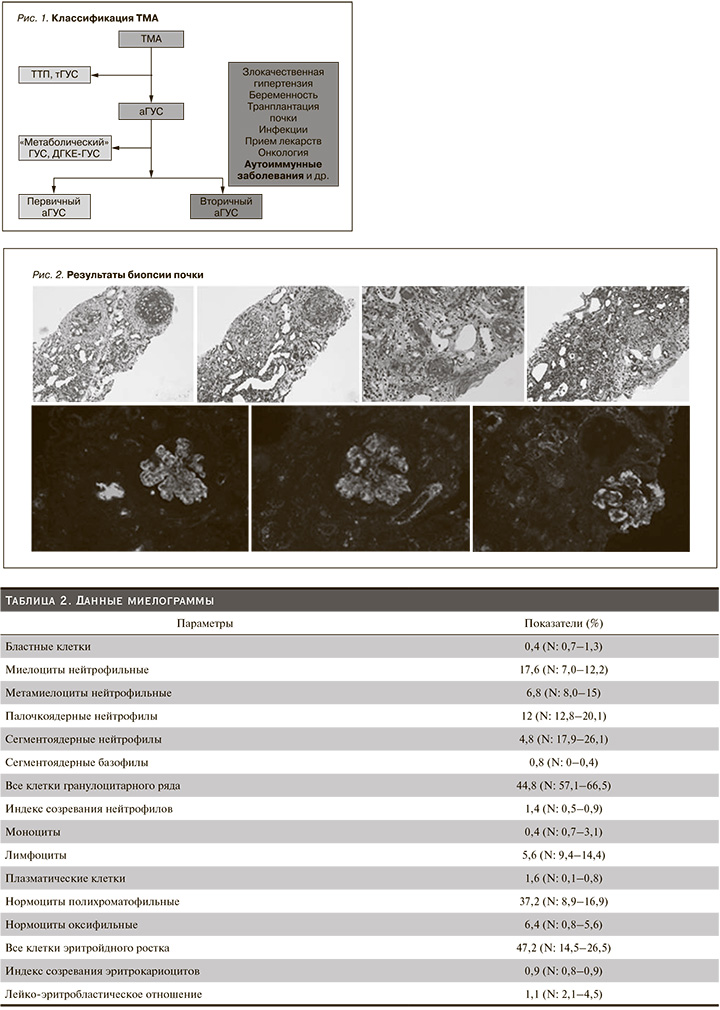
Таким образом, по результатам биопсии выявлены признаки диффузного пролиферативного и склерозирующего гломерулонефрита с элементами тромботической микроангиопатии. Морфологическая картина соответствовала ВН (IV класс) AI-7 CI-10. Изменения сосудов малого калибра, вероятно, были проявлением АФС-нефропатии либо волчаночной васкулопатии.
Принимая во внимание данные биопсии, тяжесть почечного поражения, принято решение об усилении патогенетической терапии начиная с 7-х суток нахождения в стационаре, проведено 7 сеансов высокообъемного плазмообмена с пульс-терапией метилпреднизолоном (125 мг до начала процедуры, 250 мг после проведения процедуры), с однократным введением Циклофосфамида 400 мг, введением иммуноглобулина человеческого с целью коррекции имевшего место вторичного иммунодефицита.
Несмотря на проведенную интенсивную терапию, у пациентки за время нахождения в условиях ОРИТ сохранялась потребность в проведении сеансов ЗПТ, в междиализный период обращало на себя внимание значительное нарастание показателей азотемии, сохранялась олигурия, отмечалось нарастание клинических признаков гипергидратации. Артериальная гипертензия достигала 210/160 мм рт.ст., трудно контролировалась и требовала проведения непрерывной парентеральной антигипертензивной терапии на фоне максимальных доз комбинированной поликомпонентной пероральной антигипертензивной терапии. Через 2 недели после окончания процедур плазмообмена по данным эндоскопического исследования из нижних отделов тонкого кишечника развилось желудочно-кишечное кровотечение, потребовавшее многократных заместительных гемотрансфузий различных сред (ЭВФ, КТА, свежезамороженной плазмы – СЗП) на фоне сохранившихся анемии, тромбоцитопении. Для контроля инфекционного процесса мочевыводящих путей проводилась смена антибактериальной терапии. Также с учетом выявления активной ЦМВ (цитомегаловирус)-инфекции использовался ганцикловир.
Для оценки активности СКВ и адекватности проведенной терапии повторно определяли уровень антител к двухспи- ральной ДНК, результат которого был отрицательный (50 МЕ/мл), сохранялась гипокомплементемия с уровнем компонентов комплемента С3 – 62 мг/дл и С4 – 10 мг/дл.
На 26-е сутки нахождения в стационаре отмечено развитие второго эпизода желудочно-кишечного кровотечения, потребовавшего проведения оперативного вмешательства в объеме лапароскопической аппендэктомии (рис. 3).
По результатам полученной биопсии удаленного аппендикса были выявлены признаки продуктивного васкулита с микротромбозами в стенке (рис. 4).
С учетом прогрессирующей панцитопении выполнялась стернальная пункция с целью исключения гемофагоцитарного синдрома, вирусного поражения костного мозга. Исходя из полученных данных миелограммы (табл. 2), гемограммы, уровня плазменного ферритина, данных за гемофагоцитарный синдром не получено, при динамической оценке полимеразной цепной реакции к ЦМВ получен отрицательный результат.
Снижение показателей крови, вероятно, имело транзиторный характер и служило следствием сочетания миелотоксических факторов (применение циклофосфамида, ганцикловира); проведение стимуляции миелопоэза не рекомендовано.
На фоне проводимой комплексной терапии, в т.ч. в рамках усиления патогенетической терапии (7 сеансов ТРЕ, циклофосфамид) у пациентки с высокой степенью активности СКВ (SLEDAI-2K=31 балл) сохранялись следующие клинические и лабораторные проблемы:
- стойкая, трудно поддающаяся коррекции артериальная гипертензия на многокомпонентной терапии в максимально разрешенных дозировках, включающая в себя внутривенное введение натрия нитропруссида;
- рецидивирующие кишечные кровотечения из аппендикса, солитарных язв печеночного изгиба толстой кишки, эрозивно-геморрагического энтероколита;
- острое почечное повреждение с потребностью в продолжении проведения процедур заместительной почечной терапии;
- сохраняющаяся гипокоагуляция, обусловленная в основном снижением плотности сгустка за счет персистирующей тромбоцитопении (по данным тромбоэластографии), не поддающейся коррекции заместительными гемотранс-фузиями;
- анемия тяжелой степени тяжести, требующая проведения заместительной гемотрансфузии эритроцитарных сред.
После проведения консилиума при наличии исключающих данных за тромбоцитопеническую пурпуру, катастрофический антифосфолипидный синдром и с учетом клинико-лабораторной картины по жизненным показаниям после предварительной профилактической иммунизации противоменингококковой вакциной был начат начальный цикл терапии экулизумабом в дозе 900 мг в/в капельно 1 раз в неделю в течение первых 4 недель с дальнейшим переходом на фазу поддерживающей терапии в дозе 1200 мг каждые 2 недели.
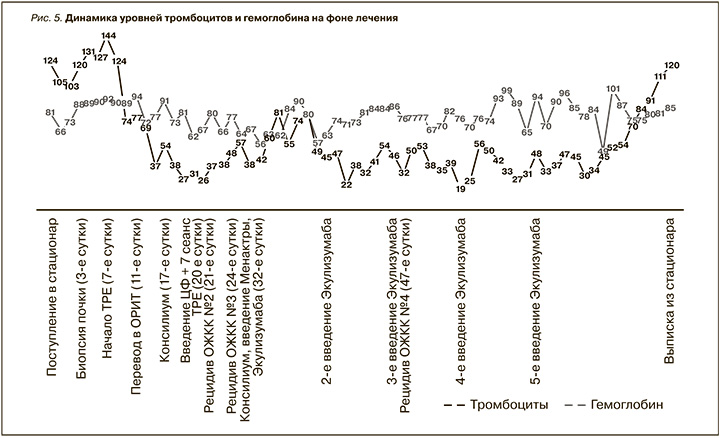
Через 4,5 недели от начала терапии ингибитором С5 компонента комплемента экулизумабом отмечалось постепенное нарастание и стабилизация уровня как тромбоцитов, так и гемоглобина с прекращением постоянных гемотрансфузий (рис. 5). Клинически за это время отмечалось нарастание темпа диуреза до 300–350 мл/сут. После полученного положительного эффекта при стационарном лечении пациентка выписана на амбулаторный этап с последующим введением экулизумаба в дозе 1200 мг каждые 2 недели. После выписки с учетом олигоанурии при концентрации креатинина в плазме крови около 300–350 мкмоль/л при небольшой массе тела (около 49 кг сухого веса), а также сохраняющихся периферических отеках пациентке продолжены сеансы гемодиализа в интермиттирующем режиме на манжеточном центральном венозном катетере амбулаторно. При лабораторном обследовании в общем анализе крови отмечали стабилизацию уровня гемоглобина – 105 г/л, тромбоцитов – 147*109/л. На фоне проводимого лечения у пациентки отсутствовали рецидивы кишечного кровотечения и стабилизировалось артериальное давление на уровне заданных целевых значений.
Обсуждение
В данном клиническом случае представлено развитие КО-ТМА у пациентки с ВН высокой степени активности (IV типа), подтвержденной выполненной во время госпитализации биопсией и частичным ответом на проводимую комбинированную патогенетическую терапию. Важным аспектом данного клинического случая явилось то, что у пациентки на фоне проводимого ей лечения в условиях проводимых сеансов высокообъемного терапевтического плазмообмена рецидивировало жизнеугрожающее осложнение в виде массивного кишечного кровотечения, сохранялась потребность в массивной трансфузионной терапии различных компонентов крови на фоне сохраняющейся микроангиопатической гемолитической анемии и тромбоцитопении, при этом использование 5 доз (в нашем случае) экулизумаба привело к полному лабораторно подтвержденному прекращению гемолиза, стабилизации уровня тромбоцитов, устранению рецидивов ранее выявленного диффузного кишечного кровотечения.
Заключение
В данном клиническом наблюдении продемонстрирована высокая эффективность и безопасность экулизумаба в лечении взрослой пациентки с КО-ТМА и СКВ с рефрактерностью к плазмообмену, глюкокортикостероидам и иммуномодулирующей терапии. Следует подчеркнуть, что на фоне высокой активности заболевания комплементблокирующая терапия позволила в относительно короткие сроки добиться клинически значимого эффекта с достижением стойкой клинико-лабораторной ремиссии заболевания.
Очевидно, что применение таргетной терапии экулизумабом при КО-ТМА может быть патогенетически оправданным вариантом ее лечения. Проведение исследований в этом направлении и получение дополнительного опыта использования препарата пациентами с данной патологией могут дать дополнительную информацию о возможности и условиях применения экулизумаба при КО-ТМА.



